丙泊酚对糖氧剥夺再灌注诱导星形胶质细胞损伤影响及其机制
宋海军,杨族悌,刘军,刘国磊
(1 南阳南石医院麻醉科,河南 南阳 473000;2 河南省直第三人民医院麻醉科)
星形胶质细胞是广泛分布于哺乳动物脑内的一类非神经元细胞,在脑缺血病理过程中发挥着保护和损伤神经元的双重作用[1-3]。高迁移率族蛋白1(HMGB1)是细胞核内一种高度保守的非组蛋白,可作为促炎因子和预警蛋白在先天性免疫应答、炎症反应及细胞凋亡等过程中发挥着重要作用[4-6]。研究证实,HMGB1在脑缺血后大量升高,且可通过促进炎症递质的释放和调控星形胶质细胞凋亡在脑缺血病理过程中发挥着重要作用[7]。丙泊酚是一种临床手术过程中常见的静脉麻醉药,被证实可通过抑制细胞凋亡和炎症递质的释放在脑损伤过程中发挥保护作用[8-9]。近年研究显示,丙泊酚可通过抑制小胶质细胞HMGB1的表达调控脑损伤免疫炎症系统[10],但HMGB1在丙泊酚保护脑缺血诱导的星形胶质细胞损伤中的作用并不清楚。脑皮质星形胶质细胞糖氧剥夺再灌注模型是研究体内脑缺血常用的细胞模型[11],本研究从细胞凋亡和炎症反应角度出发,首次探讨HMGB1在丙泊酚保护糖氧剥夺再灌注诱导的星形胶质细胞损伤中的作用,以期为阐明丙泊酚保护脑损伤的分子机制提供新依据。
1 材料与方法
1.1 实验材料
SPF级新生Wistar大鼠(体质量12~15 g)购于山东省实验动物中心。胎牛血清、DMEM高糖培养液和DMEM无糖培养液购于美国Gibco公司。丙泊酚购于美国Sigma公司。兔抗B细胞淋巴瘤/白血病-2(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体和β-肌动蛋白(β-actin)抗体均购于美国CST公司,兔抗活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved caspase-3)抗体和HMGB1抗体购于美国Abcam公司。噻唑蓝(MTT)试剂和乳酸脱氢酶(LDH)试剂盒购于南京建成生物工程研究所,BCA蛋白检测试剂盒购于美国Pierce公司。细胞凋亡检测试剂盒、ECL试剂盒及肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和HMGB1的ELISA试剂盒购于上海碧云天公司。pcDNA3.1-HMGB1过表达载体质粒购于BioVector质粒载体菌种细胞基因保藏中心。
1.2 实验方法
1.2.1实验分组与处理 将新生大鼠处死分离出大脑皮质后,剥离脑膜和血管等结构,将获得的星形胶质细胞参照文献方法[12]检测纯化培养后以每孔3×105个细胞种植于96孔细胞板上。实验分为5组,分别为对照组(A组)、模型组(B组)、模型+丙泊酚组(C组)、模型+丙泊酚+空载体组(D组)和模型+丙泊酚+HMGB1组(E组)。其中后4组行糖氧剥夺再灌注处理:弃原培养液后,加入无糖DMEM培养液,放入低氧(含体积分数0.02的O2)培养箱中于37 ℃下培养6 h(即糖氧剥夺处理);后3组给药处理:加入含10 μmol/L丙泊酚的无糖DMEM培养液。糖氧剥夺处理6 h后,从低氧培养箱中取出并弃无糖培养液,加入含10 μmol/L丙泊酚的含糖培养液并培养24 h,置于含体积分数0.05 CO2的37 ℃恒温培养箱内培养24 h(即再灌注处理)。模型+丙泊酚+空载体组:在糖氧剥夺处理前,参照脂质体2000说明书步骤加入pcDNA3.1空载体质粒转染48 h。模型+丙泊酚+HMGB1组:在糖氧剥夺处理前,参照脂质体2000说明书步骤加入pcDNA3.1-HMGB1过表达载体质粒转染48 h。转染pcDNA3.1空载体质粒作为转染pcDNA3.1-HMGB1过表达载体质粒的阴性对照,以排除转染质粒对实验结果的干扰。
1.2.2MTT法检测细胞存活率 收集处理结束后的各组细胞,按照每孔105个细胞密度种植于96孔细胞板上,置于含体积分数0.05 CO2的37 ℃恒温培养箱内培养48 h,加入浓度为5 g/L的MTT溶液20 μL孵育4 h。再以200 μL二甲基亚砜孵育20 min使蓝紫色结晶完全溶解。使用酶标仪检测各组细胞在490 nm波长处的吸光度(A)值。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A组)×100%。实验重复3次。
1.2.3流式细胞仪检测细胞凋亡率 收集处理结束后的各组细胞,参照细胞凋亡检测试剂盒说明书步骤,上流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.2.4ELISA法检测细胞上清液中HMGB1、IL-6和TNF-α含量 收集处理结束后的各组细胞上清液,参照ELISA试剂盒说明书步骤检测细胞上清液中HMGB1、IL-6和TNF-α含量。实验重复3次。
1.2.5比色法检测细胞LDH漏出率 收集各组细胞培养液,根据LDH试剂盒说明书步骤分别检测培养液和细胞内的LDH活性。LDH漏出率=培养液中LDH活性/(细胞内LDH活性+培养液中LDH活性)×100%。实验重复3次。
1.2.6Western blot检测细胞中HMGB1、Bcl-2、Bax和Cleaved caspase-3蛋白的表达 在冰上向收集到的各组细胞中加入RIPA细胞裂解液提取细胞总蛋白,以BCA定量法检测蛋白的浓度。在SDS-RIPA凝胶电泳分离后,电转至PVDF膜上。将膜置于含50 g/L脱脂奶粉的TBST液中处理1 h后,加入使用TBST稀释的HMGB1抗体(1∶1 000)、Bax抗体(1∶500)、Bcl-2抗体(1∶500)、Cleaved caspase-3抗体(1∶1 000)、β-actin抗体(1∶1 000)于4 ℃下结合反应24 h,再以TBST稀释的二抗(1∶2 000,辣根过氧化酶标记)室温孵育1.5 h。蛋白条带在Quantity One软件中进行半定量分析,以β-actin为内参照。实验重复3次。
1.3 统计学分析

2 结 果
2.1 各组细胞中的HMGB1蛋白表达和上清液中HMGB1、IL-1β及TNF-α含量比较
与对照组相比,模型组细胞内HMGB1蛋白表达水平和细胞上清液中HMGB1、IL-1β、TNF-α含量均显著升高(F=171.199~391.008,q=28.058~49.269,P均<0.01);与模型组相比,模型+丙泊酚组细胞内HMGB1蛋白的表达水平以及HMGB1、IL-1β和TNF-α的含量均显著降低(q=22.531~35.032,P<0.01);与模型+丙泊酚组比较,模型+丙泊酚+HMGB1组细胞内HMGB1蛋白的表达水平以及HMGB1、IL-1β和TNF-α的含量均显著升高(q=14.811~23.987,P均<0.01),而模型+丙泊酚+空载体组中则没有见显著改变(P>0.05)。见图1和表1。
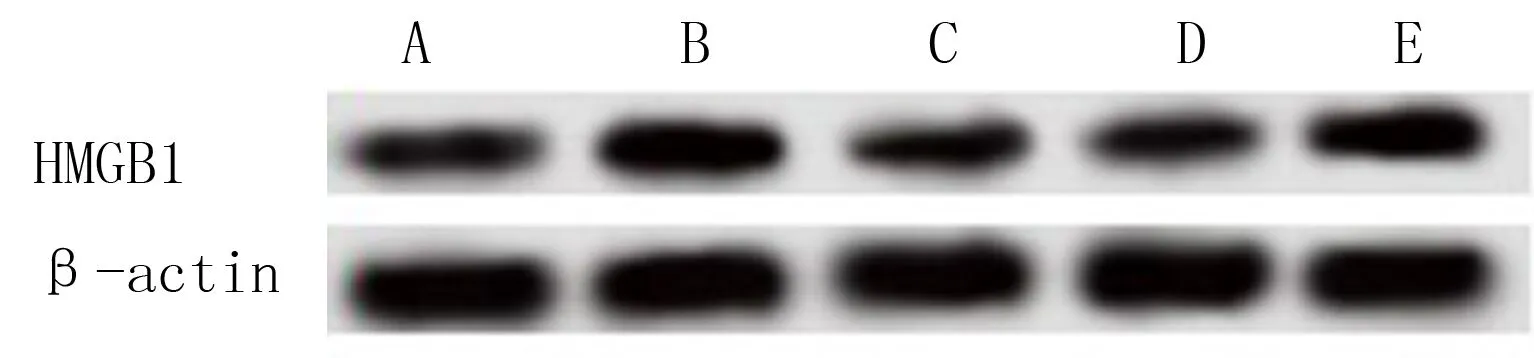
A:对照组,B:模型组,C:模型+丙泊酚组,D:模型+丙泊酚+空载体组,E:模型+丙泊酚+HMGB1组。

表1 各组细胞HMGB1蛋白表达及上清液HMGB1、IL-1β和TNF-α含量比较
2.2 各组细胞存活率和LDH漏出率的比较
与对照组相比,模型组细胞存活率显著降低,而LDH漏出率显著升高(F=167.790、349.324,q=33.505、47.940,P均<0.01);与模型组相比,模型+丙泊酚组细胞存活率显著升高,而LDH漏出率显著降低(q=21.751、24.714,P均<0.01);与模型+丙泊酚组相比较,模型+丙泊酚+空载体组细胞存活率和LDH漏出率均未见显著改变(P>0.05),但模型+丙泊酚+HMGB1组细胞存活率显著降低,而LDH漏出率显著升高(q=13.038、17.792,P<0.01)。见表2。
表2 各组细胞存活率和LDH漏出率的比较
2.3 各组细胞凋亡率的比较
对照组、模型组、模型+丙泊酚组、模型+丙泊酚+空载体组和模型+丙泊酚+HMGB1组的细胞凋亡率分别为(2.16±1.02)%、(32.25±2.36)%、(13.58±1.12)%、(12.16±1.05)%和(23.85±1.37)%,多组间比较差异有显著性(F=184.887,P<0.05)。与对照组比较,模型组细胞凋亡率显著升高(q=35.390,P<0.05);与模型组比较,模型+丙泊酚组细胞凋亡率显著降低(q=21.958,P<0.05);与模型+丙泊酚组相比较,模型+丙泊酚+HMGB1组凋亡率显著升高(q=12.079,P<0.05),而模型+丙泊酚+空载体组凋亡率未见显著改变(P>0.05)。见图2。

A:对照组,B:模型组,C:模型+丙泊酚组,D:模型+丙泊酚+空载体组,E:模型+丙泊酚+HMGB1组。
2.4 各组细胞凋亡相关蛋白Bcl-2、Bax和Cleaved caspase-3的比较
与对照组相比,模型组细胞Bcl-2蛋白表达水平降低,而Bax和Cleaved caspase-3蛋白的表达水平显著升高(F=81.619~165.223,q=24.398~33.331,P均<0.05);与模型组相比,模型+丙泊酚组Bcl-2蛋白表达升高,而Bax和Cleaved caspase-3蛋白的表达水平显著降低(q=11.711~18.974,P均<0.05);与模型+丙泊酚组相比,模型+丙泊酚+HMGB1组细胞Bcl-2蛋白表达水平显著降低,而Bax和Cleaved caspase-3蛋白的表达水平显著升高(q=5.885~13.703,P均<0.01);但是,模型+丙泊酚+空载体组与模型+丙泊酚组相比较,细胞Bcl-2、Bax和Cleaved caspase-3蛋白的表达水平差异无显著性(P>0.05)。见图3和表3。
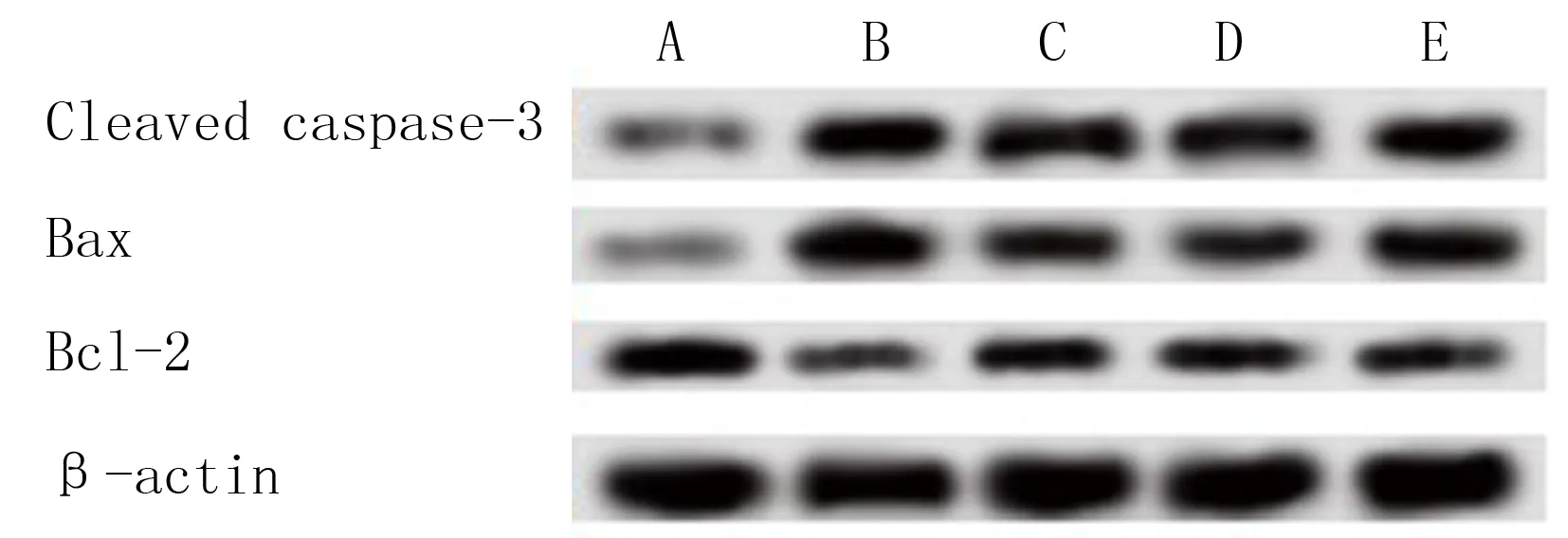
A:对照组,B:模型组,C:模型+丙泊酚组,D:模型+丙泊酚+空载体组,E:模型+丙泊酚+HMGB1组。

表3 各组细胞Bcl-2、Bax和Cleaved caspase-3蛋白表达比较
3 讨 论
HMGB1通常位于细胞核内,可被主动或被动释放到胞外,而胞外的HMGB1可通过与许多因子或受体作用,影响核转录因子-κB的活性,进而在免疫调节、炎症反应、细胞增殖和细胞凋亡等过程中发挥着调节作用[13]。HMGB1可加重缺血损伤,而靶向抑制HMGB1被认为是临床预防脑缺血损伤的重要策略[14-15]。本研究在构建的糖氧剥夺再灌注损伤星形胶质细胞模型中显示,HMGB1表达升高;同时,促炎因子IL-1β和TNF-α表达升高,星形胶质细胞存活率降低,凋亡率升高,促凋亡蛋白Bax和凋亡执行蛋白Cleaved caspase-3表达升高,而抑凋亡蛋白Bcl-2表达降低。李满等[12]研究指出,糖氧剥夺/复氧后释放的HMGB1可通过调控Bcl-2和Bax的表达促进星形胶质细胞损伤和凋亡。本研究结果与其类似,提示HMGB1在糖氧剥夺再灌注损伤的星形胶质细胞炎症反应和细胞凋亡过程中发挥着重要作用。
丙泊酚在抗炎和保护脑组织损伤方面发挥着重要作用[16-17]。刘波等[18]研究显示,低剂量的丙泊酚可通过抑制炎症反应改善脑缺血再灌注损伤。顾新宇等[19]研究证实,丙泊酚可激活ERK信号通路提高原代海马星形胶质细胞的细胞活力,在丙泊酚镇静过程中维持脑稳态。陆瑜等[20]发现,丙泊酚可通过抑制miR-181a并增强抑凋亡蛋白Bcl-2的表达对乏糖培养星形胶质细胞发挥保护作用。本研究结果也表明,丙泊酚对糖氧剥夺再灌注诱导的星形胶质细胞的活性降低、炎症反应加重和细胞凋亡能力增强等现象均有明显改善作用。同时,丙泊酚还可引起HMGB1表达降低。而WANG等[21]研究表明,丙泊酚可通过抑制脂多糖诱导的HMGB1表达和释放在脓毒症病人中起保护作用。张明晓等[10]研究证实,丙泊酚可通过激活p38 MAPK信号通路抑制TNF-α诱导小胶质细胞HMGB1表达,影响脑损伤晚期炎症反应。提示HMGB1在丙泊酚保护糖氧剥夺再灌注诱导的星形胶质细胞损伤过程中发挥着重要作用。为了证实这一推测,本研究通过上调HMGB1蛋白的表达显示,丙泊酚对糖氧剥夺再灌注诱导的星形胶质细胞损伤的保护作用明显逆转。说明丙泊酚可能通过下调HMGB1发挥保护糖氧剥夺再灌注诱导的星形胶质细胞损伤。
综上所述,丙泊酚可以通过抑制星形胶质细胞的凋亡和炎症反应改善糖氧剥夺再灌注损伤,而HMGB1表达下调是该保护过程的重要机制。该结果进一步丰富了丙泊酚保护脑缺血损伤的分子机制,但丙泊酚是如何从通路分子水平抑制HMGB1表达还有待进一步深入研究。

