再生固体牛粪垫料中细菌多样性分析及评价
刘建成,曾 军,丁 峰,许先查,窦晶晶,陈开旭,李凤鸣,高 雁
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091;3. 新疆机场(集团)天缘绿色产业有限责任公司,新疆昌吉 831100)
0 引 言
【研究意义】我国奶牛养殖业规模化、集约化程度不断提升[1]。我国奶牛存栏量1 400×104头,位居世界第3,每年牛粪排放量约6×108t,绝大部分作为有机废弃物还田或者随意堆放[2],造成其资源没有最大限度的被利用。牛床是奶牛主要的活动区域,奶牛每天有50%~60%的时间趴卧于牛床垫料上休息和反刍[3]。牛床垫料的舒适度直接影响奶牛的趴卧时间,影响其产奶性能、健康水平以及养殖场的经济效益,选择好的牛床垫料对于养殖场具有重要意义[3-5]。【前人研究进展】奶牛卧床垫料主要分为无机卧床垫料和有机卧床垫料。无机卧床垫料中常采用沙子、橡胶、水泥地面直接躺卧等。有机卧床垫料主要有锯末、木屑、稻壳等。牛粪制奶牛卧床垫料通常是直接晾晒以及好氧发酵,这些处理方式时间较长、占地面积大,直接晾晒的还存在病原菌数量多等问题,易引起奶牛乳房炎。近年来,随着牛粪垫料再生系统(BRU)的使用,牛粪被转化为含水率低(45%左右),无臭、松软、无球状颗粒料的再生固体牛床垫料(RMS),已经在英国、美国、加拿大、新西兰等国家普及使用[7-9]。与传统垫料相比,RMS不仅可以有效解决奶牛场的牛粪污染问题,而且可以减少购买垫料的资金投入,达到废物循环利用的效果,节约生产成本,提高经济效益[9]。RMS作为奶牛卧床垫料既可以改善卧床的舒适度、增加奶牛的卧床时间、提高奶产量,而且还可以降低奶牛肢蹄病的发生率[10-12]。【本研究切入点】经BRU系统处理后的RMS中仍然存在一定种类和数量的微生物,其群落组成、多样性以及在存放过程中的动态变化趋势目前外尚未见报道。评估牛粪垫料再生系统(Bedding Recovery Unit,BRU)处理的再生固体牛粪垫料(Recycled Manure Solids,RMS)的安全性。【拟解决的关键问题】研究运用高通量测序分析技术与传统细菌分离、鉴定技术相结合,对BRU系统处理前、处理后及RMS堆存期间物料中所含的细菌群落组成和多样性进行测定分析,评估通过牛粪垫料再生系统(BRU)处理的再生固体牛粪垫料(RMS)的安全性,为养殖场安全合理应用RMS提供理论依据和指导。
1 材料与方法
1.1 材 料
将奶牛粪污收集到接收池中,通过搅拌匀浆后,泵送至固液分离设备。经固液分离后把固体牛粪传送至滚筒式牛粪垫料再生系统(BRU)中,经60~65℃高温好氧自然发酵16~18 h后排出,堆放存储待用。
样品采集于新疆昌吉市某牛场,采集该牛场固液分离后的新鲜牛粪(S1)、经BRU系统发酵处理后出口处的牛粪(S2)以及堆存待用的再生固体牛粪垫料(S3)。样品S1和S2每2 h采集1次,每次采样500 g左右,连续5 d。将每天采集到的样品混匀后,作为平行样置于无菌管中液氮保存待检。样品S3是将堆存30 d后的RMS从上到下均分为5个切面,每个切面随机取5个点,采集物料表面以下50 cm深处的样品,每个点采样500 g左右,将以上样品在无菌条件下混匀后液氮保存待检。
1.2 方 法
1.2.1 温度
样品S1、S2和S3的物料温度测定使用手持式温度测定仪进行测定,BRU系统内的实时发酵温度通过温度感应器显示在设备的液晶仪表屏上。
1.2.2 水分和干物质含量
RMS水分及干物质的测定:准确称取样品25 g于烘干恒重的铝盒内,置于105℃恒温干燥箱内烘干至恒重,物料损失量即为水分含量,剩余物质量为干物质含量。
1.2.3 pH的测定
准确称取样品25 g于100 mL烧杯中,加50 mL蒸馏水,电磁搅拌10 min,用雷磁pH计进行测定。
1.2.4 微生物数量测定
样品中细菌总数参照GB/T 13093-2006《饲料中细菌总数的测定》方法进行。大肠杆菌参照GB/T 18869-2019《饲料中大肠菌群的测定》方法进行。金黄色葡萄球菌、无乳链球菌的测定:参照NT/T 2962-2016《奶牛乳房炎乳汁中金黄色葡萄球菌、凝固酶阴性葡萄球菌、无乳链球菌分离鉴定方法》进行。沙门氏菌参照GB/T 13091-2018《饲料中沙门氏菌的检测方法》进行。
1.2.5 细菌群落组成多样性
细菌群落组成多样性分析采用分子生物学高通量测序法,使用粪便基因组试剂盒提取样品中总DNA,通过琼脂糖凝胶电泳检测后进行16S rRNA基因PCR扩增。细菌高通量测序扩增16S rDNA V4区,使用引物为515F(GTGYCAGCMGCCGCGGTAA)和806R(GGACTACNVGGGTWTCTAA)[13]。PCR产物使用1%琼脂糖进行检测,将主带大小在400~450 bp的序列进行回收、纯化。使用New England Biolabs 公司的NEB Next®UltraTMDNA Library Prep Kit for Illumina试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测后,使用HiSeq进行上机测序,所有高通量测序相关工作由北京诺禾致源生物信息科技有限公司完成。基于有效数据进行OTUs聚类和物种分类分析,每个样本测序深度不低于3×104条,有效序列数不低于2×104条。
1.3 数据处理
每个样品做5个重复,数据使用Excel 2007进行描述性统计,用平均值±标准差表示(X±SD),采用SPSS 21.0软件对数据进行正态分布检验,对于符合正态分布的数据,其彼此之间比较采用方差分析,独立样本T检验,而对于不符合正态分布的数据采用非参数分析检验。
2 结果与分析
2.1 不同阶段样品理化指标比较
研究表明,与S1相比,牛粪固体物料(S2)经过BRU系统好氧发酵16~18 h后温度显著提升(P<0.01),pH和水分有所下降,干物质有所上升,但变化差异均不显著(P>0.05)。而经BRU系统处理后的牛粪在堆存30 d后,物料(S3)温度与S2相比显著降低(P>0.05),水分也继续显著降低,而干物质则显著升高(P>0.05)。与S1、S2相比,牛粪pH值呈现出上升趋势,但差异不显著(P>0.05)。表1

表1 不同阶段牛粪样品的理化指标Table 1 Changes of physical and chemical indexes in samples at different stages
2.2 不同阶段样品中可培养细菌总量、大肠杆菌、金黄色葡萄糖球菌、病原菌的数量变化
研究表明,奶牛粪污中细菌总数由S1至S3呈现出显著下降,其中固体牛粪经过BRU系统16~18 h高温好氧发酵后细菌总数下降了一个数量级(P<0.01),但RMS在推存30 d后细菌总数呈现出显著回升(P<0.01)。大肠杆菌数量与细菌总数呈现出相同趋势,在BRU系统处理后其数量极显著降低一个数量级(P<0.01),而RMS堆放30 d后,其大肠杆菌数量与S2相比增加了近4倍(P<0.01)。牛粪经过BRU系统处理后,金黄色葡萄球菌数量变化差异不显著(P>0.05),但均显著高于S3中数量,都在102cfu/g数量级上。无乳链球菌和沙门氏菌在所有样品中都未检到。表2
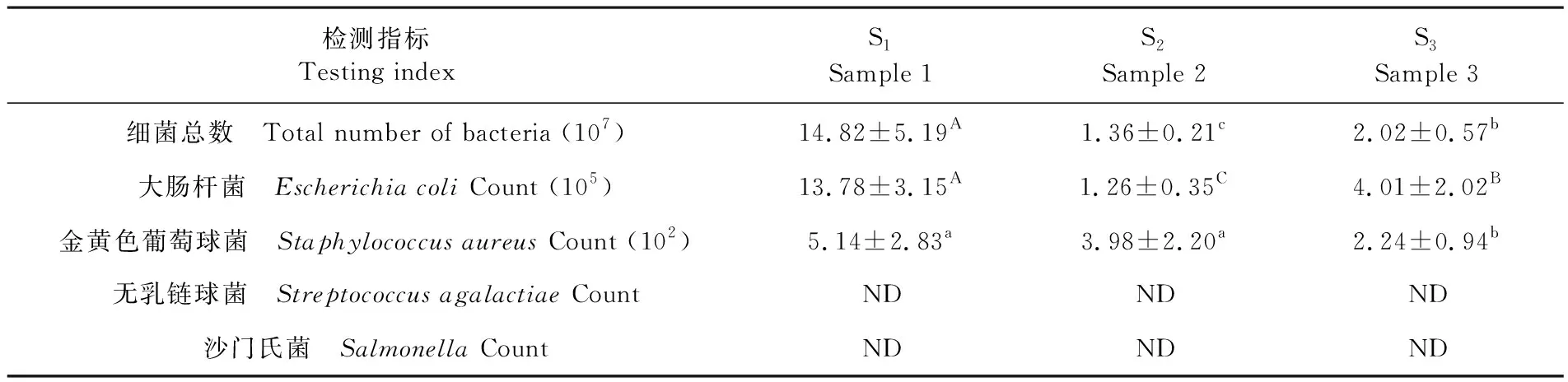
表2 不同阶段样品中微生物数量变化(n=5,cfu/g)Table 2 Changes of the number of microorganisms in different stages of samples
2.3 不同阶段样品中免培养病原细菌比较
研究表明,检测到3个样品中存在4个属的条件致病菌,分别为Aerococcussp.(气球菌属)、Facklamiasp.(费克蓝姆氏菌属)、Paeniclostridiumsp.(厌氧梭菌属)和Carnobacteriumsp.(肉杆菌属),并且这4个属全部为BRU系统处理前样品S1中优势类群,分别占细菌总数的(1.40%±0.8%)、(20.73%±3.97%)、(7.20%±2.35%)和(0.27%±0.15%),而经BRU系统处理后样品S2以及在堆放样品S3中均未检测到这些类群。
2.4 不同阶段样品中细菌Alpha多样性比较
研究表明,在3个不同阶段样品中分别获得24 801、22 134和21 098条细菌的16S rDNA序列。通过设立21 098条序列进行后续分析,得到多样性指数。研究表明,在该测序深度下3个样品的覆盖率均大于91.00%,测序深度具有代表性,涵盖了绝大多数的微生物群落组成。细菌Alpha多样性指数从S1至S3均呈现出极显著的下降趋势(P<0.01)。高温发酵16~18 h对于细菌多样性影响最大,表现在细菌OTU数量上减少了57.73%,细菌丰富度指数(ACE指数)降低了57.47%,香农多样性指数降低了81.63%。而经过堆放30 d的样品S3与S2相比OUT数量显著下降(P<0.01),下降了33.33%,细菌丰富度指数(ACE指数)降低了53.34%(P<0.01),但香农多样性指数却显著的增加了21.76%(P<0.01)。基于系统发育树的多样性指数(PD whole tree)同样展现出由S1~S3显著下降趋势(P<0.01),下降最为显著发生在S1向S2转变过程。表3
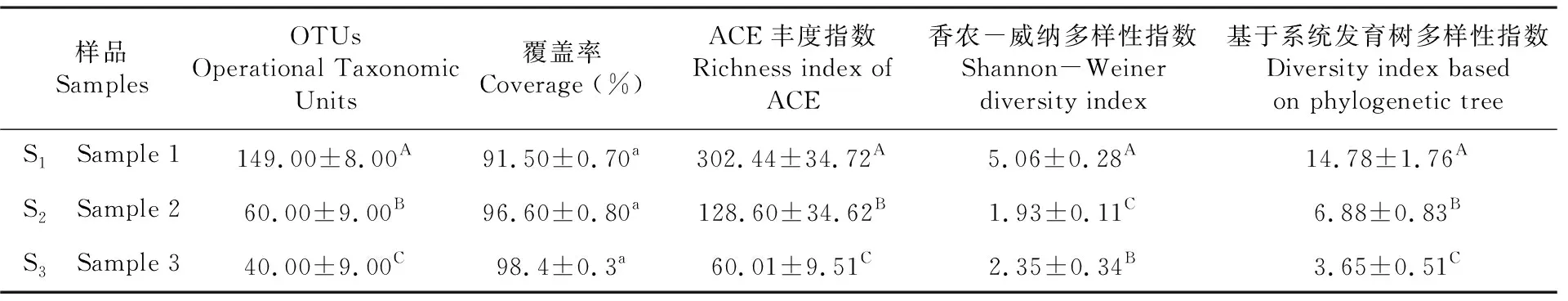
表3 不同阶段样品中细菌Alpha多样性变化Table 3 Changes of bacterial richness and diversity in samples at different stages
2.5 不同阶段样品中细菌Beta多样性比较
研究表明,3个样品分布在不同的3个象限表明其群落组成的Beta多样性差异显著,3个样品彼此间差异极显著(P<0.01)。图1
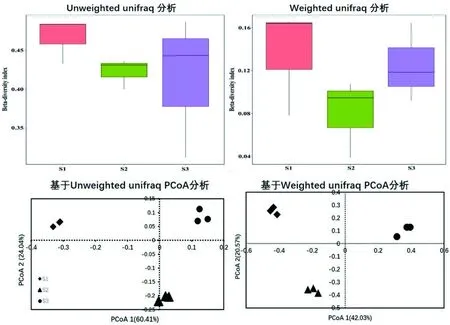
图1 不同阶段样品Beta多样性及主轴Fig.1 Analysis of Beta diversity and principal axis in samples at different stages
3 讨 论
3.1 BRU系统处理后产生的RMS安全性评价
牛粪一直是制约奶牛规模化养殖发展的一项关键而亟待解决的问题[1]。可导致奶牛乳房炎最主要的病原微生物为金黄色葡萄球菌、链球菌、大肠杆菌和沙门氏菌[3]。分析牛粪垫料中病原菌的种类与数量是固体牛粪好氧发酵制备卧床垫料技术能否安全、科学应用的关键所在,也对控制疫病的发生与传播起着重要的作用。目前,牛粪发酵牛床垫料没有相关的国家标准。研究结果显示,经BRU系统处理后RMS中可培养细菌总数和大肠杆菌数量下降了一个数量级,金黄色葡萄球菌数量并未发生明显下降,这一结果说明BRU系统在62℃处理16~18 h对病原菌的杀灭效果并不理想,增加BRU处理时间或者提高处理温度,以期增加病原菌杀灭效率。但是,RMS在堆放30 d后,物料中的金黄色葡萄球菌数量显著下降,表明RMS在堆存过程中持续的高温对金黄色葡萄球菌具有显著杀灭作用,这与一些研究结果认为粪便中的病原菌需要在高温下存放30 d才能达到完全杀灭[14-16]的结果相一致;而细菌总数和大肠杆菌数量又呈现出了显著增加的趋势,虽然在堆放过程中存在有高温胁迫,但其依然具有潜在的可能会增加一些机会主义病原菌的重新定植和数量上的增殖[17,18]。BRU系统处理牛粪垫料使用存在一定的安全隐患,除了需要提高BRU处理温度和处理时间以外,还需要堆存一定的时间,以达到彻底杀灭病原菌的效果。
3.2 BRU系统处理及堆存对牛粪中细菌多样性的影响
运用高通量测序分析技术,通过16S rRNA序列分析可以快速有效检测出样品中大量低丰度的微生物,能更加真实的反映出样品中微生物的种类和多样性。研究结果显示,经BRU处理后细菌Alpha多样性呈现出极显著的下降,各指标下降幅度均超过53.00%以上,而基于细菌系统发育和丰度的Beta多样性分析结果同样呈现出极显著的下降,表明牛粪经BRU高温好氧发酵后能够极显著的降低牛粪中的细菌种类和多样性,改变群落组成[7]。结果与已有的研究结果一致,显示出BRU系统高温好氧发酵杀灭牛粪中细菌的强大作用[4,5,6,8,11]。但在实际生产中常常存在RMS并不能及时使用,因此,存在堆放一定时间后再使用的问题。研究结果显示,RMS存放1周后其堆体温度仍然高于50℃,表明经过BRU系统高温发酵后,RMS并未发酵完全,其在堆放过程中仍然在发酵。主要原因是经过BRU系统处理后的牛粪含水50%左右,质地松软通气性好,因此,其在堆放过程中有利于好氧微生物的生长,因而造成堆体持续保持较高温度。持续的高温能够进一步造成细菌种类,丰度和均匀度显著下降,但细菌香农-威纳多样性指数呈现出极显著的增加,这表明虽然高温造成一些不耐热细菌的死亡,但是一些耐热或者嗜热微生物类群丰度的增加使得RMS中细菌多样性的增加,并且基于系统发育的Beta多样性分析结果进一步证实了RMS堆放后细菌群落多样性显著高于堆放前。细菌多样性显著的增加一方面有利于维持其所处生态环境的稳定性,这也是细菌整体群落对环境扰动的抵抗能力和其生态功能补偿的一种响应,其增加将有助于生态系统对外界其他微生物入侵,定植的抵御能力,这也将进一步的促进生态系统动态平衡的恢复[19]。RMS在经过持续不断高温后其细菌多样性的降低使得RMS生境中生态位的空余,因此,这将会给一些机会主义病原微生物(例如一些繁殖,生长迅速的病原菌)留下繁殖的空间。因此,其直接作为垫料使用理论上可能会具有一定的风险。而通过堆放一定时间后随着生态系统细菌多样性的恢复其作为垫料使用将会降低其使用风险,但如果仅任其自然堆放发酵将会造成RMS的pH的升高,过碱也将对奶牛的躺卧及健康造成不利影响[20]。研究结果BRU处理后的RMS不适合直接作为垫料使用,可以通过对处理的RMS中添加一定量益生菌(乳酸菌,枯草芽孢菌,酵母菌等)并且给与一定时间进行发酵制作成为发酵床后使用将能够降低可能的风险[21]。
4 结 论
牛粪经BRU系统发酵16~18 h后能够显著降低再生固体牛粪垫料中的细菌数量、丰度、多样性并且改变群落组成,表现在细菌OTU数量上减少了57.73%,细菌丰富度指数(ACE指数)降低了57.47%,香农-威纳多样性指数降低了81.63%,细菌和大肠杆菌数量显著下降了一个数量级,金黄色葡萄球菌数量下降不显著。再生固体牛粪垫料堆放30 d后金黄色葡萄球菌数量显著下降,BRU需要进一步提高发酵温度和发酵时间,且处理后的RMS不能立即使用,其需要堆放30 d以上,待病原菌数量完全杀灭后,才可以被安全使用。

