天南星炮制前后主要化学成分含量变化研究
祁春艳,王 晶,武 旭,张 桥,宋艺君,赵重博*,吴建华*
天南星炮制前后主要化学成分含量变化研究
祁春艳1, 2,王 晶1,武 旭1, 2,张 桥1, 2,宋艺君1, 2,赵重博1, 2*,吴建华1, 2*
1. 陕西中医药大学,陕西 咸阳 712046 2. 陕西省中药中药炮制技术传承基地,陕西 咸阳 712046
建立天南星化学成分的含量测定方法,比较炮制前后的含量变化,研究炮制过程中含量变化的规律。分别采用扫描电子显微镜、UV、HPLC、BCA蛋白浓度测定试剂盒对天南星炮制前后的草酸钙针晶的形态,草酸钙、总黄酮、总皂苷、总生物碱、多糖类以及蛋白质、尿苷、腺苷、胸腺嘧啶核苷、鸟苷、次黄嘌呤、夏佛塔苷、异夏佛塔苷、肌苷的含量进行研究。加入白矾炮制的样品草酸钙针晶结构发生明显变化;加少量白矾浸泡样品草酸钙针晶含量最高,单纯加大量白矾煎煮最低;总黄酮的含量生天南星最高,长时间浸泡含量最低;总皂苷的含量生天南星最高,单纯加大量白矾煎煮最低;总生物碱的含量生天南星最高,水煎煮样品含量最低;多糖的含量单纯生姜煎煮最高,水煎煮样品最低;总蛋白的含量生天南星最高,《中国药典》制天南星最低。尿苷、腺苷、尿苷、夏佛塔苷等化学成分在炮制过程中均发生不同程度的变化。天南星中的化学成分在炮制过程中均发生不同程度的变化,其中加入白矾处理对成分影响最大,加入辅料的顺序以及水煎煮处理均可使天南星化学成分含量发生变化,为制天南星炮制机制研究提供借鉴。
天南星;炮制;HPLC;紫外-分光光度法;草酸钙;草酸;黄酮;皂苷;生物碱;多糖;蛋白质;尿苷;腺苷;胸腺嘧啶核苷;鸟苷;次黄嘌呤;夏佛塔苷;异夏佛塔苷;肌苷;白矾;生姜
天南星(AR)是天南星科天南星属植物天南星(Wall.) Schott.、异叶天南星Bl.或东北天南星Maxim.的干燥块茎[1]。具有燥湿化痰、祛风止痉、散结消肿之功[1]。化学成分主要有黄酮类[2-3]、皂苷类[4-5]、生物碱类[6-9]、多糖类[10-11]、凝集素类[12-15]、氨基酸[16]等。药理学研究证明天南星具有抗肿瘤[17-23]、抗惊厥[24-27]、抗炎[28-30]、镇静镇痛[31-33]、祛痰[31,34]的作用。研究报道,天南星中生物碱能抑制草地贪夜蛾Sf21细胞增殖及诱导细胞凋亡[35];总黄酮及其主要成分夏佛塔苷具有抗缺血、保护神经细胞、镇痛作用[36];皂苷类成分对胃黏膜有刺激性,可以反射性地增加气管、支气管的分泌液,起到祛痰的作用[37];总多糖具有抑制肿瘤活性作用[22,38]。天南星临床多用于燥湿化痰,现代临床对过敏性哮喘在传统中医认识中多归于“哮病”,属于“痰饮病”。通过对中国知网(CNKI)和Web of Science数据库查阅相关文献,发现“痰”与“过敏性哮喘”存在紧密的联系。所以本研究以过敏性哮喘作为痰证疾病,结合网络药理学方法,在多个数据库联合来检索与过敏性哮喘相关靶蛋白的基础上,进一步通过分子计算网络特征分析得到天南星主要的活性成分。
历代医家著作认为生天南星有毒,卫生部也把天南星列入28种毒性中药之一[39],由于存在毒性,如果是口服给药,则必须由有经验的人进行炮制(制天南星或者胆南星)。天南星的炮制始见于唐代,应用最多的炮制辅料为生姜、白矾、甘草和皂角、胆汁等[40]。传统研究认为生姜归肺经化痰止呕;白矾归肺经燥湿化痰解毒;甘草入肺经清热解毒、祛痰缓和药性;皂角归肺经祛痰开窍,可达到去毒和增强归肺经化痰的目的[41]。现代研究则认为在天南星的炮制过程中,白矾主要起到降低毒性的作用,而生姜能缓解天南星的中毒症状[42],第1版《中国药典》沿用至今的天南星炮制方法均以生姜和白矾为辅料:取天南星药材,大小分开,用水浸泡,每日换水2~3次,起白沫时,换水后加白矾,泡1日后,再进行换水,至切开口尝微有麻舌感时取出。另取生姜切片煎汤,加白矾与天南星共煮透,取出晾干,切薄片,干燥。但是《中国药典》炮制方法文字性描述导致饮片厂生产操作性较差,品质不均一,且长时间浸泡和煎煮容易导致有效成分含量损失。目前,制天南星炮制的科学内涵更多揭示减毒方面,对化学成分的影响研究报道较少。本研究将《中国药典》中制天南星的炮制方法进行分解,通过测定各个步骤化学成分的含量,旨在建立天南星中6类化学成分的含量测定方法,比较炮制前后的含量变化,研究炮制过程中含量变化的规律。
1 仪器与试药
1.1 仪器
LC-2030 Plus高效液相色谱仪,日本岛津公司,配置LC-2030LC-2030 UV检测器;Waters 2695型高效液相色谱仪配置Waters2996 UV型检测器;Mettler Toledo十万分之一电子天平,上海梅特勒-托利多仪器有限公司;XM-P102H型超声波清洗机,昆山超声仪器有限公司;HH-2型电热恒温水浴锅,北京科伟永兴仪器有限公司;L5型紫外-可见分光光度计,上海仪电分析仪器有限公司;UPL-10L型超纯水机,四川卓越水处理有限公司;GENESPEED 416型离心机,Gene公司;TESCAN VEGE3扫描电子显微镜(SEM),泰斯肯贸易有限公司。
1.2 试药
对照品草酸(批号Z15S9Y70497)、芹菜素(批号T04S8F43072)、齐墩果酸(批号HA0820KA14)、葫芦巴碱(批号Z19A11H121866)、葡萄糖(批号GZDD-0523)、尿苷(批号PS010290)、腺苷(批号PS001227)、胸腺嘧啶核苷(批号PS020196)、鸟苷(批号PS010291)、次黄嘌呤(批号PS020061)、夏佛塔苷(批号PS010457)、异夏佛塔苷(批号Z16A10B93543)、肌苷(批号PS010437),质量分数均≥98.0%,均购自成都普思生物科技股份有限公司;磷酸二氢钾、磷酸、石油醚、浓盐酸、乙醇、三乙胺、正丁醇、甲醇、香草醛、高氯酸、浓硫酸、柠檬酸钠、溴麝香草酚蓝、氯仿、苯酚,均为分析纯,购于科密欧化学试剂有限公司;乙腈,色谱纯,购于科密欧化学试剂有限公司;BCA试剂盒,批号BL521A,南京建城生物科技有限公司。天南星药材购于河北安国药材市场,经陕西中医药大学中药鉴定学颜永刚教授鉴定,为天南星科天南星属植物天南星(Wall.) Schot的干燥块茎。
2 方法与结果
2.1 样品制备
取天南星药材,按《中国药典》2020年版制天南星炮制方法进行加工处理(图1):将生天南星药材洗净,分别制备3批生天南星饮片(样1);样1用水浸泡,每日换水2~3次直至起白沫,得样2;样2加白矾溶液(2%,浸泡液)泡1日后换浸泡液,直至内无干心,切开口尝微有麻舌感,即得样3;样3加生姜和白矾[取生姜(12.5%)切片煎汤,加白矾(10.5%)即得]共煮至透心,得样4(即生姜白矾共制天南星);样2加生姜(12.5%)煎汤煮至透心(样5,生姜制天南星,无白矾);样2加白矾(12.5%)溶液反复浸泡,直至无麻舌感(样6,白矾浸制天南星,无生姜,白矾一步加入);样2加白矾(12.5%)溶液共煮至透心(样7,白矾煮制天南星,无生姜,白矾一步加入);样2加水煮至透心(样8,水煮制天南星,无白矾和生姜);各样品充分干燥,保存。
2.2 天南星炮制前后草酸钙针晶形态变化研究
取天南星不同样品加水泡透,加入适量的石油醚,研磨,直至石油醚清澈,收集石油醚,离心,分离沉淀与上清液,沉淀加甲醇涡旋,即得,SEM下观察。

图1 《中国药典》2020年版制天南星炮制方法环节分解
天南星及其炮制品电镜扫描晶体结构见图2,样1、2草酸钙针晶两端尖锐,样5、8草酸钙针晶出现部分断裂,样3、6、7草酸钙针晶尖锐度有所降低,样4草酸钙针晶两端圆钝程度最高,说明白矾处理对天南星中草酸钙针晶的形态影响较大,其次加热处理也有一定的影响。
2.3 草酸钙含量测定
根据草酸钙不溶于水及有机溶剂的性质,先将可溶性的草酸盐除去,再通过酸处理使草酸钙转化为草酸(CaC2O4+2HCl=CaCl2+H2C2O4),生成1 mol/L草酸需要1 mol/L草酸钙,以此通过HPLC法测定草酸的含量并换算成样品中所含的草酸钙的含量[43-44]。
2.3.1 色谱条件 色谱柱为Agilent 5 XDB-C18柱(250 mm×4.6 mm,5 μm);流动相为0.5% KH2PO4- H3PO4水溶液(pH 2)(流动相溶液的配置:精密称取KH2PO45 g,置于1000 mL量瓶中,加H3PO4调节pH 2后定容,经过0.45 μm混合纤维树脂膜后超声脱气);体积流量0.7 mL/min;检测波长210 nm;柱温28 ℃;进样量10 μL,理论塔板数以草酸含量计算,不得低于2000。

图2 天南星生品及炮制后草酸钙针晶的形态
2.3.2 对照品溶液的制备 精密称取草酸对照品适量,置于100 mL量瓶中,加入蒸馏水定容至刻度,制备质量浓度为0.75 mg/mL的草酸对照品溶液。
2.3.3 供试品溶液的制备 精密称取各生天南星样品粉末(过4号筛)0.2 g,置于离心管中,加入3 mL蒸馏水混匀超声震荡10 min,然后置70 ℃水浴加热并搅拌10 min,4000 r/min离心5 min,残渣加热纯水洗涤3次,每次2 mL,混匀离心,取药材残渣,加0.4 mL盐酸溶液(体积比1∶1),3.0 mL纯水混匀,置于80 ℃水浴,边搅拌边加热10 min,4000 r/min离心5 min,分离沉淀与上清液,沉淀加0.1 mol/L盐酸溶液同上法处理2次,每次2 mL,离心,合并3次上清液,置10 mL量瓶中,纯水定容至刻度,即得供试品溶液[43]。
2.3.4 线性关系考察 取草酸对照品溶液,分别稀释至质量浓度为0.03、0.15、0.45、0.60、0.75 mg/mL的工作曲线溶液,10 μL注入高效液相色谱仪,测定峰面积,以草酸质量浓度为横坐标(),峰面积积分值为纵坐标(),绘制标准曲线并计算回归方程,结果草酸的回归方程为=745 892-626 346,=0.999 5,结果表明草酸在0.03~0.75 mg/mL线性关系良好。
2.3.5 重复性试验 精密称定样1粉末(过4号筛)6份,每份0.2 g,按“2.3.3”项下的方法制备供试品溶液,按照“2.3.1”项下色谱条件进样分析,测定草酸峰面积积分值,计算得草酸质量分数的RSD值为1.26%。
2.3.6 精密度试验 取同一份草酸对照品溶液(质量浓度0.45 mg/mL),连续进样6次,测定草酸峰面积积分值,计算其RSD值为1.33%,表明仪器精密度良好。
2.3.7 稳定性试验 精密称定样1粉末(过4号筛)0.2 g,按“2.3.3”项下方法制备供试品溶液,所得的供试品溶液分别在0、2、4、6、8、12 h进样,测定草酸峰面积,计算其RSD值为1.31%,表明供试品溶液在12 h内稳定性良好。
2.3.8 加样回收试验 精密称取已测定草酸含量的样1粉末6份,每份0.1 g,加适量草酸对照品溶液(0.45 mg/mL),按照“2.3.3”项下方法制备供试品溶液,按照“2.3.1”项下色谱条件进样分析,计算草酸平均加样回收率及其RSD值分别为101.73%和1.71%。
2.3.9 样品含量测定 精密称取各天南星样品粉末(过4号筛)约0.2 g,按“2.3.3”项下方法制备供试品溶液,每个样品进样10 μL,按照“2.3.1”项下色谱条件测定草酸峰面积,根据标准曲线计算草酸含量并转换成草酸钙针晶含量,结果见表1。
2.4 总黄酮含量测定[1]
2.4.1 对照品溶液的制备 取适量芹菜素对照品,加入60%乙醇,使得芹菜素对照品溶液的质量浓度为14 μg/mL,即得。
2.4.2 供试品溶液的制备 精密称定天南星样品粉末(过4号筛)0.6 g,置于具塞锥形瓶中,加入50 mL 60%乙醇,密塞后称定质量,超声处理40 min,放冷后称定质量,以60%乙醇对减失的质量进行补足,摇匀后滤过,即得供试品溶液。
2.4.3 线性关系考察 精密量取制备好的芹菜素对照品溶液1、2、3、4、5 mL,将其分别置于10 mL量瓶中,每个量瓶都加入60%乙醇至5 mL,再加入1%三乙胺溶液,至刻度线并且摇匀。在波长400 nm处测定吸光度(),以质量浓度为横坐标(),值为纵坐标(),绘制其标准曲线,进行线性回归,得芹菜素回归方程为=0.186 8-0.009 2,=0.999 7,结果表明芹菜素在1.023 6~5.022 5 μg/mL线性关系良好。
表1 天南星及其炮制品中各大类指标成分含量测定结果(n = 3)
Table 1 Content determination results of major index components in raw AR and its processed products(n = 3)
样品草酸钙/(mg∙g−1)总黄酮/(mg∙g−1)总皂苷/(mg∙g−1)总生物碱/(mg∙g−1)多糖/(mg∙g−1)蛋白质/(μg∙g−1)OD值 样12.1460.8100.4940.74918.654.5210.283 样22.0980.4430.4030.47114.404.1280.262 样32.9130.3880.3120.33311.102.7000.342 样41.7950.4630.2670.30320.351.7350.367 样51.8220.5790.4130.12823.353.9500.287 样61.8610.2250.2540.1469.652.6640.295 样71.1310.3380.2230.1647.151.9500.289 样81.9990.3350.2590.0854.202.0920.362
2.4.4 样品含量测定 精密称取各天南星样品粉末(过4号筛)0.6 g,分别按“2.4.2”项下方法制备供试品溶液,并按照“2.4.3”项下方法处理,测定值,计算总黄酮含量,结果见表1。
2.5 总皂苷含量测定
2.5.1 对照品溶液制备 取齐墩果酸对照品适量,精密称定,加甲醇制成含有齐墩果酸32 μg/mL的对照品溶液,即得。
2.5.2 供试品溶液的制备 精密称定天南星样品粉末(过4号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,称定质量,超声处理30 min,放冷,再次称定质量,70%乙醇补足减失的质量,摇匀,滤过。精密称取续滤液10 mL,蒸干。残渣加15 mL水溶解,用水饱和的正丁醇振摇提取4次,每次10 mL,合并正丁醇提取液,用正丁醇饱和的水洗涤2次,每次10 mL,分取正丁醇液,蒸干,残渣加甲醇使溶解,转移至10 mL的量瓶中[45]。
2.5.3 线性关系考察 精密吸取齐墩果酸对照品溶液1、2、3、4、5 mL,分别置于具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5 mL,充分混匀后置60 ℃恒温水浴上加热15 min,立即用冷水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以相应试剂作空白,在520 nm处测定值,以齐墩果酸质量浓度为横坐标(),值为纵坐标(),绘制标准曲线并计算其回归方程[45],齐墩果酸的回归方程为=0.190 8+0.054,=0.999 1,结果表明齐墩果酸在32~160 μg/mL线性关系良好。
2.5.4 重复性试验 精密称定样1粉末(过4号筛)1.0 g,6份,按“2.5.2”项下方法制备供试品溶液,按照“2.5.3”项下方法操作并测定其值,计算得总皂苷质量分数的RSD值为1.61%。
2.5.5 精密度试验 精密吸取1 mL对照品溶液(质量浓度32 μg/mL),按“2.5.3”项下方法处理,测其值,重复6次,计算其值的RSD值为1.55%。
2.5.6 稳定性试验 精密称定样1粉末(过4号筛)1.0 g,按“2.5.2”项下方法制备供试品溶液,所得的供试品溶液分别在0、2、4、6、8、12 h按“2.5.3”项下方法进行测定,测得其值,计算其值的RSD值为1.27%。
2.5.7 加样回收试验 精密称取已测定总皂苷含量的样1粉末6份,每份0.5 g,加适量齐墩果酸对照品,按照“2.5.2”项下方法制备供试品溶液,按“2.5.3”项下方法测定其值,计算得齐墩果酸的平均加样回收率及其RSD值分别为101.54%和1.78%。
2.5.8 样品含量测定 精密称取各天南星饮片粉末(过4号筛)1.0 g,分别按“2.5.2”项下方法制备供试品溶液,并按照“2.5.3”项下方法处理,测定值,计算总皂苷含量,结果见表1。
2.6 总生物碱含量测定
2.6.1 对照品溶液制备 精密称取葫芦巴碱对照品适量,加甲醇配制成含葫芦巴碱32 μg/mL的对照品溶液,即得。
2.6.2 供试品溶液制备 称取样1粉末(过4号筛)约1.0 g,精密称定,置于具塞锥形瓶中,精密加入60%乙醇20 mL,密塞,称定质量,超声处理30 min,放冷,再称定质量,用60%乙醇补足减失质量,摇匀,滤过。精密量取续滤液10 mL,挥干溶剂,残渣加甲醇使溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,即得[45-46]。
2.6.3 线性关系考察 精密吸取对照品溶液1、2、3、4、5 mL置于分液漏斗中,加入pH 5.6的柠檬酸钠缓冲溶液14 mL,溴麝香草酚蓝试剂4 mL,氯仿15 mL萃取3次,合并萃取液,干燥滤纸滤过水分后,在415 nm处测定值。以葫芦巴碱的质量浓度为横坐标(),值为纵坐标(),绘制标准曲线并计算回归方程[44-45]。结果胡芦巴碱的回归方程为=0.017 2+0.054 8,=0.999 1,结果表明胡芦巴碱在0.239 5~3.745 3 μg/mL线性关系良好。
2.6.4 重复性试验 精密称定样1粉末(过4号筛)1.0 g,6份,按“2.6.2”项下方法制备供试品溶液,按“2.6.3”项下方法操作并测定其值,计算得总生物碱质量分数的RSD值为1.49%。
2.6.5 精密度试验 精密吸取1 mL对照品溶液(质量浓度32 μg/mL),对照品溶液的处理按“2.6.3”项下的方法,测其值,重复6次,计算其值的RSD值为1.32%。
2.6.6 稳定性试验 精密称定样1粉末(过4号筛)1.0 g,按“2.6.2”项下方法制备供试品溶液,所得的样品溶液在0、2、4、6、8、12 h按“2.6.3”项下方法测定其值,计算其值的RSD值为1.21%。
2.6.7 加样回收率试验 精密称取已知总生物碱含量的样1粉末6份,每份0.5 g,加适量葫芦巴碱对照品,照“2.6.2”项下方法制备供试品溶液,按“2.6.3”项下方法进行测定,测得其值,计算得胡芦巴碱的平均加样回收率及其RSD值分别为101.51%和1.66%。
2.6.8 样品含量测定 精密称取各天南星样品粉末(过4号筛)约1 g,按“2.6.2”项下方法制备供试品溶液,并按“2.6.3”项下方法分别处理,测定值,计算含量,结果见表1。
2.7 多糖的含量测定
2.7.1 对照品溶液的制备 取适量的葡萄糖对照品(105 ℃干燥至恒定质量),置250 mL量瓶中,加水溶解并定容,使葡萄糖对照品溶液质量浓度为0.075 mg/mL。
2.7.2 供试品溶液的制备 称取各天南星样品粉末(过4号筛)约1.0 g,加100 mL蒸馏水,称定质量,加热回流1.5 h,冷却,称定质量,加蒸馏水补足减失的质量,离心,取2 mL上清液,加10 mL乙醇,振摇后静止12 h,离心,取沉淀加水溶解移入50 mL量瓶中加水定容,即得供试品溶液[47-48]。
2.7.3 线性关系考察 分别精密吸取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于具塞试管中,加超纯水至2 mL,加入5%苯酚溶液1 mL,加浓硫酸5 mL,摇匀,置沸水浴中水浴加热15 min,取出冷却至室温。在488 nm处测定值,以对照品质量浓度为横坐标(),值为纵坐标(),绘制标准曲线并计算回归方程[47-48]。结果葡萄糖的回归方程为=0.072 0+0.046 6,=0.999 5,结果表明葡萄糖在0.852 8~6.838 9 mg/mL线性关系良好。
2.7.4 重复性试验 精密称定样1粉末(过4号筛)1.0 g,6份,按“2.7.3”项下方法制备6份供试品溶液,按“2.7.2”项下方法处理各供试品溶液,测得其值,计算得总多糖质量分数的RSD值为1.92%。
2.7.5 精密度试验 精密吸取1 mL对照品溶液(质量浓度0.075 mg/mL),对照品溶液的处理按“2.7.3”项下方法,重复6次测其值,计算其值的RSD值为1.57%。
2.7.6 稳定性试验 精密称定样1粉末(过4号筛)1.0 g,按“2.7.2”项下方法制备供试品溶液,所得的供试品溶液在0、2、4、6、8、12 h按“2.7.3”项下方法进行测定,测得其值,计算其值的RSD值为1.39%。
2.7.7 加样回收率试验 精密称取已知多糖含量的样1粉末6份,每份0.5 g,加适量葡萄糖对照品,照“2.7.2”项下方法制备供试品溶液,按“2.7.3”项下方法进行测定,测得其值,计算得葡萄糖的平均加样回收率及RSD值分别为102.96%和2.20%。
2.7.8 含量测定 精密称取各天南星样品粉末(过4号筛)约1.0 g,按“2.7.2”项下方法制备供试品溶液,并按“2.7.3”项下方法分别处理,测定值,计算含量,结果见表1。
2.8 BCA浓度试剂盒测定蛋白质的含量
按照试剂盒说明书测定。
2.8.1 BCA工作液的配制 将试剂A与试剂B按照体积比50∶1的比例混合,配成BCA工作液,具体信息见表2。试剂A:1% BCA二钠盐、2%无水碳酸钠、0.16%酒石酸钠、0.4%氢氧化钠、0.95%碳酸氢钠,混合调pH 11.25,试剂B:4%硫酸铜。
表2 BCA工作液
Table 2 Configuration of BCA working fluid
产品编号产品名称 BL521A-1试剂A BL521A-2试剂B BL521A-3牛血清白蛋白(BSA)标准溶液 BL521A-4PBS
2.8.2 蛋白标准品配制 室温完全溶解蛋白标准品(BSA),取5 mg/mL BSA标准液20 μL,用PBS稀释至100 μL,使其最终质量浓度为1.0 mg/mL。
2.8.3 供试品溶液的制备 取各天南星样品5 g,用50 mL水泡透,匀浆机匀浆3次,每次30 s,4 ℃冷冻离心机离心20 min(1200 r/min),定容至50 mL量瓶中。
2.8.4 BSA标准测定溶液的配制 按照说明书配制质量浓度为1、5 mg/mL的BAS溶液。
2.8.5 线性关系考察 按照BCA蛋白浓度测定试剂盒的说明书操作,将10 μL待测样品加入到微孔板中,并用PBS补足到20 μL,向微孔板中加入200 μL工作液,混匀,37 ℃放置30 min,在562 nm波长处测定值,并记录读数;以值为横坐标(),BAS质量浓度为纵坐标(),绘制标准曲线,计算样品中BAS的质量浓度,结果BAS的回归方程为=0.280 0+0.042 4,=0.999 6,结果表明BSA在1.735 7~4.521 4 μg/mL线性关系良好。
2.8.6 含量测定 精密称取各天南星样品粉末(过4号筛)约1.0 g,按“2.8.3”项下方法制备供试品溶液,测定值,计算含量,结果见表1。
2.9 总评归一值(overall desirability value,OD值)计算
为了直观地考察工艺环节对各大类成分含量的总体影响,对6个化学成分的含量进行归一化处理,利用Hassan法对各效应值进行归一化,黄酮、皂苷、生物碱、多糖含量越高越好,因此,归一值d=(y-min)/(max-min);刺激性成分针晶和蛋白含量越低越好,因此,归一值d=(max-y)/(max-min);再对归一值d求算术平均值,即为OD值,OD=(1+2+……+d)/[44],结果见表1。OD值分别为0.283、0.262、0.342、0.367、0.287、0.295、0.289、0.362。从减毒存效效果来看,炮制品中以《中国药典》中炮制方法制得样品综合评判最佳,从有效成分保留程度看单纯生姜处理效果最佳,从降低毒性刺激性成分看单纯白矾处理最佳。
2.10 8种单一指标成分的含量测定[49]
2.10.1 对照品溶液的制备 精密称取鸟苷、尿嘧啶、腺苷、胸腺嘧啶核苷、鸟苷、腺嘌呤、夏佛塔苷、异夏佛塔苷适量,置于10 mL量瓶中,加水溶解并定容,使得各对照品的质量浓度均为0.4 mg/mL,即为混合对照品溶液。
2.10.2 供试品溶液的制备 称取各天南星样品粉末(过4号筛)约3 g,置于50 mL具塞锥形瓶内,加入20 mL 60%乙醇,超声提取45 min,冷却至室温并补足减失的质量,滤过,即得。
2.10.3 色谱条件 色谱柱为Agilent 5 XDB-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱程序:0~6 min,100%乙腈;6~25 min,100%~90%乙腈;25~45 min,90%~85%乙腈;45~65 min,85%~65%乙腈;65~75 min,65%乙腈;体积流量0.8 mL/min;检测波长270 nm;柱温25 ℃;进样量10 μL。理论塔板数按夏佛塔苷计算不得低于2000。
2.10.4 线性关系考察 操作方法同“2.3.4”项。混合对照品溶液稀释至质量浓度分别为0.02、0.10、0.20、0.30、0.40 mg/mL。结果得到尿苷的回归方程为=312 108-162 839,=0.999 5,结果表明尿苷在0.02~0.40 mg/mL线性关系良好;腺苷的回归方程为=59 763+108 373,=0.999 2,结果表明腺苷在0.02~0.40 mg/mL线性关系良好;胸腺嘧啶核苷的回归方程为=488 726-8 600.7,=0.999 6,结果表明胸腺嘧啶核苷在0.02~0.40 mg/mL线性关系良好;鸟苷的回归方程为=209 600+172 153,=0.999 8,结果表明鸟苷在0.02~0.40 mg/mL线性关系良好;次黄嘌呤的回归方程为=154 174+771 16,=0.999 5,结果表明次黄嘌呤在0.02~0.40 mg/mL线性关系良好;夏佛塔苷的回归方程为=343 422+5 264,=0.999 5,结果表明夏佛塔苷在0.02~0.4 mg/mL线性关系良好;异夏佛塔苷的回归方程为=326 095-12 557,=0.999 8,结果表明异夏佛塔苷在0.02~0.40 mg/mL线性关系良好;肌苷的回归方程为=115 703+71 877,=0.999 1,结果表明肌苷在0.02~0.40 mg/mL线性关系良好。
2.10.5 方法学考察[49]方法学考察同“2.3.5”项。除重复性试验外,其余均通过对实验测得的峰面积进行计算。得出尿苷、腺苷、胸腺嘧啶核苷、鸟苷、次黄嘌呤、夏佛塔苷、异夏佛塔苷、肌苷精密度试验的RSD分别为0.28%、0.62%、0.16%、0.21%、0.32%、0.27%、0.31%、0.63%,表明实验所用仪器的精密度良好;重复性试验(以质量分数进行计算)的RSD分别为0.96%、1.29%、1.04%、1.30%、0.98%、1.21%、0.62%、0.78%,表明所建立各方法重复性良好;稳定性试验的RSD分别为1.32%、1.62%、1.40%、1.34%、1.17%、0.93%、1.49%、1.85%,表明制备的天南星供试品溶液在0~12 h内稳定性良好;加样回收率试验中平均加样回收率分别为103.96%、102.75%、104.12%、102.11%、102.03%、102.75%、102.94%、102.90%,RSD分别为0.35%、0.46%、1.28%、1.51%、1.07%、0.51%、0.83%、0.41%。
2.10.6 含量测定 测定方法同“2.3.6”项。结果见表3。
2.11 网络药理学
2.11.1 天南星中活性成分的筛选 以天南星为检索词,通过中药系统药理学技术平台TCMSP(http:// lsp.nwu.edu.cn/tcmsp.Php)和HomePage-BATMAN数据库检索天南星的化学成分。筛选口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18的作为活性成分筛选条件[50],筛选出符合条件的7个活性成分。在HomePage- BATMAN和Pubchem数据库中检索得到天南星靶点9个,结果见表4、5。在GeneCards数据库中得到过敏性哮喘的相关靶点,最后通过在线韦恩图(https://bioinfogp.cnb.csic.es/tools/venny/index.html,图3)得到天南星和过敏性哮喘的共有基因。
表3 天南星及其炮制品中8种单一指标成分含量测定结果(n = 3)
Table 3 Determination results of eight kinds of single index components in raw AR and its processed products(n = 3)
样品质量分数/(μg∙g−1) 次黄嘌呤腺苷胸腺嘧啶核苷鸟苷尿苷夏佛塔苷异夏佛塔苷肌苷 样11.0991.2840.9411.4261.2993.0222.3980.736 样20.7590.4290.1720.1150.4040.3760.2550.948 样30.6470.2170.3170.3180.2050.4860.511− 样40.886−0.959−−0.8740.2990.164 样50.981−0.9340.121−1.6750.576− 样60.9060.2070.1180.3240.2031.0390.401− 样7−0.104−−−1.2300.694− 样81.1480.9580.1060.4201.1482.1681.120−
“−”表示化学成分含量极低,未检测出
“−” means that the content of chemical components is extremely low, not detected
2.11.2 活性成分靶点的预测 利用TCMSP数据库查得天南星中每个活性成分所对应的靶蛋白,再将靶蛋白导入到PubChem(https://pubchem.ncbi.nlm. nih.gov/)和SwissTarget Prediction(http://www. swisstargetprediction.ch/)数据库获取每个靶蛋白所对应的靶基因,最后将得到的靶基因进行合并,删除相同基因保留唯一项,得结果即为天南星活性成分的靶点。
表4 TCMSP数据库检索得到的化学成分
Table4 Chemical constituents retrieved from TCMSP database
编号化合物OB/%DL类别 MOL0131468,11,14-二十二碳三烯酸甲酯(8,11,14-docosatrienoic acid, methyl ester)42.230.30苷类 MOL013156[(2R)-2-[[(2R)-2-(苯甲酰氨基)-3-苯丙酰基]氨基]甲基]-3-苯基丙基]乙酸酯[(2R)-2-[[[(2R)-2-(benzoylamino)-3-phenylpropanoyl]amino]methyl]-3-phenylpropyl] acetate]38.880.56苷类 MOL00151024-菜油甾醇(24-epicampesterol)37.580.71甾醇 MOL000358β-谷甾醇(β-sitosterol)36.910.75甾醇 MOL000359谷甾醇(sitosterol)36.910.75甾醇 MOL000449豆甾醇(stigmasterol)43.830.76甾醇 MOL000953十八烷基-[2-(三甲基氮杂鎓基)乙氧基]次膦酸酯(CLR)37.870.68甾醇
表5 Pubchem数据库检索得到的化学成分
Table 5 Chemical constituents retrieved from PubChem database
PubChem CID化合物相对分子质量类别 190淀粉(amylum)135.13糖类 11390178D-甘露庚酮糖(D-mannoheptulose)210.18糖类 457801γ-谷甾醇(γ-sitosterol)414.70甾醇 6251D-甘露醇(D-mannitol)182.17甾醇 305胆碱(choline)104.17生物碱 44568343秋水仙碱(colchinine)415.40生物碱 442658夏佛塔苷(schaftoside)543.50黄酮 3084995异夏佛塔苷(isoschaftoside)546.50黄酮 12285902掌叶半夏碱F(pedatisectine F)214.22生物碱
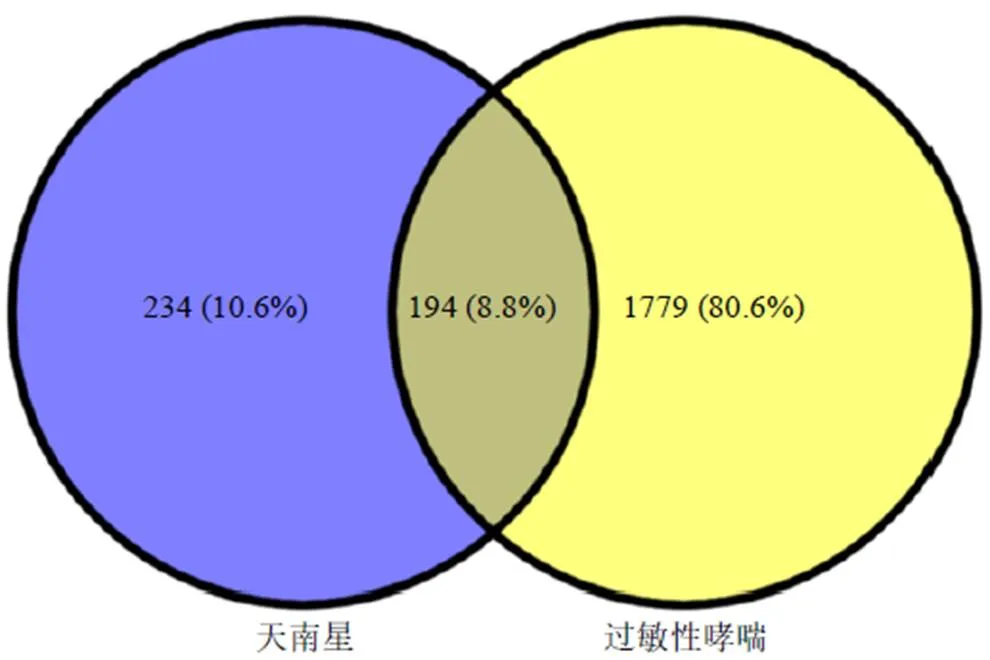
图3 成分靶点-疾病靶点韦恩图
2.11.3 疾病靶点的筛选 以“allergic asthma”为检索词,在GeneCard数据库中获得过敏性哮喘的相关靶点,并整合数据。
2.11.4 “药物-成分-靶点-疾病”网络的建立与分析建立天南星活性成分、作用靶点、疾病相互作用关系,并导入到Cytoscape 3.7.2软件中,利用该软件的“merge”工具构建天南星治疗过敏性哮喘的“药物-成分-靶点-疾病”网络图,结果见图4。
2.11.5 潜在活性成分预测 将天南星的活性成分的靶点和过敏性哮喘的相关靶点上传至在线韦恩图(http://bioinfogp.cnb.csic.es/tools/venny/index.html,Version 2.1.0)进行映射即两者取交集,获得天南星治疗过敏性哮喘的潜在成分。进一步依据检索到的过敏性哮喘潜在靶点和天南星相关靶点映射药对中可能存在治疗作用的潜在活性成分共10个,结果见表6。
3 讨论
天南星的毒性成分报道较多为草酸钙针晶、生物碱和凝集素蛋白。而其功效成分还未研究清楚,但有学者表明,黄酮、多糖和皂苷都具有一定的活性[21,33,51]。因此,采用HPLC法和紫外分光-光度法,对炮制前后天南星中主要化学成分的含量进行测定。通过网络药理学得出天南星共有10个化学成分与过敏性哮喘有关。这些化学成分包括β-谷甾醇、胆固醇、腺嘌呤、γ-谷甾醇、夏佛塔苷等。因为天南星中有些化学成分含量较低,检测成分含量时有一定的难度,因此检测天南星中的大类成分。
实验结果表明,加少量白矾长时间浸泡样品(样3)草酸含量最高,可能与长时间浸泡使草酸钙针晶更易溶出被检测到。单纯加大量白矾煎煮(样7)最低,说明加入白矾以及加热处理会破坏草酸钙针晶甚至使草酸流失。白矾长时间浸泡样品(样6)与各样品比较差异不大,说明在白矾不加热情况下对草酸含量影响不大。而单纯水煮(样8)、单纯生姜煮(样5)及生姜白矾共煮(样4)草酸含量差异不大,但姜矾共煮(样4)破坏草酸钙针晶程度远大于单纯白矾煎煮(样7),与样4在煎煮前长时间浸泡使草酸钙针晶易于析出更容易被破坏有关。实验结果仅以草酸含量推测草酸钙针晶缺乏更直接的证据,但也能从侧面反映出浸泡时间长短和白矾加热处理对草酸钙针晶影响较大。

图4 天南星“药物-成分-靶点-疾病”网络图
表6 天南星治疗过敏性哮喘潜在活性成分
Table 6 Potential active ingredients of AR in treatment of allergic asthma
编号化合物类别 18,11,14-二十二碳三烯酸甲酯(8,11,14-docosatrienoic acid, methyl ester)苷类 2掌叶半夏碱F(pedatisectine F)生物碱 3[(2R)-2-[[(2R)-2-(苯甲酰氨基)-3-苯丙酰基]氨基]甲基]-3-苯基丙基]乙酸酯[(2R)-2-[[[(2R)-2-(benzoylamino)-3-phenylpropanoyl]amino]methyl]-3-phenylpropyl] acetate]甾醇 4秋水仙碱(colchinine)生物碱 5夏佛塔苷(schaftoside)黄酮 6γ-谷甾醇(γ-sitosterol)甾醇 7十八烷基-[2-(三甲基氮杂鎓基)乙氧基]次膦酸酯(CLR)甾醇 8D-甘露醇(D-sitosterol)甾醇 9淀粉(amylum)糖类 1024-菜油甾醇(24-epicampesterol)甾醇
黄酮类成分溶于水导致各样品含量均有不同程度降低;单纯生姜处理(样5)及姜矾法(样4)相比其他处理样品含量高,有可能生姜中引入黄酮类成分,且加入白矾后可能使黄酮类成分降低,但矾水煎煮(样7)和纯水煎煮(样8)含量接近,说明白矾对黄酮影响不大,因此还需进一步分析。白矾长时间浸泡(样6)含量最低,可能是反复水处理导致成分流失。
皂苷类成分易溶于水导致各样品含量均有不同程度降低;单纯生姜处理(样5)相比其他处理样品含量高,有可能生姜中引入黄酮类成分,姜矾法(样4)、矾水煎煮(样7)和纯水煎煮(样8)含量接近,说明白矾会影响生姜中皂苷成分与天南星的结合。白矾长时间浸泡(样6)含量与其它样品差异不大,提示皂苷类成分易溶于水,前期水处理已损失较多,是否加热对皂苷类成分影响不大。
生物碱易受水处理和加热的影响,单纯水煎煮(样8)含量最低,加入白矾和生姜加热处理一定程度会影响生物碱的损失,且白矾效果优于生姜。
多糖易溶于热水,单纯生姜处理(样5)及姜矾法(样4)相比其他处理样品含量高,有可能生姜中引入多糖类成分,且矾水煎煮(样7)高于纯水煎煮(样8)含量,说明白矾对多糖有一定的影响,具体原因还需进一步分析。
蛋白遇热易变性失活,功效会降低,在不同pH值下被分解。矾水煎煮(样7)和姜矾法(样4)相比其他处理样品含量低,加热或白矾浸泡也有不同程度的降低,且加热对蛋白影响小于白矾对蛋白的影响。生姜煎煮法与生天南星差别不大,通过与郁红礼等报道[13]分析,生姜本身对天南星凝集素蛋白影响不大,但是本实验测定的是总蛋白含量,生姜中本身也有一定量蛋白,两者间相互影响,还需进一步研究分析。
尿苷、腺苷、胸腺嘧啶核苷、鸟苷、次黄嘌呤、夏佛塔苷、异夏佛塔苷、肌苷等8种化学成分在炮制过程中含量发生变化。结果表明,姜矾法(样4)处理使腺苷、鸟苷、尿苷、肌苷的含量在炮制之后几乎检测不到,有可能加热、加入生姜和白矾对腺苷、鸟苷、尿苷、肌苷的影响较大。加入白矾处理(样3、6、7)一定程度影响8种成分含量,加入白矾溶液反复处理(样6)对腺苷、鸟苷、肌苷影响较大,几乎检测不到3种成分的含量。单纯水煎煮(样8)对8种成分的含量影响不大,由于夏佛塔苷和异夏佛塔苷属于黄酮类成分,矾水煎煮(样7)和纯水煎煮(样8)含量接近,说明白矾对黄酮类成分的影响不大。肌苷在炮制后含量几乎检测不到,说明炮制对肌苷的影响最大。姜矾法(样4)处理时含量增加,可能是因为加入生姜和白矾产生了物质使得肌苷含量增加。但具体原因还需要进一步分析。
毒性药在炮制时首要考虑的是降低毒性,但在降低毒性的同时也要尽可能地保留原有功效。虽然在减毒工艺以及毒性成分的研究上取得了一定的进展,但是对于天南星药效物质基础以及炮制过程对化学成分变化尚不明确,因此应当充分利用现代科学技术,进一步揭示天南星炮制过程中有效成分的变化规律,明确炮制减毒存效的物质基础,优化其炮制工艺,确保临床用药安全有效。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 57.
[2] 王广树, 刘银燕, 陈滴, 等. 东北天南星块茎化学成分的研究 [J]. 特产研究, 2009, 31(2): 21-22.
[3] 杜树山, 雷宁, 徐艳春, 等. 天南星黄酮成分的研究 [J]. 中国药学杂志, 2005(19): 21-23.
[4] Jung J H, Lee C O, Kim Y C,. New bioactive cerebrosides from[J]., 1996, 59(3): 319-322.
[5] Jung J H, Lee H K, Kang S S. Diacylglycerylgalactosides from[J]., 1996, 42(2): 527-530.
[6] 王艳华, 张连成. HPLC法测定天南星中葫芦巴碱的含量 [J]. 黑龙江医药, 2004(5): 329-330.
[7] Prakash S, Sinha G K. Chemical examination ofKunth (Part I) [J]., 1974, 26(2): 25-27.
[8] 宋治中, 贾忠建. 螃蟹七化学成分的研究 [J]. 中国中药杂志, 1989, 14(8): 32-34.
[9] Miglani B D, Chawla A S, Gaind K N. Chemical investigation ofCorm [J]., 1978, 40(1): 24-26.
[10] Chen G, Xu J, Miao X,. Characterization and antitumor activities of the water-soluble polysaccharide from[J]., 2012, 90(4): 67-72.
[11] 王广树, 刘银燕, 陈滴, 等. 东北天南星块茎化学成分的研究 [J]. 特产研究, 2009, 31(2): 21-22.
[12] 孙光星, 丁声颂, 钱瑶君. 掌叶半夏凝集素A的分离纯化及分析 [J]. 上海医科大学学报, 1995(4): 299-302.
[13] 郁红礼, 王卫, 吴皓, 等. 炮制对天南星科4种有毒中药毒性成分凝集素蛋白的影响 [J]. 中国中药杂志, 2019, 44(24): 5398-5404.
[14] 王卫, 毛善虎, 单雪莲, 等. 基于ROS/NF-κB信号通路的天南星凝集素致炎机制及炮制对蛋白的影响 [J]. 中华中医药杂志, 2018, 33(5): 1740-1746.
[15] Feng li-xing, Sun P, Mi T,. Agglutinin isolated fromBlume induces apoptosis and autophagy in A549 cells through inhibiting PI3K/Akt pathway and inducing ER stress [J]., 2016, 14(11): 856-864.
[16] 王星, 池玉梅, 康安. 超高效液相色谱-串联质谱法定性和高效液相色谱法定量分析天南星中氨基酸成分 [J]. 色谱, 2014, 32(12): 1326-1332.
[17] 张志林, 汤建华, 陈勇, 等. 中药天南星醇提物抗肿瘤活性的研究 [J]. 陕西中医, 2010, 31(2): 242-243.
[18] 戚笑笑, 李红, 杜钢军. 天南星抗肿瘤的初步研究 [J]. 河南大学学报: 医学版, 2014, 33(2): 85-87.
[19] 杨宗辉, 尹建元, 魏征人, 等. 天南星提取物诱导人肝癌SMMC-7721细胞凋亡及其机制的实验研究 [J]. 中国老年学杂志, 2007(2): 142-144.
[20] 杨国平, 吕小满, 甘平, 等. 天南星提取物对小鼠S180肉瘤的抑制作用研究 [J]. 时珍国医国药, 2011, 22(3): 752-753.
[21] 赵重博, 王晶, 吴博, 等. 基于PB设计和BBD响应面法优化制天南星多糖超声辅助提取工艺及抗肿瘤活性研究 [J]. 中国新药杂志, 2019, 28(9): 1139-1144.
[22] 邱丽敏, 姜爽. 天南星多糖联合顺铂对乳腺癌MDA-MB-231细胞增殖、凋亡及上皮间质转化的影响 [J]. 中药材, 2016, 39(3): 630-633.
[23] 唐化勇, 张万生, 于航, 等. 天南星多糖对人肾癌细胞系GRC-1增殖及凋亡作用的影响 [J]. 中国实验方剂学杂志, 2016, 22(14): 155-158.
[24] 秦彩玲, 胡世林, 刘君英, 等. 有毒中药天南星的安全性和药理活性的研究 [J]. 中草药, 1994, 25(10): 527-530.
[25] 陈小英, 成明建, 叶志琼. 实验研究天南星抗惊厥作用 [J]. 黑龙江医药, 2009, 22(4): 470-471.
[26] 薛国华, 张东藩, 杨志孝, 等. 天南星、乌头、天麻抗电痉挛作用的初步实验 [J]. 西安交通大学学报: 医学版, 1958(1): 22-24.
[27] 刘玉玺, Voskuyl R A, Meinardi H, 等. 三种中药提取物对电刺激大鼠皮层惊厥阈值的影响及抗戊四唑惊厥作用 [J]. 中国中西医结合杂志, 1997(S1): 81-82.
[28] 刘艳平, 李晓成, 李引刚. 制天南星对兔膝骨关节炎关节液IL-1和关节滑膜的影响 [J]. 河南中医, 2013, 33(8): 1253-1255.
[29] Zhao C B, Li X Y, Wu N,. Effect of(Wall) Schott rhizome extract on rheumatoid arthritis [J]., 2016, 15(4): 805.
[30] Liu X Q, Wu H, Yu H L,. Purification of a lectin from(Wall.) Schott and its pro-inflammatory effects [J]., 2011, 16(11): 9480-9494.
[31] 聂容珍, 陈文政, 林嘉娜, 等. 天南星科有毒中药及炮制品的药效比较研究 [J]. 中药药理与临床, 2016, 32(4): 53-56.
[32] Huang C F, Yang R S, Liu S H,. Evidence for improved neuropharmacological efficacy and decreased neurotoxicity in mice with traditional processing of[J]., 2011, 39(5): 981-998.
[33] 王芹, 王胜飞, 张永太, 等. 天南星总黄酮纳米凝胶对Walker256骨癌痛模型大鼠的镇痛作用研究 [J]. 上海中医药杂志, 2015, 49(11): 62-66.
[34] 赫炎, 吴连英, 王孝涛. 胆南星不同炮制品的药效和毒性实验研究 [J]. 中药材, 1997, 20(9): 459-461.
[35] 刘丽华, 于洋, 白岩. 东北天南星生物碱对草地贪夜蛾Sf21细胞凋亡的影响 [J]. 通化师范学院学报, 2020, 41(2): 9-12.
[36] 黄维琳, 梁枫, 汪荣斌. 天南星总黄酮对肺癌A549细胞增殖及凋亡作用的影响 [J]. 齐齐哈尔医学院学报, 2017, 38(12): 1382-1383.
[37] 赫炎, 吴连英, 王孝涛. 胆南星不同炮制品的药效和毒性实验研究 [J]. 中药材, 1997, 20(9): 459-461.
[38] 赵重博, 王晶, 吴博, 等. Box-Behnken效应面法优化陕西法制天南星提取工艺及抗肿瘤药效研究 [J]. 中医药导报, 2019, 25(6): 69-73.
[39] 季申, 丁声颂, 李颖. 10种药用天南星的化学成分分析 [J]. 复旦学报: 医学版, 1989, 16(3): 203-208.
[40] 徐皓. 天南星的化学成分与药理作用研究进展 [J]. 中国药房, 2011, 22(11): 1046-1048.
[41] 王帅, 包永睿, 杨欣欣, 等. 中药东北天南星生物碱类成分提取纯化工艺研究 [J]. 时珍国医国药, 2015, 26(10): 2343-2345.
[42] 居羚, 池玉梅, 吴皓, 等. 超高效液相-高分辨串联质谱分析天南星化学成分 [J]. 亚太传统医药, 2016, 12(5): 45-49.
[43] 钟凌云, 吴皓. RP-HPLC测定天南星科药用植物中草酸钙针晶的含量 [J]. 中成药, 2008, 30(2): 260-262.
[44] 吴皓, 葛秀允, 郁红礼, 等. 天南星科4种有毒中药针晶的晶型结构和其毒性的比较 [J]. 中国中药杂志, 2010, 35(9): 1152-1155.
[45] 吴鲁东. 天南星及其炮制品的质效评价 [D]. 广州: 广东药学院, 2014.
[46] 吴鲁东, 郝虹, 李书渊. 天南星炮制过程中总生物碱的动态变化 [J]. 海峡药学, 2015, 27(3): 37-39.
[47] 赵重博. 制天南星抗类风湿性关节炎物质基础和作用机制及其药物动力学初步研究 [D]. 成都: 成都中医药大学, 2016.
[48] 徐增香, 师健友. 天南星中多糖的测定 [J]. 华西药学杂志, 2010, 25(2): 208-209.
[49] 罗芬. 天南星药材指纹图谱及黄酮部位药动学研究 [D]. 南京: 南京中医药大学, 2012.
[50] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6(1): 13-18.
[51] 梁枫, 于丽丽, 汪荣斌, 等. 异夏佛塔苷对人非小细胞肺癌A549细胞抗肿瘤的活性及其作用机制 [J]. 牡丹江医学院学报, 2019, 40(6): 33-36.
Study on chemical composition changes ofbefore and after processing
QI Chun-yan1, 2, WANG Jing1, WU Xu1, 2, ZHANG Qiao1, 2, SONG Yi-jun1, 2, ZHAO Chong-bo1, 2, WU Jian-hua1, 2
1. Shaanxi University of Chinese Medicine, Xianyang 712046, China 2. Shaanxi Traditional Chinese Medicine Processing Technology Heritage Base, Xianyang 712046, China
Six kinds of chemical components were determined and analyzed simply from Tiannanxing (, AR) before and after processing.Scanning electron microscope, UV, HPLC and BCA protein concentration determination kit were used to study the morphology of calcium oxalate needle crystals, the contents of oxalic acid, flavonoids, saponins, alkaloids, polysaccharides, protein, uridine, adenosine, thymidine, guanosine, hypoxanthine, chafotalin, isochafotalin and inosine before and after processing of AR.Needle crystal structure of calcium oxalate processed by addingchanged obviously; The content of oxalic acid was the highest when it was soaked with a small amount of, and the lowest when it was only boiled with a large amount of; The content of total flavonoids was the highest in raw AR and the lowest in long-time soaking; The content of total saponins was the highest in raw AR, and the lowest in simple decoction with a large amount of; The content of total alkaloids in AR was the highest and that in water decoction was the lowest; The content of polysaccharide inwas the highest, while that in water was the lowest; The content of total protein was the highest in raw and the lowest in. Chemical components such as uridine, adenosine, uridine, and shafutaside changed in different degrees during processing.Six kinds of chemical components in RA have different degrees of changes in the processing process, and the addition oftreatment has the greatest impact on the components. The order of adding excipients and water decoction treatment can change the content of chemical components in AR, which provides a reference for the research on the processing mechanism of AR.
; processing; HPLC; UV-spectrophotometry; calcium oxalate; oxalic acid; flavonoids; saponin; alkaloids; polysaccharide; protein; uridine; adenosine; thymidine; guanosine; hypoxanthine; schaftoside; isoschaftoside;inosine;;
R283.1
A
0253 - 2670(2022)01 - 0087 - 12
10.7501/j.issn.0253-2670.2022.01.012
2021-06-03
国家自然科学基金青年项目(81803732);陕西省教育厅自然科学专项(20JK0598);陕西省科技厅重点研发计划项目(2021SF-385)
祁春艳,硕士研究生,从事中药炮制与饮片质量标准研究。Tel: 18097388619 E-mail: 1824060853@qq.com
赵重博,博士,副教授,从事中药炮制与饮片质量标准研究。Tel: (029)38185172 E-mail: zhao_chongbo@126.com
吴建华,硕士,副教授,从事中药炮制与饮片质量标准研究。E-mail: 549536693@qq.com
[责任编辑 郑礼胜]

