g-C3N4 负载 SnO2 纳米材料制备及光催化性能研究
金志行,李 响,李忠星,李妮波,王金姣
(1.辽宁工程技术大学材料科学与工程学院,辽宁阜新,123000;2.辽宁工程技术大学公共管理与法学院,辽宁阜新,123000;3.沈阳工业大学化学装备学院,辽宁辽阳,111003)
SnO2一般为白色或淡黄色晶体,属于宽带隙n型半导体,其化学稳定性好、制备成本低,是具有良好应用前景的光催化剂之一[1]。但纯SnO2纳米材料禁带宽度为3.6 eV,存在光催化速度慢、效率低的问题,从而限制其发展。g-C3N4是一种常见的典型聚合物,是一种特殊的半导体,结构中的原子以sp2杂化,形成高共轭度的体系。具有类似于石墨的片状结构,由氮化碳薄片通过层层堆叠而成,其中Npz轨道组成最高,占据分子轨道(HOMO);Cpz轨道组成最低,未占据分子轨道(LUMO),禁带宽度为2.7 eV,因此能够吸收太阳光谱中小于475波长的蓝紫光[2]。但经煅烧三聚氰胺或者尿素合成的g-C3N4比表面积小,电子和空穴极易复合,量子效率低。SnO2和g-C3N4具有不同的带隙宽度,可以降低光生电子-空穴的复合,提高光电荷的转移速度,增强催化剂的降解效率[3-4]]。本文以三聚氰和草酸钠胺为主要原料,分别制备了g-C3N4和SnO2,再将g-C3N4和SnO2两者进行复合反应,制备g-C3N4/SnO2复合材料,并进行了分析和性能检测。
1 实验部分
1.1 试剂
三聚氰胺、草酸钠、氢氧化钠、氯化亚锡、罗丹明B(以上试剂均购自上海阿拉丁生化科技股份有限公司),无水乙醇(购自天津市恒兴化学试剂制造有限公司),去离子水(实验室自制)。
1.2 样品制备
1.2.1 g-C3N4的制备
利用热分解法制备g-C3N4,称量 10 g 三聚氰胺置于坩埚,然后将坩埚放入马弗炉以10 ℃/min 的速率升高到500 ℃煅烧 3 h。待马弗炉冷却后,取出研磨得到黄色粉末状物质。
1.2.2 SnO2的制备
将2 mmol SnCl2·2H2O 溶于 20 mL水中,记为溶液 A;将1.5 mmol NaC2O2溶于 15 m L水, 记为溶液 B ,分别搅拌10 min,将溶液 B 倒入溶液 A中,搅拌10 min,将8 mmo1 NaOH加入到35 mL 水中记为 C,搅拌 10 min,然后在磁力搅拌过程中将 C 溶液缓慢滴加到溶液 A 中,继续搅拌 10 min 。将溶液倒入不锈钢反应釜中,干温度 180 ℃ ,加热 12 h ,抽滤,洗涤,在60℃干燥12h,得到 SnO2。
1.2.3 g-C3N4负载 SnO2复合材料的合成
将制备好的样品分别称量 0. 1g SnO2和 0.02g g-C3N4充分研磨后置于坩埚中密封,放于马弗炉中,以 10 ℃/min的速率升温至 550 ℃,并保持 2 h ,自然冷却至室温后将所得的淡黄色粉末放入 10mL无水乙醇中超声震动 1h ,停止后用去离子水和无水乙醇离心洗涤后放入干燥箱中80℃保温12 h 进行冷却[5]。
1.2.4 g-C3N4/SnO2复合光催化剂活性测试及表征
配制 100 mL 浓度为 10 mg/LRhB 溶液 ,另取出 5 mL溶液置于小离心管中,标为 origin。然后将 0 .05 g 合成后的 SnO2纳米材料加入到剩余溶液中 ,在阴暗条件搅拌 30 min ,再取出 5 mL 溶液放入另一离心管中 ,标为 absorb 。之后,将混有SnO2样品的染料溶液放入光化学反应仪中 ,用 500 W 汞灯照射(测试过程中,灯与装有溶液的试管间的间距不变),每隔 15 min 抽取 5 mL 溶液,直至 120 min。将每次抽取的溶液进行离心( 3000 r/min ,5 min ) ,取上层澄清溶液 ,测试其紫外吸收光谱,根据谱图中的特征吸收峰强度,根据降解率公式I=(1-C/C0)来计算最终降解率,评价各合成产物降解有机染料的能力。公式中C0为RhB的初始浓度,C为光照下RhB的实时浓度。
2 结果与讨论
2.1 不同g-C3N4加入量对SnO2形貌的影响
图1为固定反应时间12 h、反应温度180 ℃,主盐SnCl2·2H2O加入量0.45 g、NaC2O2加入量0.2 g、NaOH加入量0.32g,不同g-C3N4加入量的形貌图。

(a)0.02 g g-C3N4 (b)0.04 g g-C3N4
如图1 (a),当 g-C3N4加入量为 0.02 g 时,出现了较小的纳米片,且片状不明显;从图1(b)看出,当g-C3N4加入量为 0.04 g 时,SnO2纳米片变薄,片状明显,分布均匀,分散性较好,g-C3N4很好地融入 SnO2晶粒中;如图 1 (c)、(d)可以看出,当g-C3N4含量过多,SnO2纳米片变得过薄,没有充分生长,而且 SnO2纳米片形貌不均匀,尺寸不均一,纳米片过于密集,分散性不好[6]。
2.2 g-C3N4 负载 SnO2 的 XRD 结果分析
图2是g-C3N4负载 SnO2纳米材料的 XRD 表征。

图2 g-C3N4 负载 SnO2 纳米材料的 XRD 表征
图2为SnO2纳米材料的 XRD 表征,g-C3N4的 XRD 表征和 g-C3N4加入量分别为 0.02 g/0.04 g/0.06 g/0.08 g的 g-C3N4负载 SnO2纳米材料的 XRD 表征。从图2中可以看出,g-C3N4的单体衍射峰与 PDF#87-1528标准卡片的数据一致,在 27.3 °对应(002)晶面。将其与 JCPDS NO:41-1445国际衍射卡片对比后发现所有的衍射峰位置与 SnO2衍射峰一致,无杂峰,说明复合成功。
2.3 g-C3N4负载 SnO2 的光催化测试结果及分析
0.02 g 的g-C3N4负载 SnO2纳米材料在紫外光照射下降解 RhB吸收光谱如图 3(a);0.04 g 的 g-C3N4负载 SnO2纳米材料在紫外光照 射下降解 RhB 的吸收光谱如图 3 (b) ; 0.06 g 的 g-C3N4负载 SnO2纳米材料在紫外光照射下降解的吸收光谱如图 3 (c); 0.08 g 的 g-C3N4负载 SnO2纳米材料在紫外光照射下降解 RhB 的吸收光谱如图 3 (d) 。
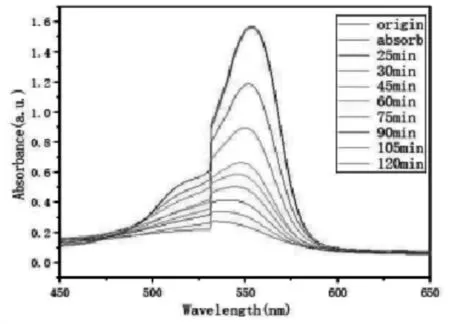
(a)0.02 g
通过计算得知,g-C3N4负载 SnO2复合材料降解 RhB 有机染料所需的时间为 120 min。 加入不同量g-C3N4合成的 g-C3N4负载 SnO2纳米材料降解RhB 最终降解率分别为: 76.64%、85.87%、80.36%、74.23% 。由此可见 g-C3N4加入量为 0.04 g 的g-C3N4负载 SnO2纳米材料 对 RhB 有机染料的降解率最高。
根据实验结果和理论结果,推出一种可能的 g-C3N4负载 SnO2复合材料可见光光催化机理,如图4所示。当分散的 SnO2与 g-C3N4表面接触时,电子将从g-C3N4扩散到 SnO2,形成一个内部电场 ,直至 g-C3N4和 SnO2的费米能级达到平衡 ,构成 g-C3N4/SnO2异质结 。 当紫外光照射该异质结构时 ,g-C3N4和 SnO2两者都会被激发,产生光生电子-空穴对 。在内部电场的作用下 ,光生电子向正电场(g-C3N4)移动 ,空穴 向 负 电场( SnO2)移动 。致使光生电子空穴转移[7-8]。综上所述 ,g-C3N4负载 Sn复合材料具有良好的紫外光光催化活性主要有两个原因:第一个是通过处理缩小能带间隙 ,进而扩大 g-C3N4负载 SnO2复合材料的响应范围 ,提高紫外光吸收;第二个是酸处理还能促进电荷转移 ,减少载流子的重组 ,进而推进光催化过程 。光催化效率的提高主要是由于 g-C3N4和 SnO2的分散性较好[9],所以产生的异质结构接触界面好并且提供了更多的反应位点,有效抑制了光生电子-空穴对的复合,从而进一步提高了 g-C3N4负载 SnO2复合材料的光催化活性[10]。
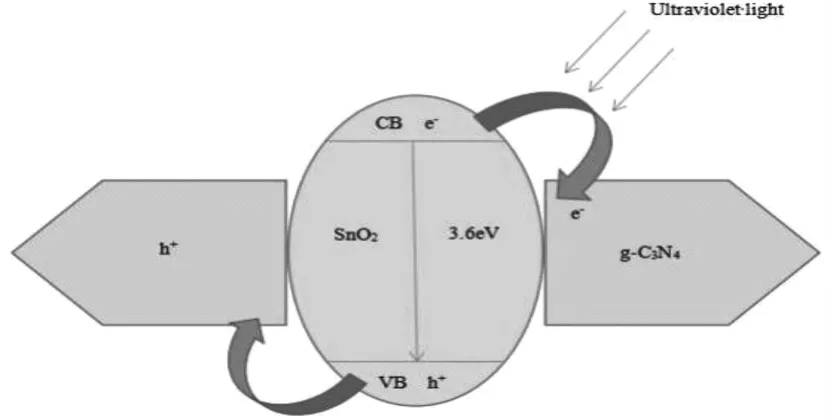
图4 g-C3N4 负载 SnO2 复合材料的光催化机理示意图
3 结论
(1)反应温度和反应时间对花形 SnO2纳米材料和 g-C3N4负载 SnO2纳米材料的形貌有很大的影响。若反应温度低、反应时间短,花形 SnO2纳米材料和 g-C3N4负载 SnO2纳米材料的尺寸就相对短小;反应温度高和反应时间长,花形 SnO2纳米材料和g-C3N4负载 SnO2纳米材料的尺寸会过大不易生长组装。
(2)NaOH加入量过低,实验环境碱性过低,Sn在碱性溶液中以 SnO32-形式存在,数量较少,不能很好地合成 SnO2纳米材料;NaOH 加入量过多,实验环境碱性增大,SnO2纳米片生长得过大且纳米片间的分散性变差。
(3)纯 SnO2纳米材料对 RhB 降解率为 76.86% ,复合材料对 RhB 降解率为 85.87% ,比单一的 SnO2和单一的 g-C3N4都要高,表明复合改性这种方法能有效提高 SnO2的光催化性能。
(4)相较 SnO2纳米材料和 g-C3N4,加入g-C3N4复合的 g-C3N4负载 SnO2纳米材料对RhB的光催化降解率显著提升,且降解速度更快。

