纳米硫化铜复合物光热治疗对舌鳞状细胞癌的体内外抑制作用
陈 栋,陈之锋,王 邹,杨雅洁,蒋艳萍,胡 琛
南方医科大学南方医院口腔科,广东 广州510515
舌癌是最为常见的口腔鳞癌,手术、化疗和放疗是治疗口腔鳞癌的传统疗法,但会对病人身体造成不可避免的伤害[1,2]。
光热治疗(PTT)是近年来被广泛研究的一种新型肿瘤治疗方法,利用具有较高光热转换效率的材料靶向肿瘤,并在近红外光的照射下将光能转化为热能,利用癌细胞不耐热的特性来杀死癌细胞,具有副作用小、操作简单、治疗精准等优点[3-7]。并且,位于皮肤浅表部位的病灶区域对PTT有更加良好的作用,因此PTT是口腔鳞癌的一种新型而有效的治疗手段。近年来,越来越多的光热纳米粒子被研发用于口腔鳞癌治疗,如Fe3O4@Au/rGO[8],Cu2-xS-RB@DMSN-AE105[8]及Ag3AuS2[9]等,这些新型金属纳米复合物在口腔鳞癌治疗中发挥了优异的抗肿瘤作用,体现了光热治疗在口腔鳞癌具有广泛的应用前景。然而,金属材料体内生物安全性仍然是一个尚未解决的重大问题,这阻碍了它们在临床中的广泛应用。由机体中天然存在物质组成的PTT试剂可有效增加纳米复合物的生物安全性,避免产生严重不良反应,此类生物制剂在临床上具有广泛的应用价值[10]。硫化铜纳米粒子(CuS NPs)因其优异的吸附性、高效的光热转换效率和其简易的制备方法而被广泛研究,应用于各类癌种的治疗中[11,12]。然而,CuS NPs的改性是增加生物安全性和临床PTT应用的关键[13-17]。近年来,以蛋白质为模板的蛋白质生物矿化技术指导无机纳米粒子的合成,为构建功能性金属硫化物提供了另一种方法,可以满足生物医学应用的要求,但当前以蛋白质为模板的硫化铜纳米粒子用于舌癌光热治疗尚未见报道。因此,在本研究中,我们利用牛血清蛋白(BSA)可以鳌合金属的特点,以及其可以帮助纳米粒子抵御生物体的清除机制及增加生物安全性的优点,以BSA为模板,成功合成了BSA@CuS-NPs纳米复合物,并且,在此基础上进一步修饰聚乙二醇(PEG)以进一步增加其生物相容性,为CuS纳米粒子在舌癌中的转化与应用奠定基础。
1 材料和方法
1.1 主要试剂和仪器
DF-101Z集热式恒温加热磁力搅拌器(巩义予华仪器有限公司);ME104E 电子天平[梅特勒-托利多仪器(上海)有限公司];Z90马尔文激光粒度仪(Malvern);756PC紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);硝酸铜[Cu(NO3)2·3H2O,含量质量分数99%,北京伊诺凯科技有限公司];硫化钠(Na2S·12H2O,含量质量分数95%,北京伊诺凯科技有限公司);1064 nm 激光仪(北京镭志威光电技术有限公司);细胞培养基、胎牛血清及Matrigel基质胶(Corning);CCK-8细胞增殖试剂盒、细胞周期检测试剂盒(上海凯基公司)、流式细胞仪(BD)。
1.2 实验动物
实验动物为SPF健康雌性balb/c小鼠,4~6周龄,体质量16~18 g,购于南方医科大学实验动物中心。将小鼠随机分为空白对照组及生理盐水组,5只/组。所有动物实验均通过南方医科大学南方医院伦理委员会审核,所有实验程序都遵循《赫尔辛基宣言》。
1.3 方法
1.3.1 BSA@CuS-PEG纳米复合物的制备 根据生物矿化策略制备。将Cu(NO3)2·3H2O(0.05 mol/L,2 mL)水溶液加入BSA(40 mg/mL,10 mL)溶液中,在50 ℃的水浴中进行磁力搅拌。5 min后,加入适量的NaOH溶液调节体系的pH值至12。随后,向上述体系中注入的Na2S·9H2O(0.4 mol/L,4 mL)。继续搅拌4 h后,收集溶液,用去离子水透析48 h,除去多余的Cu2+和碱性溶液,冻干收集样品,可得到BSA@CuS纳米复合物。再者,将mPEG(1 mg/mL,5 mL)水溶液加入BSA@CuS(1 mg/mL,10 mL)溶液中,在常温下进行磁力搅拌24 h,冻干收集样品,可得到BSA@CuS-PEG纳米复合物。
1.3.2 细胞培养 Cal27及SCC9细胞培养使用含10%胎牛血清的DMEM培养基、置于37 ℃5%CO2培养箱中进行培养。每24 h更换1次培养基,细胞密度超过70%时,以0.25%胰酶消化进行传代培养。
1.3.3 BSA@CuS-PEG纳米复合物光热性能评估 利用溶液方法研究纳米材料的光热性能,利用温度成像仪测量在激光照射下溶液温度的变化。取制备的BSA@CuS-PEG纳米复合物水溶液(60 μg/mL,500 μL)与对照的空白溶剂去离子水,采用波长为1064 nm近红外激光(光强0.5 W·cm-2)照射10 min,期间每60 s记录1次温度,描绘温度曲线及光热图。
1.3.4 CCK-8细胞毒性实验 首先将处于对数生长期的Cal27及SCC9细胞经胰酶消化后获得单细胞悬液,并进行细胞铺板,置于恒温孵育箱中培养24 h;随后,待细胞贴壁后,在每孔中加入不同浓度(0、2、4、16、24、32 μg/mL)的BSA@CuS-PEG 纳米复合物进行光照或者非光照处理,继续放置在孵育箱中培养24 h;然后,去除培养基、收集细胞沉淀分别进行CCK-8细胞毒性实验。
1.3.5 细胞周期检测实验 将处于对数生长期的Cal27及SCC9细胞经胰酶消化后获得单细胞悬液,并进行细胞铺板,置于恒温孵育箱中培养24 h;待细胞贴壁后,在每孔中加入BSA@CuS-PEG纳米复合物(8 μg/mL)进行光照或者非光照处理,继续放置在孵育箱中培养24 h;去除培养基、收集细胞沉淀利用流式分选技术分析细胞周期实验。
1.3.6 纳米复合物体内成像 为更好了解BSA@CuSPEG 纳米复合物的体内分布情况,利用Cy5.5 标记BSA@CuS-PEG纳米复合物,利用单侧荷瘤模型对小鼠进行体内材料分布实验:将小鼠分为实验组(n=3)及对照组(n=3),分别通过尾静脉予以注射Cy5.5 标记BSA@CuS-PEG纳米复合物(6 mg/kg,200 μL)及单纯的Cy5.5商用试剂(200 μL),观察小鼠肿瘤区域及小鼠其他区域的荧光强度。
1.3.7 纳米复合物体内抗肿瘤作用 构建皮下单侧荷瘤的Balbc小鼠模型,将小鼠随机分为实验组(n=5)及对照组(n=5),分别予尾静脉注射BSA@CuS-PEG纳米复合物(6 mg/kg,200 μL)及生理盐水(200 μL),24 h后用NIR(0.5 w/cm2,5 min)照射单侧皮下肿瘤,连续记录小鼠瘤体体积并绘制生长曲线;3周后,用戊巴比妥对小鼠实施安乐死,留取肿瘤组织进行称重及体积测量。
1.3.8 统计学分析 所有数据均采用IBM SPSS 20.0处理。计数资料比较则采用卡方检验。采用Kaplan-Meier法进行生存分析,并用Log-rank检验比较组间差异。对以上结果均进行双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 BSA@CuS-PEG纳米的理化性质
本实验成功制备BSA@CuS-PEG纳米复合物,透射电镜图显示BSA@CuS-PEG纳米复合物粒径约为20~30 nm,纳米粒子为光滑圆球形,尺寸均匀,分散良好(图1A)。对BSA@CuS及BSA@CuS-PEG的水合粒径及Zeta电位进行分析,经由马尔文粒径仪测得,BSA@CuS和BSA@CuS-PEG的水合平均粒径分别为10 ±1.1 nm和15±2.1 nm,而其平均Zeta电位分别为-11±2.1 mⅤ和-16±1.5 mⅤ(图1B、C)。

图1 BSA@CuS-PEG理化表征Fig.1 Characterization of BSA@CuS-PEG nanoparticles.A:Transmission electron microscopic images of BSA@CuS-PEG nanoparticles.B:Particle size distribution of BSA@CuS and BSA@CuS-PEG nanoparticles.C:Surface charge of BSA@CuS and BSA@CuS-PEG nanoparticles.Data are shown as Mean±SD(n=3).
2.2 BSA@CuS-PEG纳米颗粒的光热性能
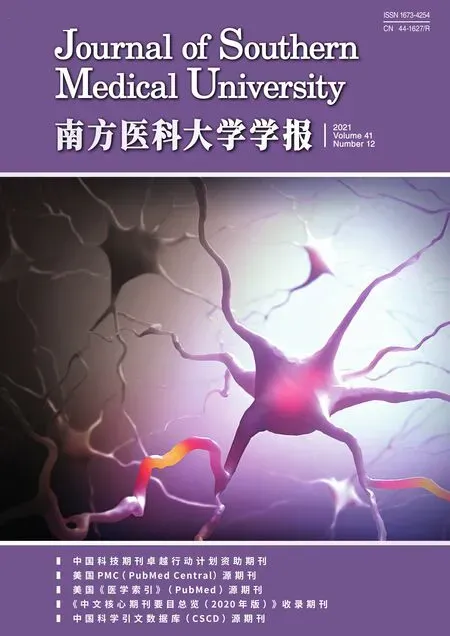
为进一步证明被成功合成,我们对其进行紫外光谱分析,紫外吸收图谱显示紫外光谱在近红外二区区域有紫外吸收,可以证明其具有近红外二区光吸收的功能(图2A)。利用近红外二区激发光(1064 nm)对其进行激发,通过对温度曲线和光热图的分析发现,相比于超纯水组,BSA@CuS-PEG纳米复合物在0.5 W/cm2功率下的溶液温度呈先快速增高,后缓慢升高趋势,其变化温度值(ΔT)约为30 ℃,显示出良好的光热性能(图2B、C)。
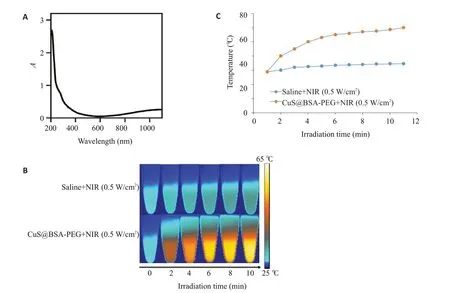
图2 BSA@CuS-PEG纳米颗粒的光热性能Fig.2 Infrared thermographic capacity of BSA@CuS-PEG nanoparticles.A:UV-vis absorption spectrum of BSA@CuS-PEG nanoparticles.B,C:Curves of temperature changes induced by BSA@CuS-PEG nanoparticles and saline under NIR irradiation(0.5 W/cm2).
2.3 BSA@CuS-PEG纳米的体外抗肿瘤效应
CCK-8细胞毒性实验结果显示(图3 A、B),在无光照的情况下,不同浓度BSA@CuS-PEG纳米复合物(0、2、4、16、24、32 μg/mL)处理的Cal27及SCC9的存活率均高于75%。相比于纯材料组,BSA@CuS-PEG联合近红外光照射对Cal27及SCC9舌癌细胞具有显著抑制增殖作用(BSA@CuS-PEG+NIRvsBSA@CuS-PEG,P<0.001)。流式细胞学实验结果显示:相比于纯材料组,BSA@CuS-PEG 联合近红外光照射使Cal27 及SCC9 舌癌细胞更多被阻滞于G2/M 期(BSA@CuSPEG+NIRvsBSA@CuS-PEG,P<0.001,图3C、D)。

图3 BSA@CuS-PEG纳米复合物抗肿瘤作用Fig.3 In vitro anti-tumor effect of BSA@CuS-PEG.A:Viabilities of Cal27 cells after incubation with BSA@CuS-PEG with or without NIR irradiation (0.5 W/cm2) detected by CCK-8 assay.B:Viabilities of SCC9 cells after incubation with BSA@CuS-PEG with or without NIR irradiation (0.5 W/cm2) detected by CCK-8 assay.C,D:Cell cycle changes of Cal27 and SCC9 cells after incubation with BSA@CuS-PEG with or without NIR irradiation (0.5 W/cm2) detected by flow cytometry.Data are shown as Mean±SD (n=3).*P<0.001.
2.4 BSA@CuS-PEG纳米的在体分布图
利用Cy5.5标记BSA@CuS-PEG纳米复合物,利用单侧荷瘤模型对小鼠进行体内材料分布实验。经过尾静脉注射后,利用活体成像仪对小鼠体内材料分布进行分析可以发现,Cy5.5标记BSA@CuS-PEG纳米复合物在小鼠癌灶区域聚集并表达荧光,而单纯的Cy5.5处理的小鼠癌灶区域没有荧光表达(P<0.001,图4A、B)。
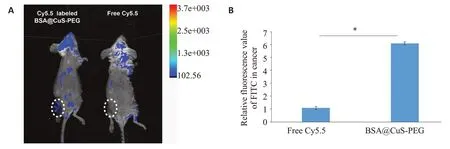
图4 BSA@CuS-PEG纳米复合物活体成像Fig.4 In vivo fluorescence imaging of BSA@CuS-PEG nanoparticles.A:Fluorescence image tumor bearing mice at 24 h after treatment with Cy5.5 loaded BSA@CuS-PEG.B:Fluorescence intensity at the tumor loci(n=3).*P<0.001.
2.5 BSA@CuS-PEG纳米的体内抗肿瘤效应
本研究构建了小鼠单侧皮下荷瘤模型,经尾静脉注射不同处理组的药物后,定期监测裸鼠瘤体直径,结果显示:与生理盐水处理组相比较,BSA@CuS-PEG纳米复合物组的肿瘤抑制率高达90%(P<0.001,图5A~D)。

图5 BSA@CuS-PEG纳米复合物体内抗肿瘤作用Fig.5 In vivo anti-tumor effect of BSA@CuS-PEG.A:Tumors dissected from mice treated with saline or BSA@CuS-PEG.B:Volume of Cal27 tumors dissected from the mice.C:Relative volume of Cal27 tumors isolated from mice.D:Weight of Cal27 tumors isolated from mice(n=5).*P<0.001.
3 讨论
近年来,CuS NPs被作为重要的光热治疗剂,用于体外肿瘤细胞光热治疗研究,具有良好的抗肿瘤效应[18]。CuS NPs被证明在多个癌肿中均具有良好的光热效应,产生良好的抗肿瘤作用,但是目前尚未有研究阐明CuS NPs在舌癌中的应用。据研究报道,利用希瓦氏菌合成5 nm左右的稳定纳米粒子CuS NPs,具有较强的光热作用,光热转换效率达到27.2%,在短时间近红外光照射下能对人肺腺癌上皮A549细胞系产生卓越的光热杀伤能力[19],但此CuS NPs 纳米粒子存在生物相容性低、制备较复杂的问题,阻碍其大批量生产及临床应用。在本研究中,我们报道了一种具有良好的分散性、稳定性、生物相容性、易于合成和较高的光热效应的金属硫化物。相比于传统的CuS纳米复合物,本研究所合成的BSA@CuS-PEG纳米复合物,具有更好的分散性及更高的稳定性及生物相容性,但对其光热效应无明显影响。相比于传统的CuS纳米复合物合成,我们合成方法更加简便及有效。本研究利用BSA作为模板,其中的半胱氨酸残基可转化为活性硫阴离子,与金属离子发生硫化物成核反应从而成功合成BSA@CuS NPs。此反应能精确控制形成的CuS 纳米粒子的大小和形态,增加CuS纳米粒子合成的可控性。同时,由于我们对BSA@CuS NPs 进一步修饰了PEG,不同浓度的BSA@CuS-PEG纳米复合物处理的细胞存活率均高于75%,因此相比于报道的传统的CuS纳米复合物[19],本研究BSA@CuS-PEG纳米复合物具有更加优化的生物相容性,为临床应用奠定基础。
传统的CuS NPs 在近红外区有很强的吸收能力和较高的光热转换效率,使用Hela 细胞系进行体外光热治疗研究,结果表明CuS NPs 在功率为2 W/cm2的近红外激光照射下会对Hela 细胞产生明显的杀伤效果[20],这表明CuS NPs在临床癌症治疗中具有广阔前景。然而,近年来美国食品药物管理局多次提出:过高的近红外照射功率(>0.75 W/cm2)对人体组织会有安全隐患。在本研究中,经过对CuS NPs合成工艺的改进,合成的BSA@CuS-PEG纳米复合物经过0.5 W/cm2的近红外二区(1064 nm)光照下,10 min后的温度升高幅度可达30 ℃。相比于纯材料组,BSA@CuS-PEG联合近红外光照射对Cal27及SCC9舌癌细胞具有显著抑制增殖作用,使得舌癌细胞更多被阻滞于G2/M期。因此,本研究利用BSA所提供的蛋白外壳不仅赋予CuS良好的生物相容性,相比于报道的CuS NPs[20],BSA@CuS-PEG可在相对安全的近红外二区(1064 nm)的低功率光照下达到良好的光热转化效能及优异的抗肿瘤效果。
有研究指出,将水溶性CuS NPs 包裹在介孔二氧化硅纳米粒子内,在表面修饰Trc105 聚合物并结合同位素64Cu,功合成了纳米粒子64Cu-CuS@MSN-Trc105,该研究证实64Cu-CuS@MSN-Trc105纳米粒子可以到达肿瘤组织,在动物实验中表现出显著的肿瘤热消融现象,在治疗后2个月未发现复发现象[21],但该研究利用64Cu这一具有放射性的正电子材料,存在辐射副作用。在本研究中,BSA所提供的蛋白外壳不仅赋予CuS良好的生物相容性,降低副作用,为临床应用奠定基础。而且,其蛋白外壳也有利于荧光染料的进一步功能化。在本研究中,我们对BSA@CuS-PEG纳米复合物进行Cy5.5标记,其成功标记也归因于BSA外壳的存在,赋予了纳米材料光学成像能力。利用Cy5.5标记的BSA@CuS-PEG纳米复合物探究体内分布情况,显示出良好的纳米材料肿瘤聚集特性。这是由于高通透-滞留效应使得纳米材料能够在肿瘤部位大量聚集从而提高肿瘤的治疗效果。并且,由于BSA模板及PEG的修饰作用,使其具有较小的毒副作用[22-24]。本研究通过单侧皮下荷瘤模型的构建,进一步证明了BSA@CuSPEG纳米复合物的优良光热治疗效果。
综上,本研究成功制备具有光热治疗作用的BSA@CuS-PEG,并在体外和体内都得到了验证,通过透射电镜,水合粒径,Zeta电位及紫外吸收光谱的研究分析表明,BSA@CuS-PEG被成功制备,同时,通过对BSA@CuS-PEG 的光热特性进行分析,BSA@CuSPEG,变化温度值(ΔT)约为30 ℃具有优良的光热性能。然后,进一步对BSA@CuS-PEG体外体内抗肿瘤作用进行分析,研究结果得出BSA@CuS-PEG有良好的抗肿瘤作用。因此,此研究为舌癌原发灶无创早期诊断和非手术治疗提供一种潜在思路和手段。