贝伐单抗通过抑制mTOR通路对卵巢癌腹水模型裸鼠的改善作用
张竣,周敏,王海雅,刘俊丽
(西安交通大学医学院附属陕西省肿瘤医院妇瘤科,西安 710061)
卵巢癌是妇科常见的恶性肿瘤之一,致死率居各类妇科肿瘤的首位[1]。卵巢癌进展至中晚期时可发生腹腔转移,此时淋巴系统受到癌细胞的侵犯导致肿瘤细胞在淋巴管中繁衍、生长,从而阻塞淋巴管回流,造成腹腔内大量淋巴组织渗出,形成腹水[2]。因此,腹水是卵巢癌患者直接且重要的临床表现。贝伐单抗是重组人源化单克隆抗体,能与人血管内皮生长因子(vascular endothelial growth factor,VEGF)特异性结合并阻断其生物活性,发挥抑制肿瘤生长的作用[3]。目前,临床已将贝伐单抗应用于结直肠癌、肺癌等恶性肿瘤的辅助治疗[4-5]。有研究发现,卵巢癌腹水的形成及腹水量与VEGF水平异常有关,推测贝伐单抗对卵巢癌腹水有良好的改善作用[6]。但贝伐单抗改善卵巢癌腹水作用机制的报道较少。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种能调节细胞生长、增殖的蛋白激酶,mTOR信号通路调控异常与多种肿瘤的形成、增殖及恶化密切相关,当mTOR信号通路被激活时,其直接底物真核起始因子4E结合蛋白1(4E binding protein 1,4E-BP1)发生磷酸化,导致磷酸化4E-BP1(phosphorylation-4E-BP1,p-4E-BP1)表达增加,从而促进肿瘤细胞的侵袭和迁移[7]。本研究主要分析贝伐单抗通过抑制mTOR通路对卵巢癌腹水模型裸鼠的改善作用。
1 材料与方法
1.1实验材料 40只无特定病原体级8周龄雌性BALB/c裸鼠,体重19~25 g,购自北京维通利华实验动物技术有限公司(生产许可证:SCXK2017-0011)。卵巢癌细胞HO-8910购自上海奥陆生物科技有限公司,mTOR购自上海泽叶生物科技有限公司(批号:20180508)、3-苄基-5-(2-硝基苯氧甲基)-γ-丁内酯(3-benzyl-5-(2-nitrophenoxymethyl)-γ-butyrolactone,3BDO)购自美国MedChemExpress LLC公司(批号:20180724),贝伐单抗购自上海麦克林生化科技有限公司(纯度≥95%,批号:20170928),磷酸盐缓冲液购自北京汇智泰康医药技术有限公司(批号:0111261),Tris-HCl缓冲盐溶液+Tween(Tris buffer saline+Tween,TBST)购自上海联迈生物工程有限公司(批号:150418-1),0.25%胰酶购自上海慧颖生物科技有限公司(批号:1297729),胎牛血清购自沃卡威(北京)生物技术有限公司(批号:10099-141),杜尔贝科改良伊格尔培养基购自深圳子科生物科技有限公司(批号:12322-1),550型全自动酶标仪购自上海坤科仪器设备有限公司,苏木精-伊红染液及试剂盒购自上海西格生物科技有限公司(批号:10615-19),伊文思蓝染色液购自北京索莱宝科技有限公司(批号:1161546),RNA提取试剂盒购自上海睿时生物科技有限公司(批号:7490411),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)内参购自北京百奥莱博科技有限公司(批号:20180624),mTOR(批号:201800513)、磷酸化mTOR(phosphorylation-mTOR,p-mTOR)(批号:20170723)及4E-BP1(批号:20170915)、p-4E-BP1(批号:20180525)一抗、二抗购自美国CST公司。
1.2细胞培养 将卵巢癌细胞HO-8910置于10%胎牛血清的杜尔贝科改良伊格尔高糖培养基,并于37 ℃、5% CO2孵箱中培养,3~5 d传代1次。待细胞贴壁生长约80%融合度后,取对数生长期细胞进行0.25%胰酶消化,以离心半径12 cm,1 000 r/min离心5 min,弃上清液,磷酸盐缓冲液重悬。
1.3卵巢癌腹水裸鼠模型的构建及分组 所有裸鼠均腹腔接种卵巢癌细胞HO-8910,将200 μL注射于40只裸鼠腹腔内(每只3×106个细胞),2周后裸鼠出现腹部膨隆、活动减少、厌食等症状提示腹水形成[8]。40只裸鼠建模成功36只,按照随机数字表法分为3组,各12只,模型组给予等量0.9%氯化钠溶液,3BDO+贝伐单抗组给予0.1 nmol/L 3BDO+5 mg/kg贝伐单抗,贝伐单抗组给予5 mg/kg贝伐单抗,各组均采用腹腔注射给药,连续给药28 d后以颈椎脱臼法处死。
1.4腹水平均体积及腹膜渗透性的检测 给药结束后,每组随机选取6只裸鼠处死,采用无菌注射器收集腹水,计算各组腹水平均体积。每组剩余6只裸鼠用于腹膜渗透性的检测:0.25 mL 5%伊文思蓝染色液缓慢注射于裸鼠尾静脉,2 h后处死裸鼠并将收集的腹水离心,以酶标仪540 nm检测上清液伊文思蓝的吸光度,分析腹膜渗透性的D(λ)值。
1.5观察肿瘤组织病理改变 切取腹膜腔内部分肿瘤组织置于10%甲醛溶液固定,经洗涤、脱水、透明后的组织块用石蜡包埋,切片后进行苏木精-伊红染色,封存。观察各组肿瘤组织病理改变情况,并使用显微相机进行拍照。
1.6mTOR、4E-BP1 信使RNA(messenger RNA,mRNA)表达检测 采用Trizol法提取肿瘤组织总RNA,反转录合成互补DNA,再以反转录聚合酶链反应扩增目的基因,设计GAPDH为内参基因。mTOR基因上游引物序列:5′-GGCTACTTGACTCGTTAGAGTC-3′,下游引物:5′-CCTAGGTCACACGTGTCACTTGAG-3′,长度317 bp。4E-BP1基因上游引物序列:5′-ACCAGGTACTTACGGTCGTC-3′,下游引物:5′-TACACTTCACAGGCTAAC-3′,长度289 bp。GAPDH内参基因上游引物序列:5′-AGCCTTAACGGTCATCACTGTA-3′,下游引物:5′-GCAATCGCTTGCCACAGTGACCTG-3′,长度265 bp。聚合酶链反应扩增条件:94 ℃预变性5 min,95 ℃变性40 s,60 ℃退火50 s,72 ℃延伸50 s,重复40个循环。聚合酶链反应产物以90 V电泳30 min,凝胶成像仪拍照记录,mTOR/GAPDH、4E-BP1/GAPDH表示mRNA相对表达量。
1.7蛋白免疫印迹法检测mTOR、p-mTOR和4E-BP1、p-4E-BP1的表达 收集各组肿瘤组织,裂解后提取总蛋白,蛋白质定量法测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转至聚偏氟乙烯膜上,膜置于5%脱脂奶粉配制的TBST液中室温封闭1 h后,加入一抗,4 ℃摇床孵育过夜。取出膜并用TBST缓冲液洗膜3次后加入二抗,室温摇床孵育2 h,再次用TBST缓冲液洗膜3次,以化学发光法检测。显色后曝光显影,拍照,Image J分析灰度值,目的蛋白与GAPDH灰度值的比值为相对表达量。

2 结 果
2.13组腹水平均体积及腹膜渗透性比较 28 d给药后36只裸鼠均存活。3组腹水平均体积及腹膜渗透性比较差异有统计学意义(P<0.01);与模型组比较,3BDO+贝伐单抗组和贝伐单抗组腹水平均体积减小、腹膜渗透性降低(P<0.05);与3BDO+贝伐单抗组比较,贝伐单抗组腹水平均体积减小、腹膜渗透性降低(P<0.05)。见表1。

表1 3组雌性卵巢癌腹水模型裸鼠腹水平均体积及腹膜渗透性比较
2.23组肿瘤组织病理改变情况 苏木精-伊红染色后光镜下观察,模型组可见肿瘤细胞呈圆形或椭圆形,胞质饱满,细胞核明显增大,核仁深染;3BDO+贝伐单抗组可见部分肿瘤细胞皱缩减小,核分裂象减少,且有小片状坏死区;贝伐单抗组肿瘤组织内可见凋亡小体以及片状坏死区,肿瘤细胞残存小巢状肿瘤细胞。见图1。
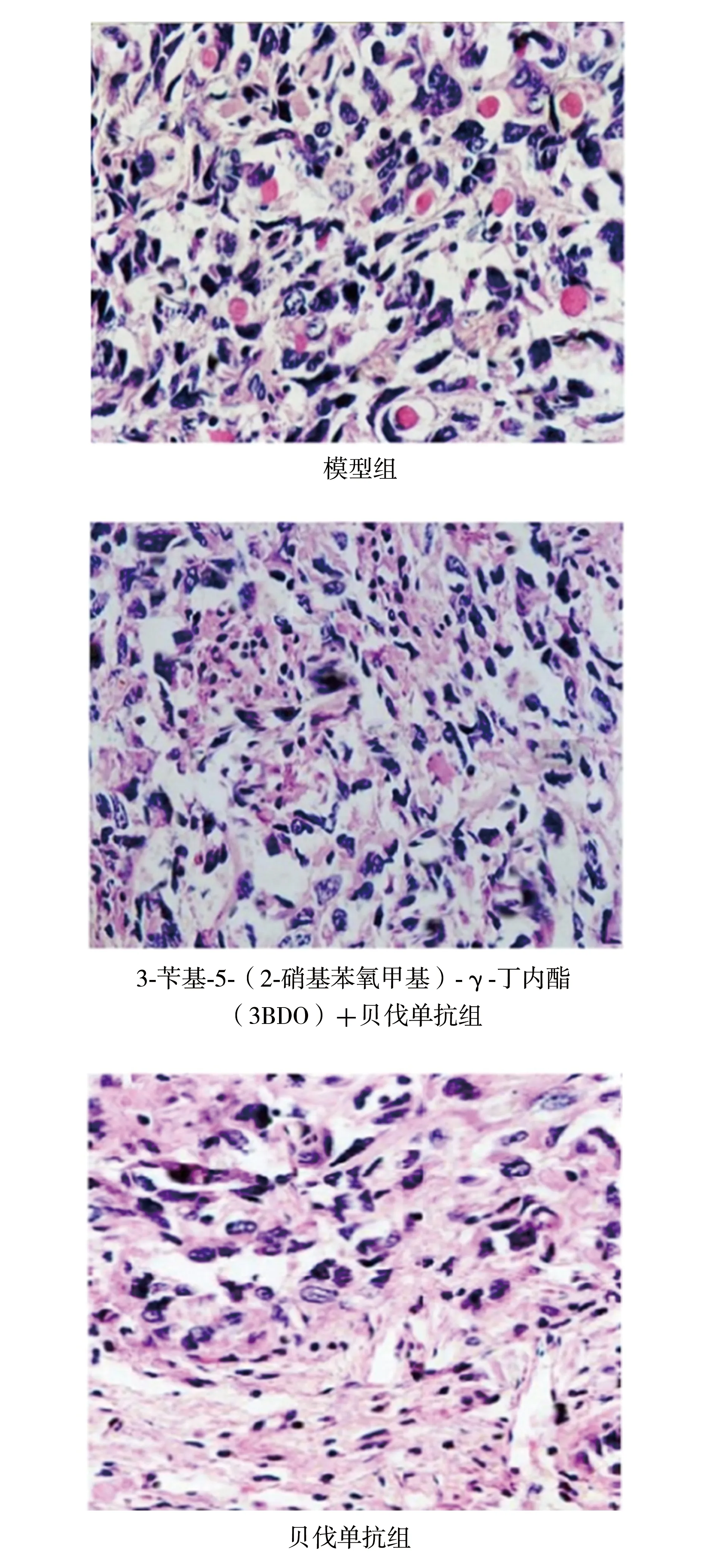
图1 3组雌性卵巢癌腹水模型裸鼠肿瘤组织病理改变情况(苏木精-伊红染色,×400)
2.33组雌性大鼠相关蛋白表达情况比较 3组p-mTOR/mTOR、p-4E-BP1/4E-BP1比较差异有统计学意义(P<0.01);与模型组比较,3BDO+贝伐单抗组和贝伐单抗组p-mTOR/mTOR、p-4E-BP1/4E-BP1均降低(P<0.05);与3BDO+贝伐单抗组比较,贝伐单抗组p-mTOR/mTOR、p-4E-BP1/4E-BP1均降低(P<0.05)。见表2、图2。

表2 3组雌性卵巢癌腹水模型裸鼠p-mTOR/mTOR、p-4E-BP1/4E-BP1比较
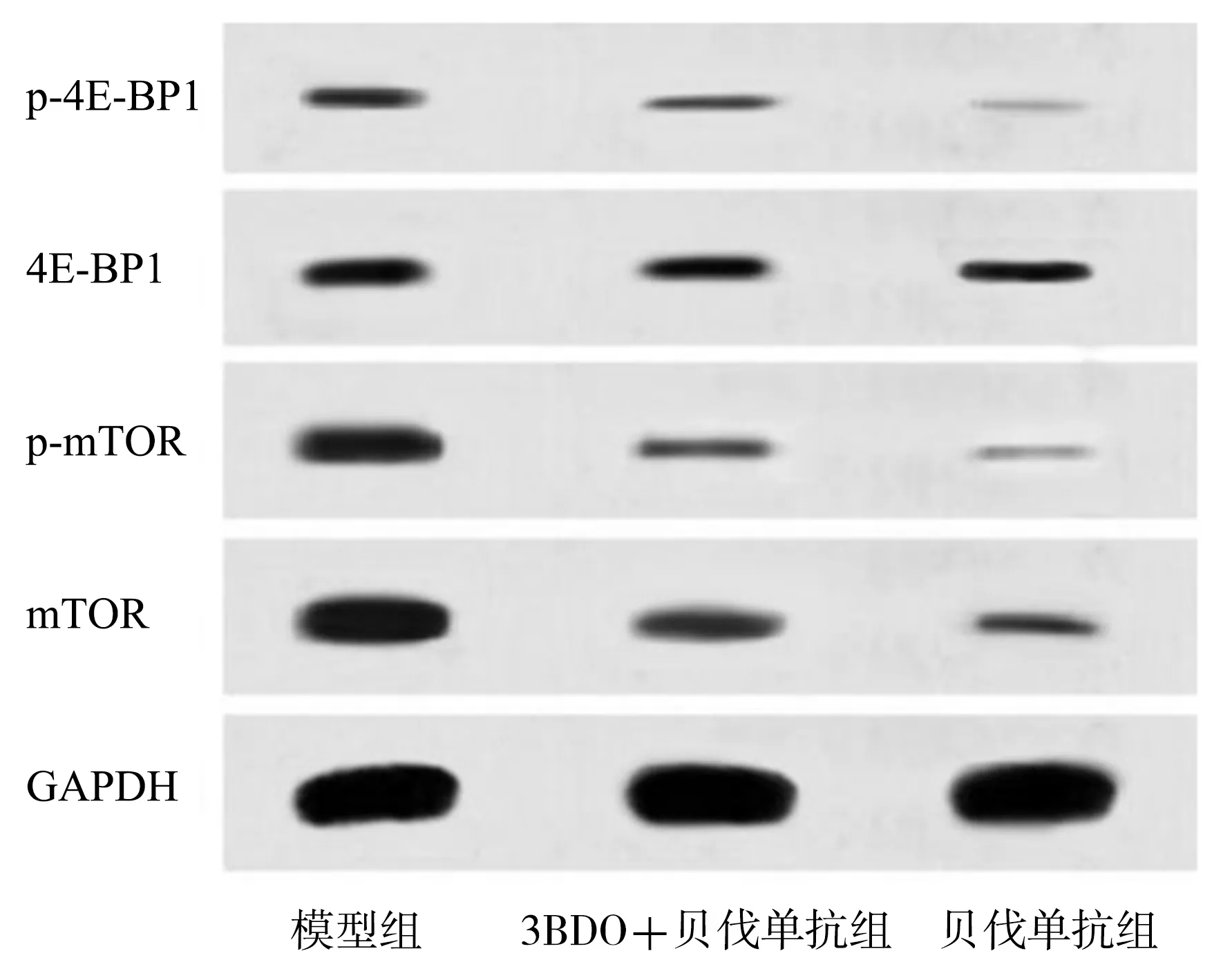
4E结合蛋白1;p-4E-BP1:磷酸化4E-BP1;mTOR:哺乳动物雷帕霉素靶蛋白;p-mTOR:磷酸化mTOR;4E-BP1:GAPDH:甘油醛-3-磷酸脱氢酶;3BDO:3-苄基-5-(2-硝基苯氧甲基)-γ-丁内酯
2.43组雌性大鼠mTOR、4E-BP1 mRNA表达情况比较 3组mTOR、4E-BP1 mRNA表达水平比较差异有统计学意义(P<0.01);与模型组比较,3BDO+贝伐单抗组和贝伐单抗组mTOR mRNA、4E-BP1 mRNA表达降低(P<0.05);与3BDO+贝伐单抗组比较,贝伐单抗组mTOR mRNA、4E-BP1 mRNA表达降低(P<0.05)。见表3。

表3 3组雌性卵巢癌腹水模型裸鼠mTOR、4E-BP1 mRNA表达情况比较
3 讨 论
腹膜内扩散和腹水是中晚期卵巢癌的主要特征,且腹水常伴有腹部压力升高,进而出现腹胀、消化不良、厌食等,若腹水量多向上挤压横膈肌则可出现胸闷、呼吸困难、心慌等,严重影响患者生存质量和生存时间[9-10]。腹水的产生与VEGF关系密切,VEGF与其受体VEGF1/2相互作用后可刺激血管内皮细胞,促进肿瘤组织中新生血管生成,增加血管通透性,形成恶性积液[11-12]。目前针对卵巢癌的辅助治疗仍以化疗为首选,但卵巢癌的高复发率以及对铂类药物产生的耐药性成为治疗难点[13]。贝伐单抗是临床阻断VEGF及其受体作用的常用靶向药物之一,其在多种癌症的一线治疗、铂敏感复发及铂耐药复发治疗中均有较高的临床价值[14]。
刘端等[15]通过检测卵巢癌组织中VEGF及其下游信号通路蛋白基质金属蛋白酶9的表达发现,在体外培养中贝伐单抗可抑制卵巢癌细胞SKOV3的增殖,并具有剂量依赖性,同时贝伐单抗可通过调控VEGF的下游信号通路以及基质金属蛋白酶9的表达水平发挥抗肿瘤效应。本研究结果显示,贝伐单抗组和3BDO+贝伐单抗组腹水平均体积均较模型组减少、腹膜渗透性均较模型组降低,且贝伐单抗组腹水平均体积最少、腹膜渗透性最低,表明贝伐单抗能减少裸鼠腹水量,调节腹膜渗透性,有效改善裸鼠腹水情况。本研究对肿瘤组织苏木精-伊红染色观察发现,模型组肿瘤细胞核大深染,3BDO+贝伐单抗组部分肿瘤细胞皱缩且有小片状坏死区,贝伐单抗组肿瘤组织内则可见凋亡小体以及片状坏死区,表明贝伐单抗能抑制肿瘤细胞增殖,并促进其凋亡。以上研究结果提示,贝伐单抗改善裸鼠腹水、促进肿瘤细胞凋亡的作用可能与抑制mTOR通路有关。
mTOR是一类进化上高度保守的丝氨酸/苏氨酸蛋白激酶,具有信号转导功能,可调控细胞分化、凋亡、能量代谢等[16]。mTOR是磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/Akt)信号通路的下游靶基因,当促肿瘤形成蛋白PI3K和Akt表达增加时,mTOR信号通路不断被激活,同时mTOR的直接底物4E-BP1不断被上游信号通路磷酸化,p-4E-BP1表达增加可促进肿瘤细胞迁移和侵袭[17-18]。相关研究发现,约12%的卵巢癌患者显示出有PI3K/Akt/mTOR信号通路失控的现象,其中大部分患者为mTOR通路异常激活[19]。Zhou等[20]通过给予卵巢癌细胞不同浓度的丹参酮处理,并测定PI3K/Akt/mTOR通路蛋白水平发现,PI3K/Akt/mTOR通路失活可诱导卵巢癌凋亡、自噬,进一步抑制肿瘤生长。在本研究结果中,模型组、3BDO+贝伐单抗组和贝伐单抗组的mTOR mRNA、4E-BP1 mRNA表达、p-mTOR/mTOR、p-4E-BP1/4E-BP1依次降低,说明mTOR激活剂可弱化贝伐单抗对卵巢癌细胞的抑制作用,提示贝伐单抗可抑制mTOR信号通路产生,同时上调4E-BP1表达,减少p-4E-BP1。此外,mTOR信号通路可能参与PI3K/Akt调节VEGF的过程,在神经母细胞瘤中抑制PI3K可减少p-Akt和p-mTOR,降低VEGF水平[21-22]。因此,贝伐单抗可能通过抑制mTOR信号通路对卵巢癌腹水模型裸鼠发挥作用。
综上所述,贝伐单抗能有效减少卵巢癌腹水模型裸鼠的腹水量,调节腹膜渗透性,其作用机制可能与抑制mTOR信号通路、减少肿瘤细胞增殖和侵袭有关。

