基于3D-SMI及SWE定性定量参数在诊断乳腺肿块的Logistic回归分析应用
韩 萌,赵巧玲(通讯作者),吴延琴,薛珊珊,夏晓娜,袁 娜
(西安交通大学第一附属医院超声医学科 陕西 西安 710061)
2020年全球癌症统计报告,乳腺癌是我国女性最常见的新发癌症,影响女性健康[1]。乳腺癌的早期诊断对患者的治疗和预后有重要意义[2]。虽然乳腺BI-RADS分类为鉴别乳腺肿块提供了诊断依据,但假阳性率较高[3],特别是对BI-RADS 4类病灶的鉴别[4]。为提高乳腺肿块的诊断效能,多模式超声联合应用得到了更多关注与研究。现根据3D-SMI、SWE定性定量参数结合BI-RADS分类指标,应用二元Logistic回归分析建立多模式诊断模型,探索是否能提高乳腺肿块的诊断效能。
1 资料与方法
1.1 一般资料
选取2020年11月—2021年2月在我院就诊的193例女性乳腺肿块患者。纳入标准:①年龄23~74岁;②活检前常规超声、SWE及3D-SMI检查;③经FNA检查或术后病理学检查确诊;④无放射性治疗、化学药物治疗及手术史;⑤实性肿块直径<50 mm(含两个实性为主的混合性包块)⑥患者均知情同意,签署穿刺同意书。排除标准:①临床资料缺失;②复发性乳腺癌及其他部位的转移瘤;③合并重症感染、血液系统疾病(出凝血功能异常)或其他脏器功能严重异常;④精神疾病不能配合者。200个肿块纳入研究对象,平均年龄(43.29±11.52)岁。病理确诊乳腺癌患者77例。
1.2 仪器与方法
采用佳能APLIOI900超声诊断仪,应用高频线阵探头,由一名资历10年以上的超声医生操作,测量三次,取平均值。两名工作10年以上的超声医生对肿块Adler分级及3D-SMI血管分型评估,有异议时课题组讨论诊断。3D-SMI测量血管指数(VI)、阻力指数(RI),对肿块血管分型。SWE测量杨氏模量最大值(E-max)、剪切波速最大值(SWV-max),见图1。

图1 浸润性乳腺癌SWE成像
1.3 判定标准
应用CDFI对肿块血流分级,Adler分级标准[5],见表1。

表1 Alder分级
应用3D-SMI将乳腺肿块血管形态分为5种类型[6]:无血流或少许点状血流型;线型,病灶中可见1~2根线状血流信号;树枝型,病灶中可见血管类似树枝样分支,管径较为均匀;残根型,病灶周围或内部血管走行紊乱,能够看到2根以上的血管增粗扭曲,见图2;蟹足型,病灶周边及内部可观察到2根以上的血管粗细不均,走形迂曲杂乱,呈放射状,或微小毛刺状,见图3。
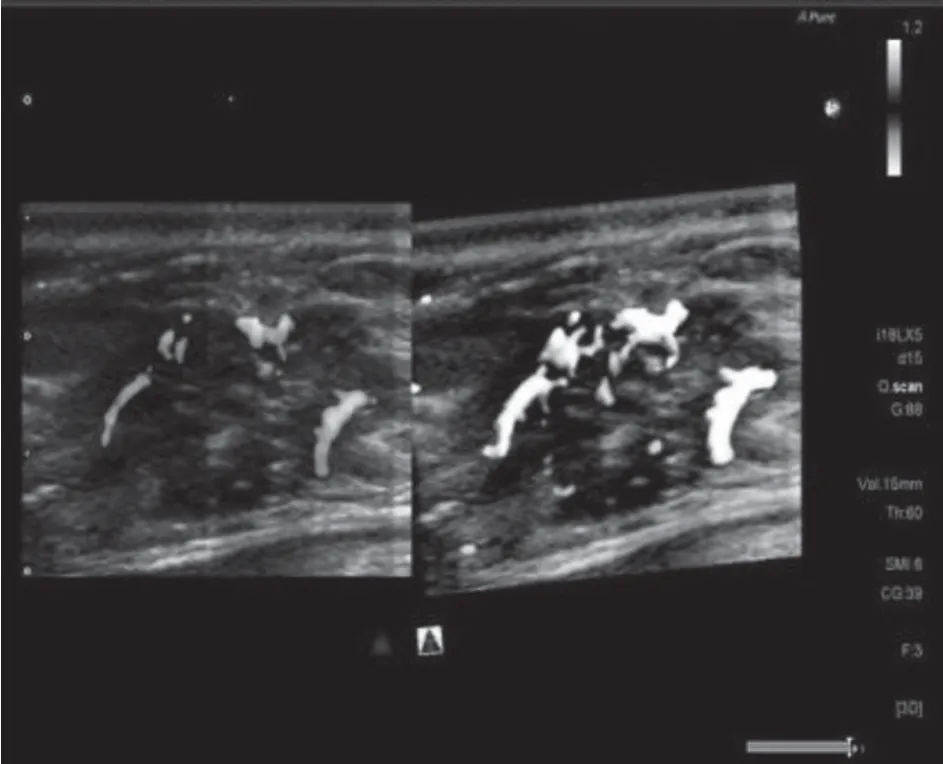
图2 浸润性癌 3D-SMI残根型血流(患者44岁)
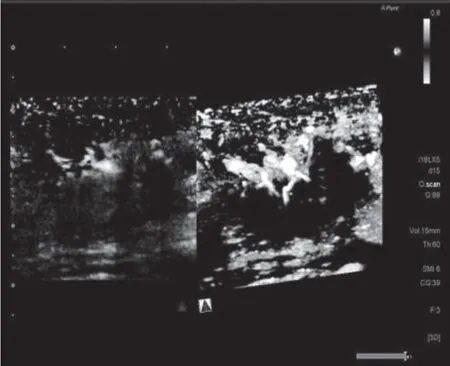
图3 三阴乳腺癌 3D-SMI蟹足型血流(患者42岁)
1.4 统计学方法
采用SPSS 23.0统计软件进行数据处理。病理分为良、恶性组。计量资料以(x-± s)表示,行t检验,计数资料以频数和百分比(%)表示,行χ2检验。先应用单因素分析及二元Logistic回归根据乳腺肿块常规超声的BI-RADS分类指标与病理结果建立模型,再联合3D-SMI、SWE定性定量参数另建模型,计算敏感度、特异度、准确度。应用ROC曲线下面积比较两种模型的诊断效能。两名医生的Adler分级、3D-SMI血管分型结果分别进行Kappa检验,观察符合率分别为95.5%、94%,Kappa值分别为0.89、0.86。
2 模型构建
2.1 常规超声BI-RADS分类的二元Logistic回归模型
根据BI-RADS分类指标进行单因素分析,各项指标对于区分良恶性肿块均有统计学差异。病理结果为因变量,0代表良性,1代表恶性,采用步进法得到4项分类诊断指标(即自变量)分别为:X1代表肿块的纵横比(0:纵横比<1,1:纵横比≥1);X2代表肿块的边缘(0:光整,1:不光整);X3代表肿块内钙化(0:无微钙化,1:有微钙化);X4代表肿块Adler分级(0:0~Ⅰ级,1:Ⅱ~Ⅲ级);模型中常量为-5.484,建立模型:Logit(P)=-5.484+4.11X1+54.726X2+11.656X3+2.54X4。计算灵敏度82.9%,特异度88.1%,准确度86.0%。模型的χ2值为141.89,P<0.01,具有统计学意义。
2.2 基于3D-SMI及SWE定性定量参数的二元Logistic回归模型
应用单因素分析及二元Logistic回归分析,病理结果为因变量,0代表良性,1代表恶性。采用步进法得到7项诊断指标,7项指标(自变量)对于区分良恶性肿块均有统计学差异。其中肿块的定量参数指标Emax、VI和RI分别用Y1,Y2,Y3表示,定性参数指标三维血管分型(0:无血流、点线型或树枝型,1:残根型、蟹足型)、肿块边缘(0:光整,1:不光整)、肿块后方回声变化(0:无衰减或增强,1:衰减)及肿块内钙化(0:无微钙化,1:有微钙化)分别用Y4,Y5,Y6,Y7表示,模型中常量为-8.707,建立模型:Logit(P)=-8.707+1.075Y1+0.906 Y2+117.354Y3+11.779Y4+14.53Y5+11.302Y6+15.714Y7。计算灵敏度95.1%,特异度97.5%,准确度96.5%。模型的χ2值为227.89,P<0.01,具有统计学意义。
2.3 常规超声与基于3D-SMI及SWE定性定量参数的二元Logistic回归模型诊断效能比较
绘制ROC曲线比较两种回归模型的诊断效能,常规超声曲线下面积0.855,P<0.01,95%CI(0.797-0.913);联合3D-SMI、SWE的回归模型曲线下面积0.963,P<0.01,95%CI(0.931-0.995)。两者间进行Z检验,Z=3.176>Z0.05/2=1.96,P<0.05,两种模型的诊断效能有统计学差异,基于3D-SMI、SWE的回归模型诊断效能高于常规超声模型,见图4。
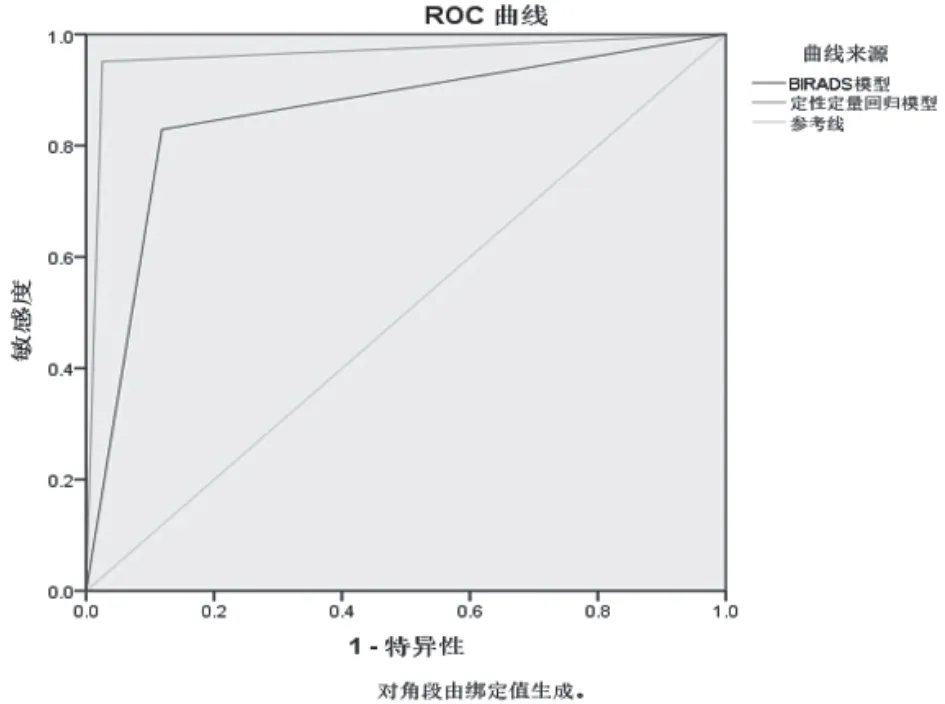
图4 Logistic回归模型效能比较
3 讨论
随着超声技术的发展,3D-SMI和SWE得到了推广应用。3D-SMI是在二维成像基础上发展的计算机血流容积成像技术,为早期发现肿瘤新生血管提供了技术支持。3D-SMI运用智能化自适应算法和滤波技术减少运动伪像,提取微血管与正常低速运动组织的差异,实现低速血流和微小血管(管径>0.1 mm)的检测[7]。有研究表明3D-SMI对病灶的微血流显像优于彩色多普勒血流成像(CDFI),比超声造影更能精细地显示病灶血管的分支[8-9]。3D-SMI定量测量VI及RI,客观提供了乳腺肿块的血管生长状况及差异程度[10]。3D-SMI从三维空间显示乳腺肿块较完整的血管构型,研究发现乳腺良恶性肿块的血管构型具有特征性表现,良性肿块以无血流、点状、线状或树枝样构型为主,恶性肿块则以残根样或蟹足型为主[6]。对乳腺肿块内血流进行定性定量分析有助于区分肿块的良恶性,但有少数肿块本身血供不丰富,有些新生血管还处于萌芽阶段,尚未形成,此时3D-SMI就不能为肿块定量诊断,需联合其他检查方法。
SWE是对生物组织弹性参数或硬度进行成像和量化,可定量分析肿块及其周围组织的硬度值,恶性肿块因肿瘤间质有纤维组织增生,癌细胞在纤维间质内浸润性生长,导致肿块硬度增高,恶性肿块的杨氏模量及剪切波速往往高于良性肿块[11]。对乳腺肿块组织间弹性应变的定量测量提高了乳腺恶性肿瘤诊断准确度[12],但良恶性肿块之间弹性系数存在部分重叠,肿块的生长过程也可出现液化坏死、机化、钙化等现象,超声弹性受这些因素影响,会出现假阳性或假阴性,可以结合二维声像图及肿块的血供综合诊断。
将3D-SMI、SWE定性定量参数与乳腺BI-RADS系统相结合,应用二元Logistic回归分析建立多模式联合诊断模型,结果优于单独应用乳腺BI-RADS分类指标的诊断模型,准确度达到96.5%,提高了乳腺肿块的鉴别诊断效能。

