新冠肺炎疫情期间美国防护类医疗器械的应急监管措施与思路
裴晓辉 张云 周良彬 张春青
1 中国医疗器械行业协会 (北京 100035)
2 广东省医疗器械质量监督检验所 (广东 广州 510663)
3 中国食品药品检定研究院 (北京 100050)
内容提要: 目的:探讨美国新型冠状病毒肺炎疫情期间防护类医疗器械的应急监管措施和思路,为我国相关工作提供参考。方法:整理分析美国在新冠肺炎疫情期间发布的防护类医疗器械相关指南、政策和法规。结果与结论:美国的医疗器械监管机构在新冠肺炎疫情期间,对于防护类医疗器械的应急监管措施,以部分监管政策要求的让步、系列相关程序的减免,引导、服务促进紧缺物资供应量的提高,同时坚持保障产品基本性能和控制主要风险的基本原则,追求供应量和防护质量的最优平衡。
2020年全球新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)疫情迅速蔓延,防护类医疗器械的短缺成为在各国普遍存在的现象和难题。在这场疫情中,美国感染人数以百万计,居全球之首,同时作为医疗器械的生产大国和主要消费市场之一,美国的医疗器械监管一直以来都处于领先的地位,为全球各个地区的监管者引为重点参考对象。目前,由于我国疫情得到有效控制,且全球疫情仍然处于较为紧张困难的阶段,我国前期激发的防护类医疗器械行业产能开始面向全球寻求销售市场,美国是其中最为重要的目标市场之一。本文旨在通过对疫情以来美国医疗器械监管监管针对疫情中防护类医疗器械急缺这一形势所采取的应急措施和政策进行整理分析,为我国行业相关工作提供参考思路和资料信息。
1.公共指南文件
1.1 医疗器械物资总体应对策略
疫情期间,美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)发布应急策略指导医护人员获取和使用有限的医疗器械物资来获得较好的防护效果[1]。分别针对眼部防护、隔离衣、手套、面罩、N95呼吸器、有源空气净化呼吸器、弹性橡胶呼吸面罩、呼吸机提供了疫情期间的应对策略,这些策略通常分为三类情况:
常规策略:在医疗机构的一般日常感染预防和控制计划中应已经实施的措施,由工程设计控制、管理控制和个人防护装备控制组成。
应急策略:在预期的个人防护装备短缺期间可以临时使用的措施。
危机策略:与美国的护理标准不相称的策略,但在已发生的个人防护装备短缺期间可能需要考虑采用。
1.2 以优化N95呼吸器供应的策略为例说明
N95呼吸器是指过滤至少95%的空气微粒,不耐油。以优化N95呼吸器供应的策略为例,这三类策略具体包括以下内容[2]。
常规策略:①工程设计控制:空气感染隔离室的选用,物理屏障的使用,通风系统的适当维护;②管理控制:限制到院患者数量、远程医疗、排除不相关的医护人员、限制医护人员和患者的碰面、排除确诊或疑似患者的访客、源头控制(佩戴普通口罩)、患者的隔离、医护人员的隔离、N95呼吸器使用培训(何时使用、如何使用)、即时的适合性测试、培训时呼吸器的节省、定性的适合性测试(替代在呼吸器上打孔的定量测试,节省呼吸器);③个人防护装备控制:全面计划的制定实行,包含使用、培训、测试、消毒、清洁、维修、储存等方面;外科N95呼吸器的节约使用;N95呼吸器的替代品——采用经国家职业安全和健康研究所(National Institute for Occupational Safety and Health,NIOSH)认证的其他产品。
应急策略(在采取了常规策略的基础上):①管理控制:缩短医学稳定COVID-19患者的住院时间;暂停年度适合性测试。②个人防护装备控制:将超过制造商货架寿命的N95呼吸器用于培训和适合性测试;延长N95呼吸器使用时间(满足条件的情况下,最多8~12h)。
危机策略(在采取了应急策略的基础上):①当N95供应很少时,个人防护装备控制:使用超过制造商货架寿命的N95呼吸器;使用与NIOSH认证呼吸器类似的、经其他国家标准批准的呼吸器(如中国的GB 2626-2006、GB 2626-2019、GB19083-2010);限制性地重复使用N95呼吸器;根据作业类型排序使用N95呼吸器和口罩。②当没有呼吸器时:a)管理控制:具有因COVID-19而患严重疾病的高风险医护人员(高龄、慢性病或孕妇),不使其接触确诊或疑似COVID-19患者;指派COVID-19康复的医护人员进行确诊或疑似患者的护理。b)过程技术控制:建立临时患者隔离室,以减低风险;使用通风床头板(NIOSH开发)。
需要注意的是,CDC在提出以上措施的同时,都明确地表述了其应用情景、条件和注意事项,以确保这些措施在需要的时候被有效地使用。
在针对具体物资供应使用提供指导的同时,为了进一步优化防护产品的供应,CDC还针对在库的N95呼吸器(包括超过使用寿命的产品)、过滤式面罩的净化及复用、采购他国呼吸器、防护产品消耗量的计算、防护产品的使用等方面针对医疗机构给出了指南文件和相关信息[1]。
此外,针对与疫情相关的一些新产品或应用,FDA通过发布信息指导其应用,比如用于呼吸器净化的灭菌系统、用于公共场所人流体温监测的红外热成像系统,介绍这些产品的技术特点、使用条件及其局限性,以及用于疫情防控期间的重点注意事项[3,4]。
2.应急监管政策
防护类医疗器械的应急监管系列政策文件主要由美国食品药品管理局(U.S. Food and Drug Administration,FDA)制定发布,包括两个主要方面:
第一,为提高产品的供应量,基于风险分析控制思路,FDA以即时生效指南的形式,明确疫情期间对各类相关产品的应急政策要求(Enforcement Policy)[5]。这些针对具体产品的、立即生效的政策文件,主要内容有背景信息、适用范围、政策要求(包含标识、性能(包括适用标准)、变更要求、临床试验等)、各品种产品具体注意事项、提高获得性保障供应的相关政策(明确疫情期间可以暂不要求执行的法规)以及其他相关文献资料,部分产品的文件中包含了其紧急使用授权(Emergency Use Authorization,EUA)要求和途径。这些政策仅在COVID-19疫情期间有效。虽然文件要求即时生效,但在生效期间,各方面仍然可以提交对该文件的意见。
目前这一系列文件已涵盖的产品有:口罩和呼吸器、手术服和手套等防护产品以及呼吸机、热成像系统、体外膜氧合设备等疫情相关医疗器械,目前发布的该系列文件已有16个[5]。
以口罩和呼吸器类产品为例,其指南除了背景、范围、定义、EUA相关信息之外,针对该类产品的实际情况,其政策要求分六部分[6]:①总则;②非医疗用口罩、面罩和N95呼吸器;③不提供液体阻隔保护的医用口罩;④医用面罩;⑤提供液体阻隔保护的外科口罩;⑥当没有FDA批准或NIOSH认证的N95呼吸器时的替代方案。指南中针对性地阐明了各类情况需要符合的法规及标准,同时在满足FDA认为风险控制所必要条件的前提下,对暂不做要求的法规进行了明确。例如对于提供液体阻隔保护的外科口罩,在通过液体阻隔测试和阻燃测试、正确标识以及不用于高风险用途的情况下,FDA认为其不会产生不合理风险,此时该类产品的销售和使用可不满足上市前告知、质量体系法规要求、更正和撤除报告、唯一性标识的法规要求。
第二,在本国产能难以满足国内市场需求的情况下,FDA制定了紧急使用授权(EUA)政策,在保障产品基本性能要求的前提下,豁免相关程序和部分法规要求,方便之前未获许可的制造商快速获得在美国的销售和使用授权,提高急缺物资的市场供应量[7]。2020年2月4日,根据联邦食品、药品和化妆品法案(Federal Food,Drug,and Cosmetic Act,简称FD&C法案)第564(b)(1)(C)条,美国卫生与公共服务部部长认定,美国发生了可能会极大影响国家安全或居住在国外的美国公民的健康与安全的公共卫生突发事件,涉及导致COVID-19的病毒。基于这一认定,部长宣布根据FD&C法第564条的规定,这一情况表明,在遵守该法规关于紧急使用授权条款的前提下,在COVID-19爆发期间对控制疫情相关器械采取紧急使用授权的策略是合理的。
随着疫情的持续蔓延,FDA已经制定发布了口罩、呼吸器、灭菌器、呼吸机等产品的EUA文件,明确了各类相关产品的EUA具体要求,并及时公开、更新已获得EUA的产品清单[7]。这些文件中表明,按照FD&C法案要求,对某一类产品实施EUA的考量主要有疾病的严重性、产品对疾病防控有效性与收益/风险比、产品的稀缺性三方面。
在EUA文件中,通常包括以下内容[8,9]:①EUA的背景信息和修订历程;②文件所涵盖的产品品种范围;③获取EUA的资格标准及其所需提交的相关资料(资质证明、预期数量、标识复件等);④生产、进口、使用EUA产品所需遵守的要求(包括说明书、标识、不良事件报告、相关记录等方面);⑤EUA产品所豁免的法规要求,如制造商质量体系要求;⑥EUA的时效(紧急状态的结束或者EUA被取消)。
此外,FDA在发布的EUA要求中,通常都会要求这类产品需要遵从CDC的相关建议,对EUA的适用人群也有明确阐述,例如一次性过滤式呼吸器面罩(Filtering Facepiece Respirator,FFR)的EUA文件中明确表明这一授权只针对医护人员按CDC建议使用的情况下,并非适用一般公众的使用,而口罩的EUA文件中则表明使用者包括公众(作为源头控制的措施之一)和医护人员[8,9]。
FDA对无NIOSH认证的一次性过滤式呼吸器面罩的EUA工作中,FDA根据产品是否来自于中国,分别发布了两份要求文件和清单,文件对产品资格标准和相关资料的要求有所区别(见表1)[8,10]。
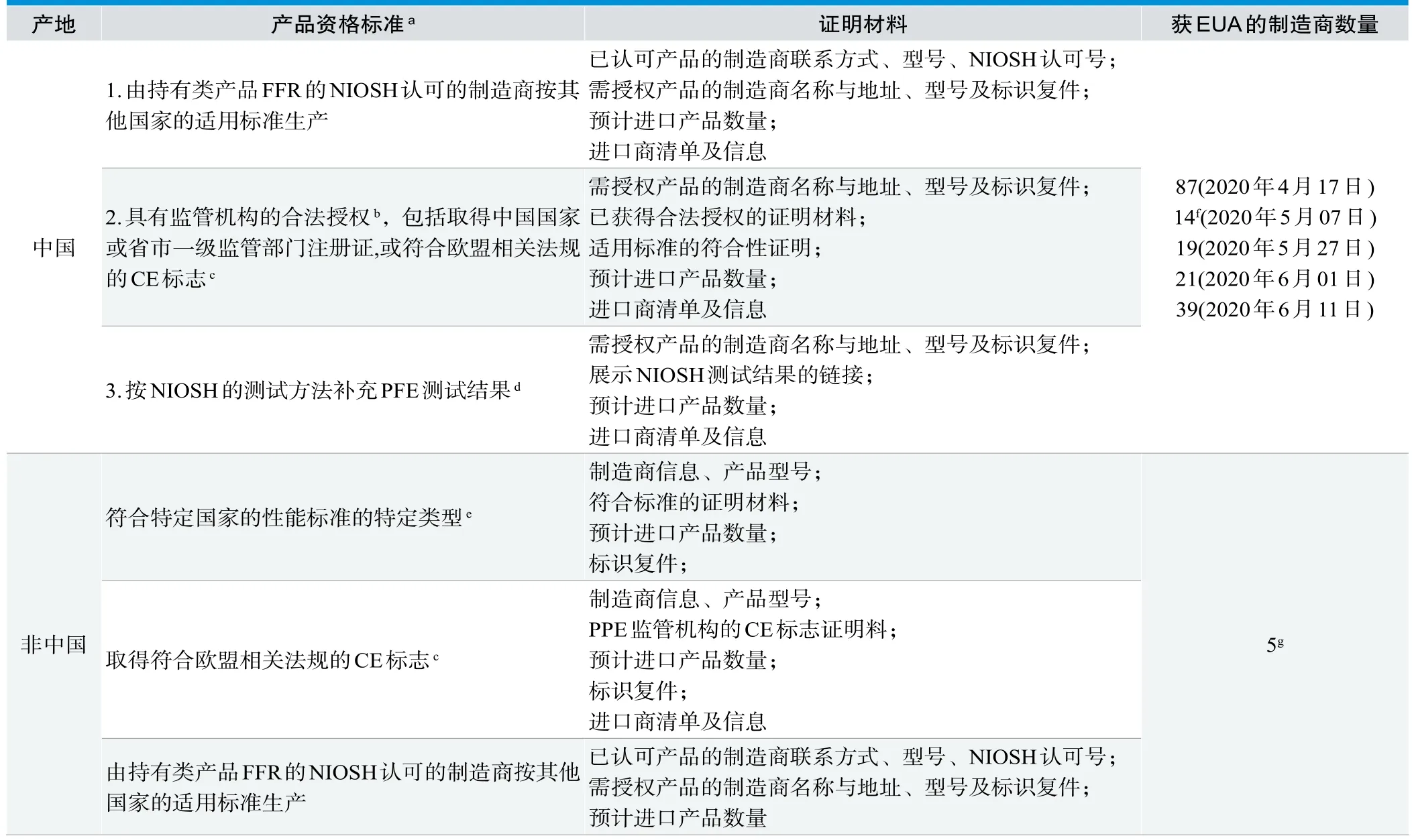
表1. 美国FDA对非NIOSH认证FFR的EUA政策
3.技术支撑工作
疫情期间,为了给呼吸器的相关监管措施提供技术依据和参考,NIOSH的国家个人防护技术实验室(The National Personal Protective Technology Laboratory,NPPTL))针对三类呼吸器开展了技术评估[11-14]:①过期呼吸器/在库呼吸器;②经过清洁灭菌的呼吸器,清洁灭菌方法有过氧化氢蒸汽、二氧化氯、亚甲基蓝、辐照、臭氧、商用衣物烘干机(80~85°C)等;③外国呼吸器,基本来自于中国。基本情况见表2。

表2. NPTTL疫情期间防护产品评估项目概况
以上技术评估或检测的结果,给美国的有关部门制定政策指南提供了有力的支撑:①对过期/在库呼吸器的评估,为该类产品的安全有效提供了技术依据;②对各种清洁灭菌方法的考察结果,为一次性呼吸器的复用提供了技术参考;③依据对外国呼吸器颗粒过滤效率(Particulate Filter Efficiency,PFE)的检测结果,FDA认为该类产品不能提供足够的呼吸防护,因而修改了对中国产呼吸器的EUA要求,取消了通过提交第三方合格报告的获取EUA的途径,将之前通过该途径获得EUA的70家制造商从授权清单中移除(同时引入EUA清单移除程序——FDA将从清单中移除其认为不再满足EUA资格标准的呼吸器),并限期制造商提交NIOSH方法检测PFE的合格结果来重新获得EUA[8]。
4.小结
4.1 监管思路分析小结
随着新冠肺炎疫情在全球范围的持续蔓延,口罩、防护服等防护产品成为各国急需的战略物质,不论各国抗疫的策略如何,该类产品都对其防疫工作的有效展开有着至关重要的影响。疫情期间该类医疗器械的监管,充分体现各国医疗器械监管水平和思路。如上文所述,美国主要相关部门CDC和FDA,一方面,针对使用方,以公众、医疗机构、医护人员、经销商、制造商等为对象发布各种指南文件,对防护类医疗器械产品的应急使用措施提供法规层面的凭据和技术指引;另一方面,针对供应方,以制造商、进口商为主要对象,以应急政策系列文件和紧急使用授权系列文件为主要内容,提供清晰的政策指引的同时,以保障基本防护性能为前提,豁免部分法规和程序,刺激国内产能,吸引国外产品入场。同时,在技术评估的基础上,监管者也在积极寻求各种提高供应量的方法,比如对过期产品的有条件启用、积极开发/评估一次性呼吸器的重复使用方法等。
整体而言,新冠肺炎疫情期间美国防护类医疗器械的应急监管思路,一方面,尽量在合法合规的框架下,尽量从政策法规上支持各方面对疫情的响应;另一方面,也注重将应急情况下的新产品和新方法纳入监管之下,始终保有并持续实践其风险控制基本思路。EUA等系列临时政策的发布实施,一方面有效解决供应量不足的燃眉之急,一方面明确其时效性,避免疫情后的市场上产品监管秩序的混乱和巨大的监管负担。
4.2 对我国行业的影响
疫情期间,在美国监管机构有利政策的引导下,中国制造商生产的防护类器械产品大量涌入美国市场,亿美元级别的大额订单层出不穷。随着供不应求形势的缓解,美国相关部门监管思路逐步趋向正常化,政策开始收紧,5月7日以PFE评估结果为参考大量移除EUA清单中的中国制造商可视为这一趋势的佐证。针对中国产品开展的产品质量评估及其后续政策调整,作者认为,一方面是因为短时间内大量涌入美国的中国产品之前并未获得其监管体系的认可,难免引起美国国内各方面对这些产品质量的担忧;另一方面,不能排除中美贸易关系变化的影响。
在2020年5月7日、6月6日的相关EUA文件修改版中,将中国监管机构纳入资格标准2的监管机构范围中,方便了中国已有上市资质的优质产品获取EUA进入美国市场,相信这是FDA在综合评估后,在提高市场供应量和控制产品质量风险两者之间权衡的结果。

