栽培种花生Ty1-copia 类反转录转座子反转录酶序列的克隆及分析
熊发前刘 菁阳太亿蒋 菁贺梁琼唐秀梅韩柱强钟瑞春吴海宁黄志鹏唐荣华刘俊仙
(1.广西农业科学院经济作物研究所,广西 南宁 530007;2.广西农业科学院甘蔗研究所,广西 南宁 530007)
在形态、品质、抗性等表型上,栽培种花生存在着较丰富变异,但起源及育种栽培中的定向选择导致栽培种花生遗传基础非常狭窄,虽然利用常规分子标记技术能检测到栽培种花生中一定量的DNA多态性,但这些技术存在着重复性差、操作复杂、成本高和多态性不高等缺点,研究表明SSR 标记在花生栽培种间存在较丰富的多态性,使其成为当前检测栽培种花生DNA 多态性的主要分子标记,但能在任意两个栽培种花生品种间检测出DNA 多态性的SSR标记引物仍然比较匮乏[1-2]。 虽然近年来也不断有研究者利用高通量测序技术来开发栽培种花生SNP标记,但SNP标记的检测对设备要求高,且很难在不同实验室之间通用。 因此,有必要在花生上开发新的分子标记技术,往栽培种花生上引入更多简单实用的高效分子标记。
长末端重复(long terminal repeat,LTR)反转录转座子是高等植物基因组中最为丰富的一大类转座元件,其具有的高拷贝、高度异质性和插入多态性等特点非常适合开发成分子标记,开发出来的分子标记可作为SSR 标记和SNP标记的有效补充。 但到目前为止,在栽培种花生上尚未见到基于LTR反转录转座子开发分子标记的研究报道。
分离和鉴定LTR 反转录转座子是基于LTR反转录转座子的分子标记开发利用的前提。 而有关花生LTR 反转录转座子的分离研究却鲜见报道,Nielen等先后分离获得了花生Ty3-gypsy和Ty1-copia类反转录转座子FIDEL和Matita的全长序列并对它们的拷贝数、染色体分布及系统进化进行了研究[3-4]。 除此之外,笔者曾系统阐述了花生LTR反转录转座子和微型反向重复转座元件(miniature inverted repeat transposable element,MITE)的分离及其应用的研究进展[5],也对四倍体野生种花生(A.monticola)的Ty1-copia类反转录转座子反转录酶序列进行了克隆与序列分析[6],但尚未见有对栽培种花生Ty1-copia类反转录转座子反转录酶序列克隆及序列分析的报道。
本研究拟克隆栽培种花生品种桂花1026的Ty1-copia类反转录转座子反转录酶序列,并进行序列特征分析,调查了该类反转录酶序列的组成和变异模式及与其他物种植物之间的系统进化关系,以期为开发栽培种花生基于Ty1-copia类反转录转座子的分子标记奠定基础。
1 材料与方法
1.1 材 料
本研究所用栽培种花生品种为桂花1026,是广西农业科学院经济作物研究所选育出来的广西第一个通过国家审定的花生品种[7]。
1.2 方 法
1.2.1 基因组DNA 的提取
采用笔者先前建立的改良CTAB 法对花生高质量基因组DNA 进行提取[8]。
1.2.2 反转录酶序列的PCR 扩增
参照Kumar等[8]设计的简并引物进行PCR扩增,上游引物为RTp1:5’-ACNGCNTTYYTNCAYGG-3’, 下游引物为RTp2:5’-ARCATRTCRTCNACRTA-3’,其中N=A/T/C/G,R=A/G,Y=C/T。 PCR 扩增反应的体系和程序及产物检测分离参考报道文献进行[9]。
1.2.3 PCR 产物的回收、克隆、转化及测序
具体参考报道文献进行[9]。
1.2.4 反转录酶序列分析
序列相似性检索、序列统计分析、序列图及Logo图生成、蛋白质的二级结构和三级结构预测、蛋白质三级结构的转角数和氢键数统计、保守基序预测等参考报道文献进行[6]。 运用MEGA6.0软件的邻接法(No.of differences模型)构建系统进化树,自展值设置为1000。
2 结果与分析
2.1 栽培种花生Ty1-copia 类反转录转座子反转录酶序列的PCR 扩增及测序
图1 可见,本研究所用简并引物对在桂花1026中扩增得到了一条260 bp左右大小的目的条带,对目的片段进行回收、克隆和测序,共获得了46条序列。 利用DNAMAN 软件等去除46条序列中的重复序列,利用NCBI数据库对46条序列进行相似性分析,去除非反转录酶序列,最后共获得了34条非重复的Ty1-copia类反转录转座子反转录酶序列,将单条序列按照Ah RT1-X的形式进行命名,并提交每条反转录酶序列到GenBank,对34条反转录酶核苷酸序列进行多重比对(图2),为了展示碱基在每个位置上的保守性,也生成了序列比对logo图 (图3)。
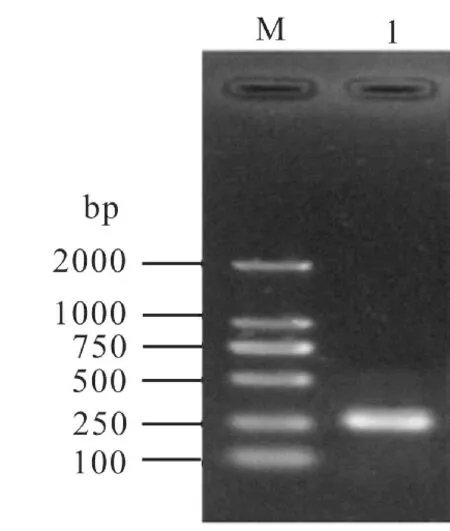
图1 栽培种花生Ty1-copia 类反转录转座子反转录酶序列的PCR扩增Fig.1 PCR amplification of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut

图2 栽培种花生Ty1-copia 类反转录转座子反转录酶序列多重比对Fig.2 Multiple alignment of reverse transcriptase of Ty1-copia-like retrotransposons amplified from cultivated peanut
图3 栽培种花生Ty1-copia 类反转录转座子反转录酶序列比对logoFig.3 The alignment logo of reverse transcriptase of Ty1-copia-like retrotransposons amplified from cultivated peanut
2.2 栽培种花生Ty1-copia 类反转录转座子反转录酶序列的相似性与异质性分析
从栽培种花生品种桂花1026基因组中克隆获得的34条反转录酶序列长度变化范围为256~267 bp,其中,AhRT1-49和AhRT1-59的序列最长,为267 bp,AhRT1-20的序列最短,为256 bp,绝大多数序列长度为266 bp,拥有266 bp长度的序列占总序列数的76.47%,本研究中栽培种花生的反转录酶序列长度都小于Voytas等[10]报道的273 bp,都存在不同程度的缺失(6~17 bp)。 通过对这34条序列碱基进行分析,A、T、C、G 数量变化范围分别为57~95、75~93、29~71和43~68,AT所占比例范围为51.36%~67.79%,AT 与GC比例为1.06~2.10,最高达2.10。 核苷酸序列间相似性范围为44.9%~98.5%,表明存在较高异质性,其中,Ah RT1-16与Ah RT1-61之间的相似性最高,达98.5%,Ah RT1-11 与AhRT1-20 之间的相似性最低,为44.9%(表1)。
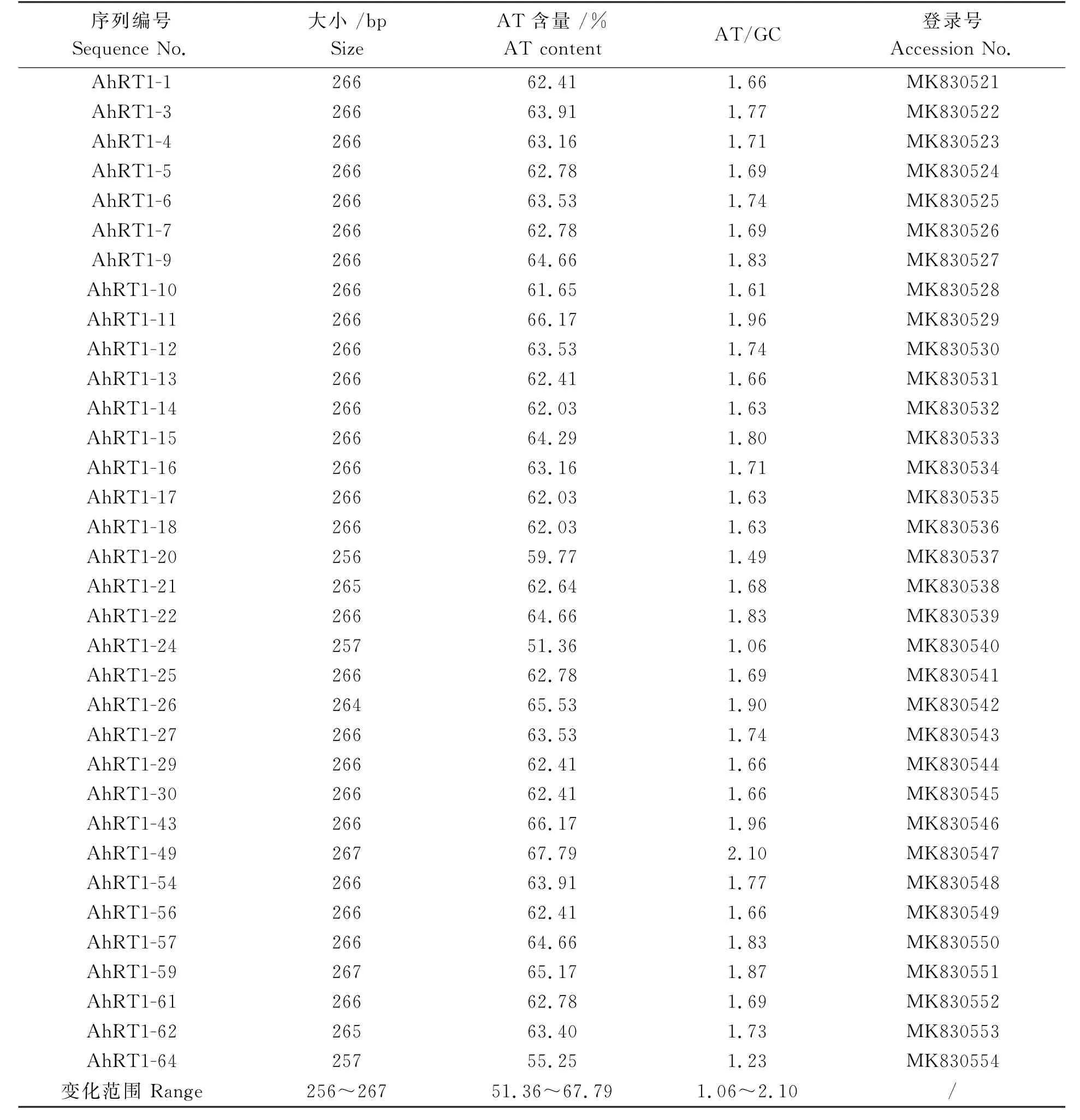
表1 栽培种花生Ty1-copia 类反转录转座子反转录酶序列的基本信息Table 1 The basic information of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut
2.3 栽培种花生Ty1-copia 类反转录转座子反转录酶序列聚类分析
根据遗传进化树的分支长度可将这34条序列分为3个家族(图4)。 其中家族Ⅰ包含19条序列,家族Ⅱ包含12条序列,剩下的3条序列(AhRT1-20、AhRT1-24和AhRT1-64)与其他序列差异较大单独聚为家族Ⅲ,这个家族与其他家族遗传距离最大,亲缘关系最远。 家族Ⅰ和家族Ⅱ分别占到了总序列数的55.88%和35.29%,表明这2个家族是构成栽培种花生Ty1-copia类反转录转座子的主要成分,也表明栽培种花生Ty1-copia类反转录转座子反转录酶序列有非常高的保守性与相似性。
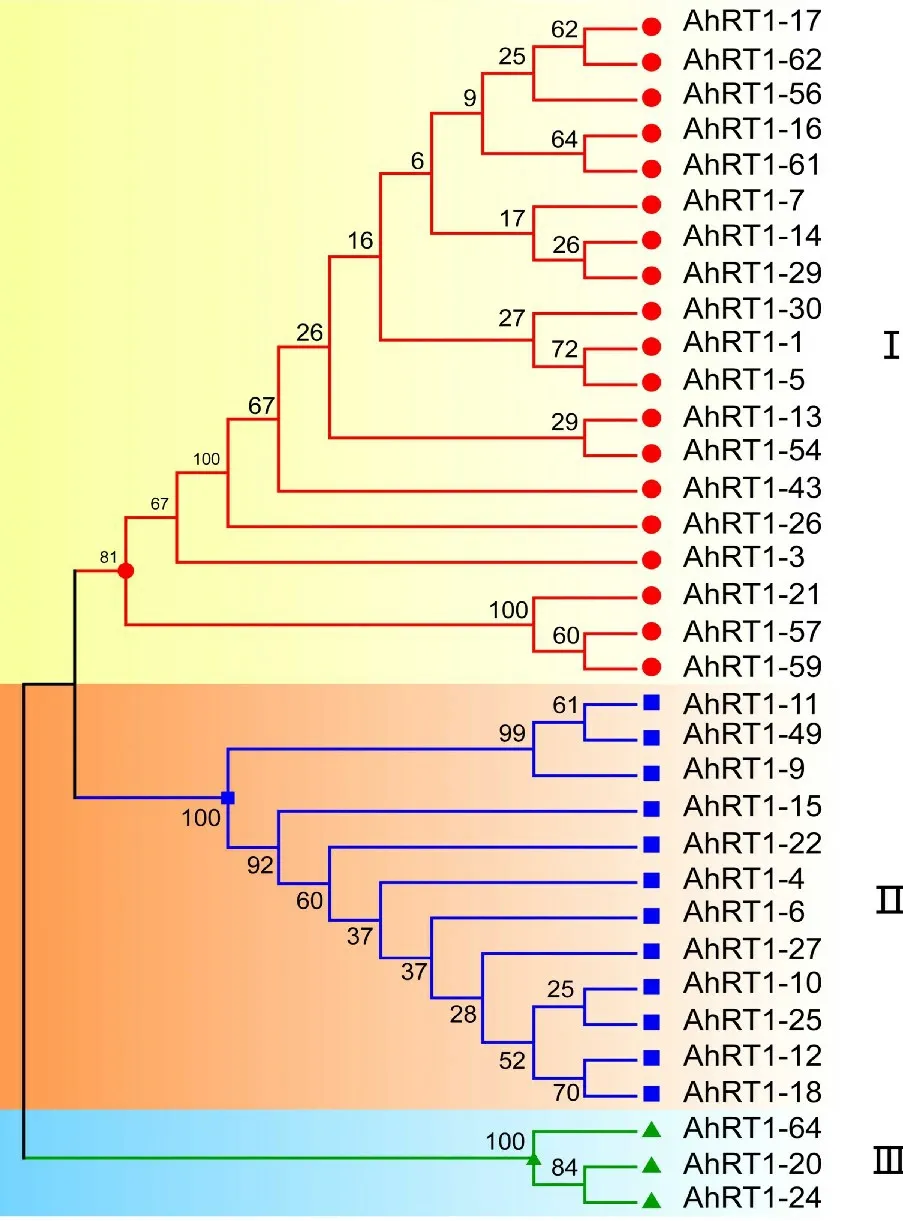
图4 栽培种花生Ty1-copia 类反转录转座子反转录酶序列遗传进化树Fig.4 Phylogenetic tree of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut
2.4 栽培种花生Ty1-copia 类反转录转座子反转录酶的氨基酸序列分析
34条反转录酶序列间相似性范围11.4%~98.9%,呈高度异质性,其中AhRT1-20与AhRT1-59的相似性最低(11.4%),但这两条核苷酸序列间相似性为54.7%,并不是最低的;Ah RT1-29 与Ah RT1-61的相似性最高(98.9%),但这两条核苷酸序列间相似性为97.7%,也并不是最高的。
图5可见,34条序列中有14条发生了1~7个无义突变。 其中,AhRT1-59的无义突变最多,有7个无义突变,分别在第18、65、66、71、75、76、77个氨基酸处;AhRT1-26和AhRT1-49各有5个无义突变,AhRT1-26在第30、32、60、74、76个氨基酸处发生了突变,AhRT1-49在第21、51、58、74、77个氨基酸处发生了突变;AhRT1-21有4个无义突变,分别在第32、39、82、85个氨基酸处;AhRT1-1和AhRT1-20各有3个无义突变,AhRT1-1的终止密码子连续出现在第75、76、77个氨基酸处,AhRT1-20的终止密码子出现在第50、62、82个氨基酸处;AhRT1-3(第16、18个氨基酸处)、Ah RT1-11(第16、46 个氨基酸处)、Ah RT1-43(第46、52 个氨基酸处) 和Ah RT1-56(第46、71个氨基酸处)各有2个无义突变;剩余的Ah RT1-9(第44 个氨基酸处)、Ah RT1-12(第26个氨基酸处)、Ah RT1-22(第21个氨基酸处)和AhRT1-57(第46个氨基酸处)均只有1个无义突变。
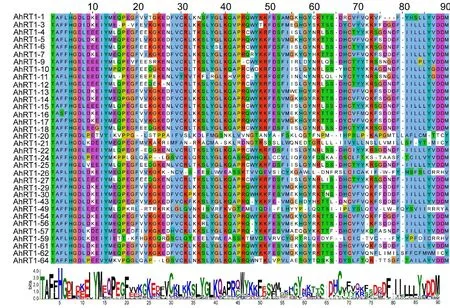
图5 栽培种花生Ty1-copia 类反转录转座子反转录酶氨基酸序列的多重比对Fig.5 Multiple alignment of amino acid sequences of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut
根据核苷酸聚类结果,选择每个家族中的代表序列,利用在线程序Phyre2预测其蛋白质的二级结构和三级结构(表2;图6),代表序列蛋白三级结构匹配覆盖度最高的模板为d1hara,置信度均为61.5~73.1,属于逆转录酶家族。 二级结构包含2个α-螺旋和4~5个β-折叠,图6A 为家族Ⅰ中代表序列Ah RT1-14的蛋白质二级结构;三级结构包含5~6个转角和30个氢键,还有1个明显的螺旋结构和2个不明显的折叠结构(红色为N 端,蓝色为C 端),图6B 为家族I中代表序列AhRT1-14的蛋白质三级结构。
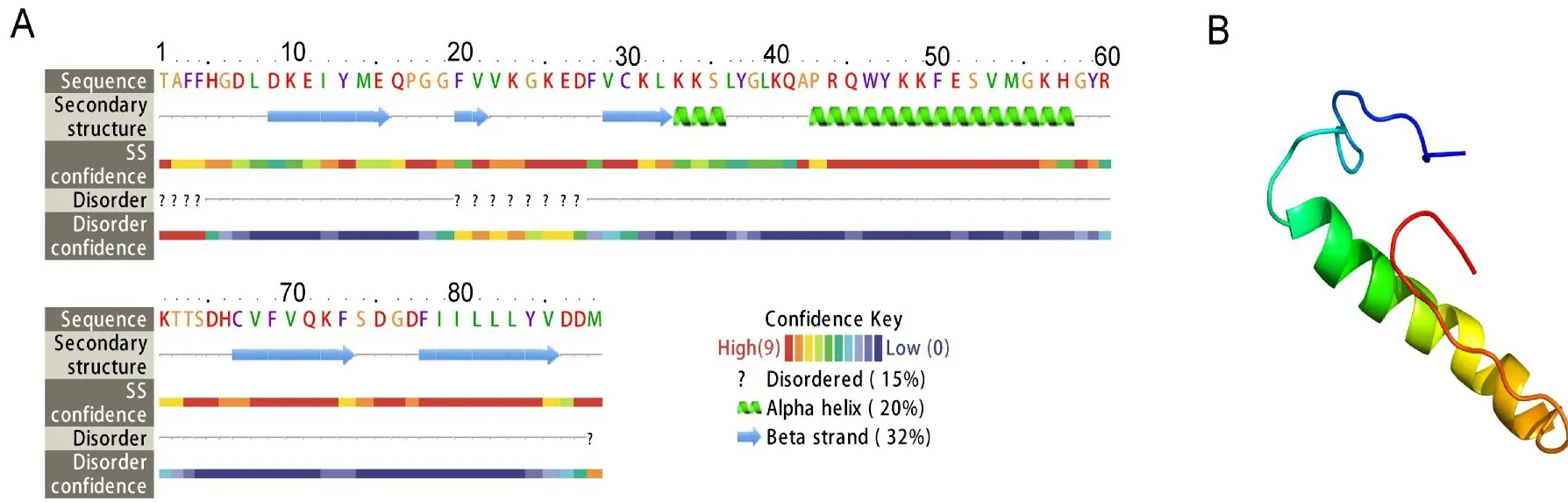
图6 栽培种花生Ty1-copia 类反转录转座子反转录酶蛋白质的二级结构(A)与三级结构(B)Fig.6 The protein secondary(A)and tertiary(B)structure of reverse transcriptase of Ty1-copia-like retrotransposon from cultivated peanut

表2 栽培种花生Ty1-copia 类反转录转座子反转录酶蛋白质结构信息Table 2 The protein structure information of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut
2.5 栽培种花生Ty1-copia 类反转录转座子反转录酶保守基序预测
34条序列共存在10种保守基序,其中同时包含motif 1、motif 2和motif 3这3种保守基序的序列共有26条,占全部序列数的76.47%,即上游保守序列motif 1为第1位至第50位的5’-TAFFHGDLDKEIYMEQPEGFVVKGKEDFVCKL KKSLYGLKQAPRQWYYKKF-3’,中游保守序列motif 3为第52位至59位的5’-SVMGKHGY-3’及下游保守序列motif 2 的5’-RKTTSDHCVFVQKFSDDDFIILLLYVDDM-3’,表明这3 种保守基序是栽培种花生Ty1-copia类反转录转座子反转录酶的主要基序。 另外8条序列中包含7种不同的保守基序,在所克隆序列中出现的频率较低而且长度较短,估计可能是进化过程中发生突变所致,这8条中的7条序列在系统进化树中也是单独聚为Ⅴ类和Ⅶ类的,也从侧面验证了这7条序列含有不同保守基序的准确性 (图7)。
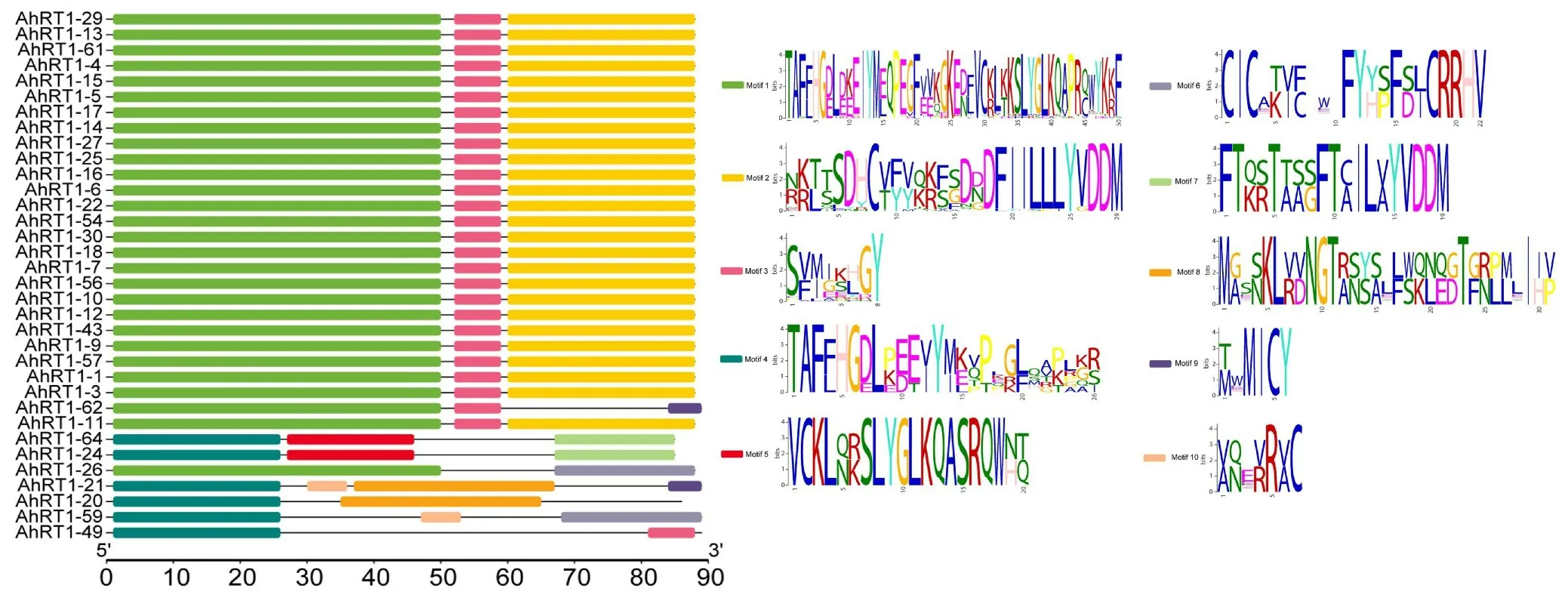
图7 栽培种花生Ty1-copia 类反转录转座子反转录酶保守基序预测Fig.7 The conservative motifs prediction of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut
2.6 栽培种花生Ty1-copia 类反转录转座子反转录酶序列的系统进化树构建
从系统进化树上可看出,所有反转录酶序列可分为7类(表3,图8)。 其中,Ⅰ类包含16条栽培种花生和8条其他物种植物的反转录酶序列,除欧洲云杉(Picea abies,O49918)为裸子植物外,其余均为双子叶植物,说明栽培种花生的16条反转录酶序列与葡萄(Vitis vinifera) 的CAN72446.1、 辣 椒 (Capsicumannuum) 的AFS89513.1、 马铃薯(Solanumtuberosum) 的CAA13065.1、 野茶树(Camelliasinensis) 的CAJ09751.1、 烟 草 (Nicotaniatabacum) 的AAA03507.1和番茄(Lycopersicon esculentum)的AF072638.1之间具有很高相似性,且在Ⅰ类当中,栽培种花生的Ah RT1-57与马铃薯(Solanum tuberosum)的CAA13065.1具有较高相似性,亲缘关系最近;Ⅱ类包含栽培种花生的11条反转录酶序列和大豆(Glycine max)的E47759、甜菜(Beta vulgaris)的T14589、杨树(Populus ciliata)的AAT73704.1 和 橙 (Citrus sinensis) 的CAJ41389.1,它们之间相似性较高;Ⅰ类和Ⅱ类分别包含16 条和11 条栽培种花生反转录酶序列,表明栽培种花生Ty1-copia类反转录转座子反转录酶序列具有相当高的保守性与相似性;其他物种植物中的绿豆(Vigna radiata,AAT90494.1)单独聚为Ⅲ类;玉米(Zea mays)的AAK84853.1与拟南芥(Arabidopsis thaliana)的S71291聚为Ⅳ类;Ⅴ类包含2条栽培种花生的反转录酶序列以及草莓(Fragaria x ananassa)的ACZ81628.1和铁皮石斛 (Dendrobiumofficinale) 的AIL54325.1 序列,表明它们之间具有较高相似性,但与其他类遗传距离较远;来源于向日葵(Helianthus annuus)的AAA33373.1、栽培稻(Oryza sativa)的T03671和燕麦(Avena sativa)的I47759聚为Ⅵ类;剩余的5条栽培种花生的反转录酶序列单独聚为Ⅶ类,它们之间相似性较高,但与其他类遗传距离最大,亲缘关系最远。 Ⅴ类和Ⅶ类分别包含2条和5条花生反转录酶序列,也说明栽培种花生Ty1-copia类反转录转座子反转录酶序列具有较高异质性与遗传变异率。
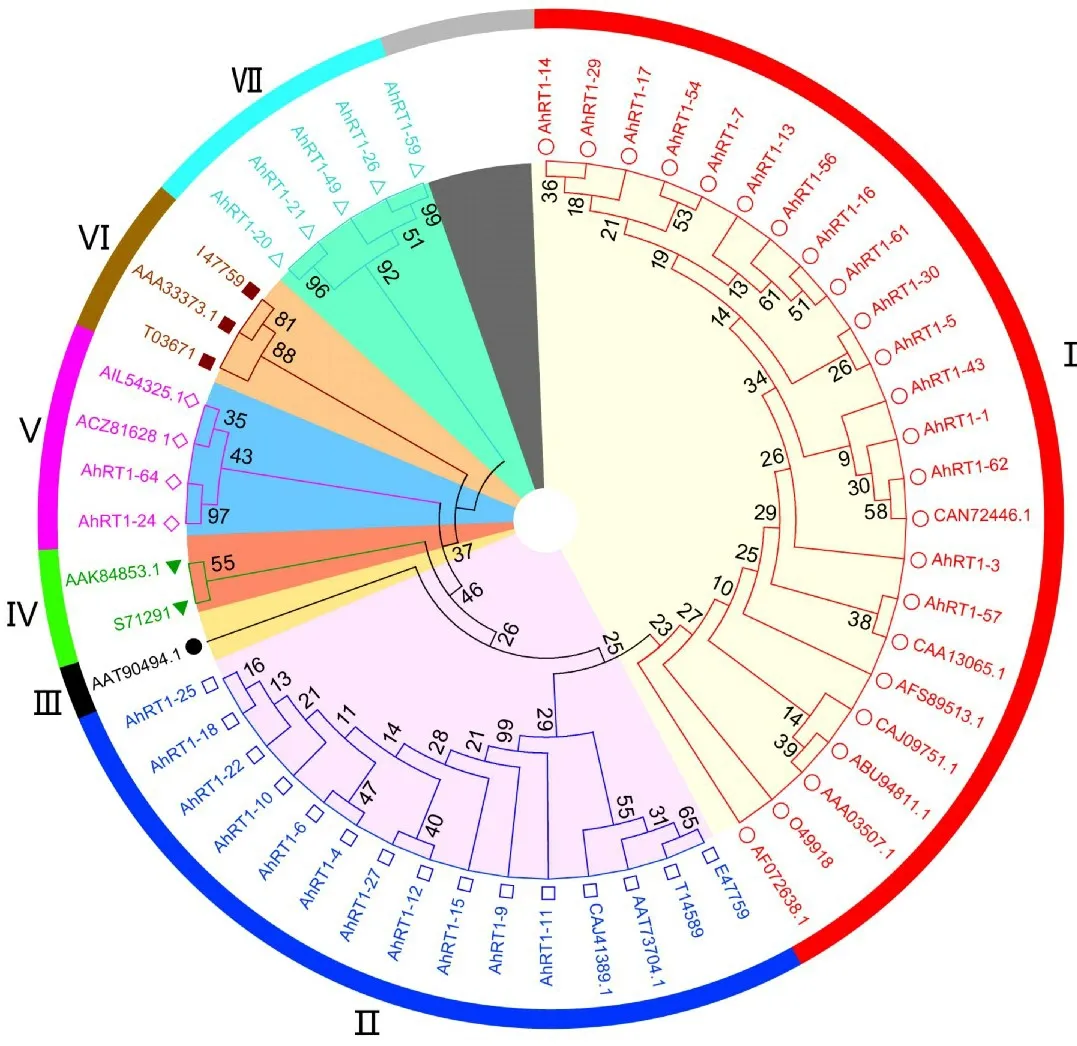
图8 栽培种花生与部分其他物种植物Ty1-copia 类反转录转座子反转录酶序列系统进化树Fig.8 Phylogenetic tree of amino acid sequences of reverse transcriptase of Ty1-copia-like retrotransposons from cultivated peanut and some other plant species
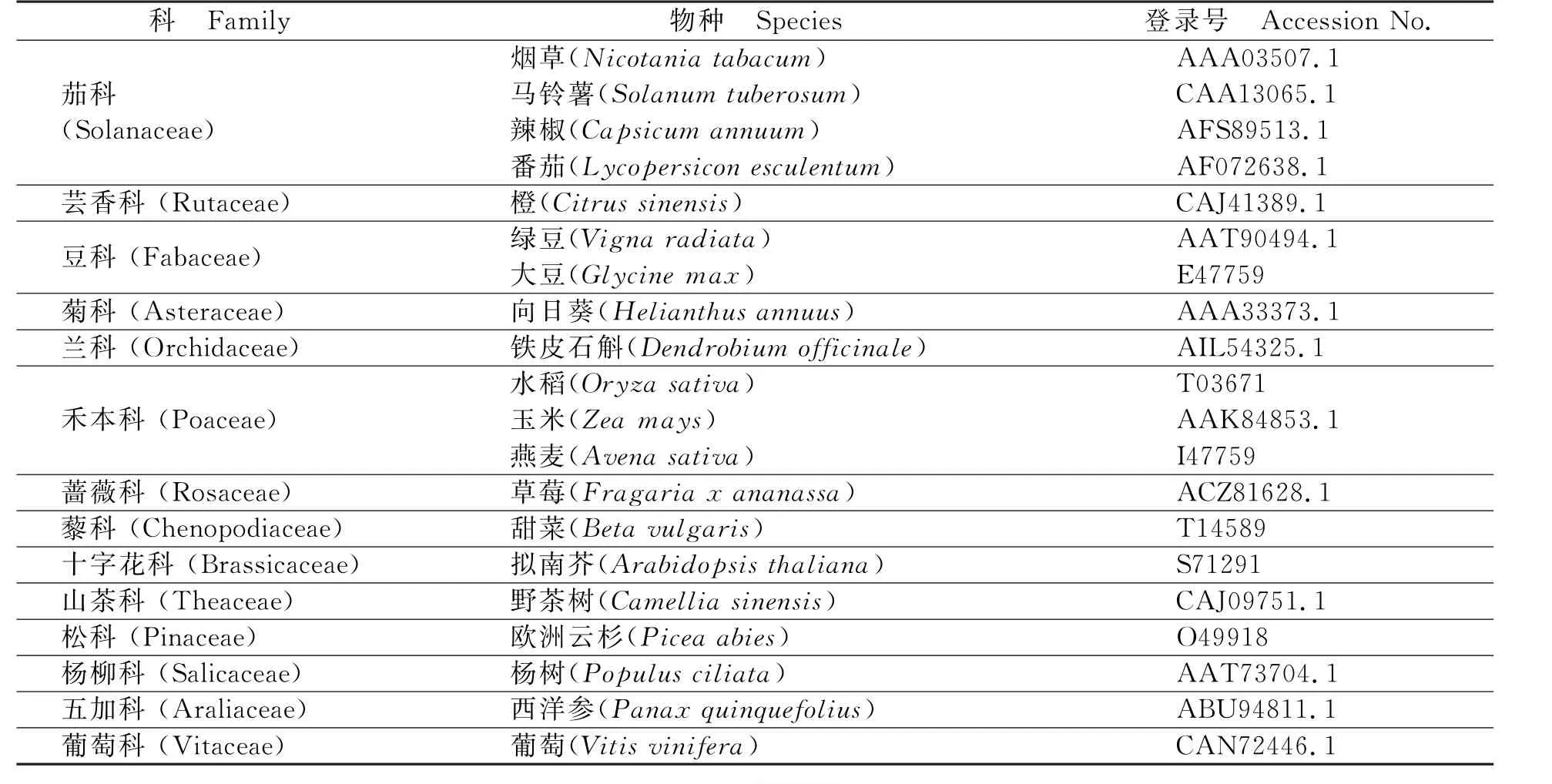
表3 部分其他物种植物的Ty1-copia 类反转录转座子反转录酶序列信息Table 3 The amino acid sequences information of reverse transcriptase of Ty1-copia-like retrotransposons from other plant species
3 讨 论
本研究首次对栽培种花生Ty1-copia类反转录转座子反转录酶序列进行PCR 扩增,从中扩增出260 bp左右的目的片段,与Voytas等[10]的研究结果一致,对目的片段进行回收、克隆和测序,经去除非反转录酶序列和重复序列,共获得34条反转录酶序列,说明该类反转录转座子广泛存在于栽培种花生中,且具有相当高的保守性,同时也证实了Kumar等[8]提出的利用简并引物来分离克隆栽培种花生基因组中的Ty1-copia类反转录转座子反转录酶序列的方法是切实可行的。
用同一简并引物从同一栽培种花生种质中PCR扩增出单一条带的前提下,克隆获得的Ty1-copia类反转录转座子反转录酶的核苷酸和氨基酸序列在序列长度、序列组成及序列相似性等方面存在较大差异和多态性,表明同一栽培种花生种质内同一类群反转录转座子存在较高异质性,这些异质性主要来源于缺失突变及无义突变。34条序列长度变化范围为256~267 bp,相差11 bp,但都小于Voytas等[10]报道的273 bp,存在不同程度的缺失突变;34条序列均富含AT 碱基,AT 所占比例范围为51.36%~67.79%,AT 与GC比例为1.06~2.10,最高达2.10,导致较高异质性;核苷酸序列间相似性范围为44.9%~98.5%,呈现较高异质性;翻译成氨基酸后,34条序列中的14条发生了无义突变,无义突变导致反转录转座子失去转录活性,无义突变可能是导致花生Ty1-copia类反转录转座子表现出较高异质性和多拷贝的主要原因;氨基酸序列间相似性范围为11.4%~98.9%,呈现高度异质性;各序列间保守基序也存在较大差异,呈较高异质性。 异质性产生的原因为:①反转录转座子在转座过程中易发生高频突变;②核苷酸自然突变(胞嘧啶到胸腺嘧啶)和同源重组增加了序列变异几率;③宿主的防御机制促使反转录转座子发生变异;④反转录转座子的纵向传递和横向传递。
遗传进化树显示34条反转录酶序列被分为3个家族,其中,家族Ⅰ和家族Ⅱ是主要成分,含序列数愈多的家族历史愈久远。 各家族内部成员越复杂,序列相似性越高,存在有转录活性的反转录转座子的可能性也越大,其转座发生的时间可能越近。 家族Ⅰ和家族Ⅱ中分别有11条和7条反转录酶序列未发生无义突变,推测这两个家族很有可能是存在具有转录活性的Ty1-copia类反转录转座子的家族,存在的历史也更为久远。
各家族中代表序列的蛋白质结构基本类似,但在β-折叠数和转角数上存在着细微差别,家族Ⅲ中AhRT1-64的β-折叠数要少于其他代表序列,其转角数要多于其他代表序列,这也表明栽培种花生Ty1-copia类反转录转座子存在较高异质性和多态性,推测这些细微差别可能会影响到Ty1-copia类反转录转座子的转录活性、转座效率及拷贝数等。
从系统进化树上可看出,Ⅰ类中的16条栽培种花生反转录酶序列与来自葡萄、马铃薯、辣椒、野茶树、烟草和番茄的序列间相似性较高;Ⅱ类中的11条栽培种花生反转录酶序列与来自大豆、甜菜、杨树和橙的序列间具有较高相似性;Ⅴ类中的2条栽培种花生反转录酶序列与来自草莓、铁皮石斛的序列间具有较高相似性,故而推测栽培种花生Ty1-copia类反转录转座子可能与这些物种间发生过横向传递。 Ⅶ类包含5条栽培种花生的反转录酶序列,表明它们之间相似性较高,但与其他物种植物的反转录酶序列遗传距离最大,亲缘关系最远,说明这两条序列在起源和进化上可能较为古老,特异性比较强,可能为栽培种花生所特有。 在核苷酸水平上,AhRT1-20和AhRT1-24聚为一小类,这一小类再与AhRT1-64聚为一大类(Ⅲ),但在氨基酸水平上,AhRT1-24 是和AhRT1-64 聚为一小类的,AhRT1-20是在另外一大类的,但这3条序列都与其他栽培种花生的反转录酶序列亲缘关系较远。
本研究从栽培种花生中成功分离出Ty1-copia类反转录转座子反转录酶序列,将为下一步分离其全长序列、研究其转录转座活性和功能提供序列基础,也对栽培种花生基于LTR 反转录转座子的分子标记开发及花生分子育种具有重要意义。

