CT 联合血清HE4 和CA125 鉴别良恶性卵巢囊实性肿瘤的价值
伏文皓 王珂 胡笑笑 孙梦雅 张繁 关键
卵巢癌是女性因妇科肿瘤死亡的三大原因之一[1]。卵巢癌的早期诊断和治疗可显著提高患者生存期[2]。建立简单、有效的诊断策略鉴别卵巢良、恶性肿瘤具有重要的临床意义。虽然腹盆腔增强CT 已被推荐用于卵巢肿瘤的术前初始诊断,但是仅凭CT 鉴别卵巢囊实性肿瘤的良恶性有一定困难,其原因是卵巢良、恶性肿瘤的CT 征象存在重叠[3-5]。研究表明肿瘤标志物血清人附睾蛋白4(human epididymis protein 4,HE4)、糖类抗原125(carbohydrate antigen 125,CA125)已广泛应用于卵巢肿瘤的诊断[6]。故本研究旨在探讨腹盆腔增强CT 联合血清HE4、CA125 鉴别成人卵巢囊实性肿瘤良、恶性的价值。
资料与方法
1.一般资料
本研究已通过我院伦理委员会的批准,并获得受检者知情同意。回顾性收集2016 年1 月~2019 年12 月于我院经手术病理证实的成人卵巢囊实性肿瘤患者172 例(中位年龄43 岁;年龄范围18~84 岁)。需排除肺结核、严重的肾功能不全者[7]。所有患者术前均行腹盆腔CT 平扫及增强检查,并在术前一周检测血清HE4、CA125。记录所有患者的年龄、绝经前/绝经后状态、血清HE4 及CA125 值、病理结果等资料。
2.CT 检查
均采用多层螺旋CT(Aquilion 64,Canon Medical System)行腹盆腔检查。扫描范围:横膈至耻骨联合下缘水平。扫描参数:管电压120 kV,管电流180~250 mA,层厚0.5 mm,螺距0.9。增强扫描:对比剂为碘普罗胺(300 mg I/ml),经肘静脉以流率2.5~3.0 ml/s 注入70~90 ml 对比剂,后继续注射40 ml 生理盐水,于75 s 时采集图像。
3.血清肿瘤标记物检测
采集所有患者静脉血样本,按制造商的说明书使用ARCHITECT HE4 试剂盒(Abbott Diagnostics)定量测定血清HE4,使用ARCHITECT CA125 Ⅱ试剂盒(Abbott Diagnostics)定量测定血清CA125。定义血清学诊断的阳性标准:CA125>105 U/ml(正常值的三倍);绝经前HE4>70 pmol/L 或绝经后HE4>140 pmol/L。
4.诊断策略
由两名放射科医师(诊断经验为10 年)在未知病理结果的情况下,按以下策略共同评估肿瘤的良恶性,在意见不同时讨论达成一致。诊断策略包括:(1)策略A,仅以CT 影像来诊断良恶性;(2)策略B,以CT 转移征象和/或血清CA125 阳性作为判定恶性肿瘤的标准;(3)策略C,以CT 转移征象和/或血清HE4 阳性作为判定恶性肿瘤的标准;(4)策略D,以CT 转移征象和/或血清肿瘤标记物(CA125 和HE4)任一阳性作为判定恶性肿瘤的标准。CT 的转移征象包括淋巴结、腹膜、脏器转移等。
5.统计分析
结果
172 例卵巢囊实性肿瘤中,恶性肿瘤86 例(上皮性肿瘤67 例;性索间质肿瘤1 例;生殖细胞肿瘤9 例;混合性肿瘤1 例;转移性肿瘤8 例);良性肿瘤86 例(上皮性肿瘤54 例;生殖细胞肿瘤10例;性索间质肿瘤22 例)。不同情况下良恶性诊断错误病例见图1~4。

图1 女,40 岁,未绝经。冠状位重组示卵巢巨大囊实性肿块,血清HE4 145.1 pmol/L(明显增高);血清CA125 57.3 U/ml(未达设定的恶性标准)。策略A 和B 均诊断为卵巢囊腺瘤(良性);策略C 和D 则诊断为卵巢囊腺癌(恶性)。最终病理为卵巢浆液性囊腺癌 图2 女,35岁,未绝经。冠状位重组示右侧卵巢巨大囊实性肿块,血清HE4 66 pmol/L(阴性);血清CA125 26 U/ml(阴性)。策略A 诊断为卵巢囊腺癌(恶性);策略B、C 和策略D 均诊断为卵巢囊腺瘤(良性)。最终病理为卵巢黏液性囊腺瘤合并出血 图3 女,35 岁,未绝经。矢状位重组示卵巢巨大囊实性肿块,血清HE4 80.1 pmol/L(阳性);血清CA125 124.9 U/ml(超过设定的恶性标准)。策略A 诊断为卵巢囊腺瘤(良性);策略B、C 和策略D 均诊断为卵巢囊腺癌(恶性)。最终病理为卵巢浆液性乳头状腺癌 图4 女,69 岁,已绝经。矢状位重组图示卵巢巨大囊实性肿块,血清HE4 81.3 pmol/L(阴性);血清CA125 61.3 U/ml(未达设定的恶性标准)。策略A 诊断为卵巢囊腺癌(恶性);策略B、C 和D 诊断为卵巢囊腺瘤(良性)。最终病理为卵巢交界性黏液性囊腺瘤
四种诊断策略与病理结果对照,以及各策略的诊断敏感度和特异度见表1。策略B、C、D 对卵巢良恶性囊实性肿瘤鉴别诊断的特异度显著高于策略A(Pspe<0.05)。策略C 特异度高于策略B(Pspe<0.05);策略D敏感度高于策略B,(Psen<0.05);策略D 敏感度高于策略C,而特异度略低于策略C(Psen<0.05;Pspe<0.05)。四组策略鉴别卵巢囊实性肿瘤良恶性的ROC 曲线见图5,曲线下面积分别为0.686、0.756、0.814、0.802,两两比较,均有差异,其中以策略C 诊断效能最高(P<0.05)。

图5 四种诊断策略鉴别卵巢囊实性肿瘤良恶性的ROC 曲线
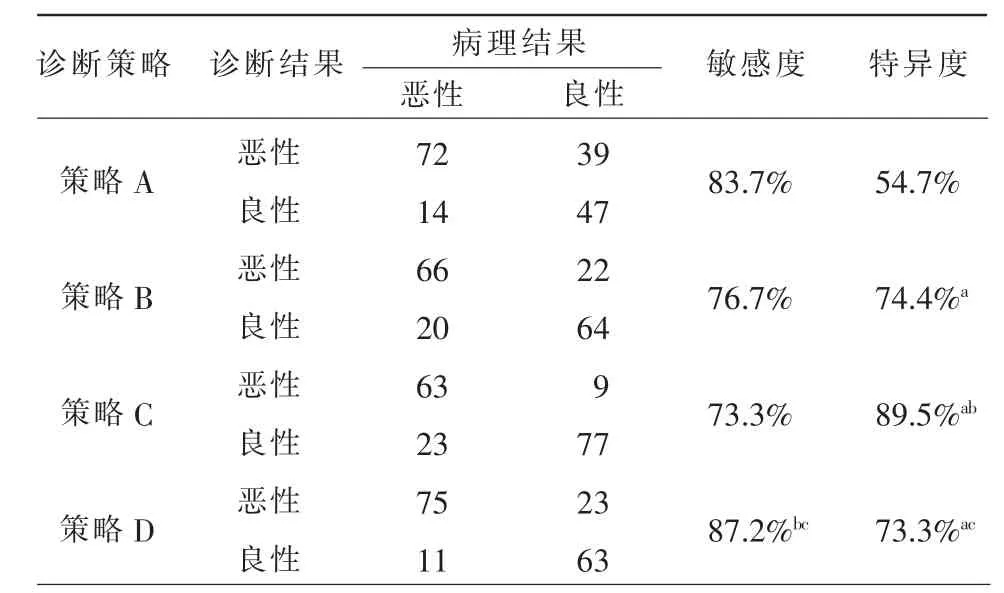
表1 不同策略诊断结果与病理结果对照及诊断效能比较
讨 论
1.卵巢肿瘤良恶性判断及检查方法选择
卵巢肿瘤为常见的妇科肿瘤,早期鉴别卵巢肿瘤良恶性,不但可以提高卵巢癌早期患者的生存率,同样可减少因误诊导致的不当医疗处置,具有重要的临床意义[8]。
卵巢癌诊断常见影像检查包括超声、CT 及MRI。超声检查简便易行,但图像清晰度、解剖关系的显示均不及CT 和MRI,未婚患者不适宜阴道超声检查,同时超声检查受操作者水平影响大。MRI 扫描范围较CT 小,无法在短时间内获得大视野图像,不利于排除腹腔转移,且各地医疗水平发展不均,高场强磁共振设备在基层医院的普及率低。腹盆腔增强CT 用于临床卵巢肿瘤的诊断主要有以下几点优势:(1)通过发现可测得的强化实性成分和非强化囊性成分以判定肿瘤囊实性,尤其是确定实性成分的存在;(2)通过多平面重组以更好地观察肿瘤与邻近脏器、血管的关系,以判定肿瘤是否起源于卵巢[9];(3)腹盆腔大视野图像可以更好地观察肿瘤转移以及胃肠道原发肿瘤等情况,以帮助判定卵巢转移性肿瘤[3,10]。但由于卵巢良、恶性肿瘤均可呈囊实性表现,两者的CT 征象存在部分重叠[3-5],单用CT 对两者鉴别困难,易发生误漏诊。
2.血清肿瘤标记物对卵巢肿瘤的诊断价值
目前常见的卵巢肿瘤标记物有CA125、HE4、癌胚抗原(carcinoembryonic antigen,CEA)以及 糖类抗原199(carbohydrate antigen 199,CA 199)。CEA与CA199 用于卵巢肿瘤良恶性鉴别诊断的特异度和敏感度均不高[11,12]。HE4 是由位于染色体20q12-13.1 上的HE4 基因编码的分泌型n-糖基化蛋白,因其首次在附睾远端上皮细胞中被发现而得名。HE4 蛋白可在女性生殖道正常腺上皮中表达,包括宫颈腺、子宫内膜腺、输卵管和Bartholin腺,正常女性血清中可检测到一定浓度的HE4[13]。研究表明,HE4 蛋白在卵巢正常上皮中表达为阴性,而在卵巢癌患者中高表达,明显高于正常女性和卵巢良性肿瘤患者[13-15]。其原因是卵巢癌细胞可高表达HE4 基因,其基因产物n-糖基化后分泌到细胞外环境中,因而可在患者血清中检测到高浓度的HE4[15-17]。研究表明HE4 对于原发性卵巢癌检测具有较高的特异度[17]。但其易受绝经状态、肺结核、肾功能等因素的影响,将其单独用于卵巢肿瘤诊断时效果欠佳。CA125 是胚胎发育过程中体腔上皮细胞表达的跨膜糖蛋白,在卵巢癌细胞中明显高表达[16,18,19]。研究表明,血清CA125 在卵巢癌的诊断中具有极高的敏感度[20],但其特异度较低,在一些诸如子宫内膜异位囊肿之类的良性卵巢肿物中也可明显增高[15,21]。单用血清CA125水平来判定卵巢肿物的良恶性会造成误诊。因此,笔者尝试联合CA125 和/或HE4 及CT 表现开展诊断分析,试图寻找简单易行诊断效能高的诊断策略。
3.联合诊断策略的可行性和分析
通过预实验,设定当血清CA125 大于正常值3 倍时作为阳性标准,可排除一部分因卵巢良性病变或妇科炎症引起的血清CA125 升高造成的假阳性。而肺结核、严重的肾功能不全均可引起血清HE4 升高[14,22],这部分患者会造成假阳性,因此也需排除。
本研究结果显示,腹盆腔增强CT 联合血清HE4 和/或CA125,鉴别良恶性卵巢囊实性肿瘤的特异度显著高于单独CT 诊断,而敏感度亦不低于单独CT 诊断。在四组诊断策略中,腹盆腔增强CT联合血清HE4 对判断卵巢囊实性肿瘤良恶性的效能最高,其原因在于联合策略充分利用了HE4对卵巢癌诊断的高特异度、CT 腹盆腔扫描大范围及定位优势。血清CA125 特异度较低,在某些良性病变时同样呈现为阳性,与HE4 及腹盆腔增强CT 联合使用时,拉低了整体的诊断特异度。值得特别注意的是,某些血清CA125 或HE4 为阴性的卵巢癌亚型(如透明细胞癌)[23],按以上策略鉴别良恶性存在一定困难。
4.研究局限性
本研究所纳入病例均为成人,未纳入18 岁以下患者,该类患者主要以生殖细胞肿瘤为主,肿瘤标记物与成人不同[24],还有待进一步研究。
综上所述,腹盆腔增强CT 联合血清肿瘤标记物能够有效提高卵巢囊实性肿瘤良、恶性鉴别诊断的符合率。采用腹盆腔增强CT 联合血清HE4 的诊断策略,诊断效能较高且简单易行,值得推广。

