纳米结构酶催化剂研究进展
夏欢,卢滇楠,戈钧,,吴建中,刘铮
(1清华大学深圳国际研究生院,广东 深圳 518055;2清华大学化学工程系,北京 100084;3加州大学河滨分校化学与环境工程系,美国 加利福尼亚 92521)
引 言
源于自然界的酶催化具有反应条件温和、(区域、立体和化学)高选择性和高催化效率等优点,已被广泛应用于精细化工、药物合成、分析检测及食品生产等[1-8]。然而,天然酶在工业环境或者操作条件下(如高温或有机溶剂)会发生变性失活、难以重复使用。解决上述问题的方法可以分为两大类,一类是采用蛋白质工程方法对酶进行分子改造[9-10],另一类是对酶进行化学修饰或者固定化[11-15]。
固定化酶常用的载体包括大孔树脂、多孔玻璃、硅藻土等,采用这类材料可以有效地解决酶回收利用的问题,但固定化酶的活性与自由酶相比往往很低,其中一个重要原因是载体尺度较大,不利于酶催化过程中底物的传质[16-18]。纳米材料由于其独特的性质和纳米效应,作为固定酶载体时,可赋予固定化酶独特的性质,如一些具有多孔结构的纳米材料往往对反应底物有一定的富集效应,可增加酶与底物接触的概率,从而提高固定化酶表观活性[19];纳米材料中的组成部分还可能对酶分子产生激活效应,进而提高固定化酶的性能[20]。采用适宜的纳米材料还可为酶分子提供适宜的微环境,能最大程度地维持其天然构象,从而提高酶在苛刻条件如高温、有机溶剂和极端pH中的稳定性[21-26]。此外,一些多功能化纳米材料与酶的结合甚至可构建出新型智能生物复合材料[27-31]。
本研究组开展纳米结构酶催化剂的研究近20年,发展了包括单分子酶纳米凝胶[32-36]、酶-高分子纳米偶联体[37-41]、酶-无机晶体[42-45]纳米杂合体、酶-MOFs[46-49]纳米杂合体、酶-石墨烯[50]纳米气凝胶等多种纳米结构酶催化剂(图1)。本文主要介绍了近期发展的新技术以及酶催化过程分子模拟新方法,讨论了纳米结构酶催化剂的发展前景。
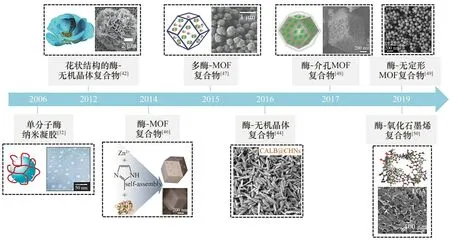
图1 纳米结构酶催化剂的研究进展Fig.1 The research progress of nanostructured enzyme catalysts
1 酶-无机晶体复合物
无机晶体材料具有较好的刚性结构,可赋予固定化酶优异的稳定性,同时,无机晶体中的金属组分还可能激活酶分子,进而提高固定化酶的表观活性。Ge等[42]利用漆酶诱导无机晶体(磷酸铜)成核,然后通过自组装形成花状结构的酶-无机晶体复合物。研究表明,由于酶与纳米无机晶体间的协同效应,纳米结构酶催化剂的活性比天然酶提高了5~7倍,并且固定化酶的稳定性得到了显著提高。Zhu等[43]基于漆酶-无机晶体纳米催化剂,构建了一种快速检测苯酚的检测器。该检测器能快速催化苯酚与4-氨基安替比林氧化偶联反应,并形成安替比林染料分子。研究表明,苯酚的检测线性范围为0.4 ~50μg·ml-1,并且该检测系统具有良好的循环使用性能,在30次循环使用后,其催化活性能保持在初始活性的80%左右。Wang等[20]基于别构效应设计出α-淀粉酶与CaHPO4无机晶体的杂化纳米催化剂。得益于纳米CaHPO4的多级结构以及钙离子对α-淀粉酶的构象调节作用,α-淀粉酶-CaHPO4纳米结构酶催化剂表现出比天然α-淀粉酶更高的活性。
此外,Li等[44]报道了辣根过氧化物酶和细胞色素C与水胆矾[Cu4(OH)6SO4]的纳米结构酶催化剂,研究表明,纳米结构水胆矾不仅对以上两种金属酶具有激活效应,同时,还赋予了固定化酶抑菌功能。进一步将该方法拓展至多酶体系共固定化,以辣根过氧化物酶和葡萄糖氧化酶为典型体系,制备了多酶-磷酸铜复合物,实现了多酶在载体中的分区分布,基于两种酶之间的邻近效应,纳米结构双酶催化剂的总活性比天然酶体系提高了3倍[45]。此外,其他酶-无机晶体纳米材料如磷酸钴[51]、氢氧化铜[52]和磷酸锌[53]等也被探索用于构建纳米结构酶催化剂[54-56]。
2 酶-MOFs复合物
金属有机骨架材料(metal-organic frameworks,MOFs)是一类新型多孔材料,由无机金属离子或团簇与有机配体通过配位键形成。与传统多孔材料相比,MOFs具有高孔隙率、大比表面积、结构多样性、易修饰及较好的生物相容性等特点,在酶固定化中有很好的研究前景[57]。
采用类似于酶-无机晶体复合物的制备方法,在合成MOFs的前体溶液中引入酶分子,可以通过原位包埋的方法将酶分子固定到MOFs载体中[58]。将细胞色素C与ZIF-8前体(锌离子和2-甲基咪唑)溶液混合,ZIF-8前体与生物分子官能团之间通过氢键、静电等相互作用促进MOFs成核和生长,使酶分子在锌离子与2-甲基咪唑自组装形成ZIF-8过程中被原位包埋其中(图2)[46]。由于MOFs本身很好的刚性结构和热稳定性,包埋后的细胞色素C稳定性显著提高。Wu等[47]采用原位包埋法将葡萄糖氧化酶和辣根过氧化物酶双酶体系包埋于ZIF-8中,利用双酶的邻近效应显著提高了级联反应的总酶活,从而提高了对葡萄糖检测的灵敏度。Zhang等[48]制备了含有介孔空洞的ZIF-8用于细胞色素C的负载,并应用于电化学检测过氧化氢。研究表明介孔有利于底物传质,与天然酶相比,固定化酶的活性提高了1.3 倍。原位包埋方法被应用于多种不同类型酶和MOFs的组合[59-65],进一步证明了该方法的普适性。Hu等[66]结合微流控技术进一步发展了该方法,通过微流体混合制备了具有缺陷结构的酶-MOF复合物,该缺陷结构使得MOF具有微孔介孔混合的多级孔道结构,在提高包埋酶稳定性同时,有利于酶催化过程的底物传递,在5次循环使用后,固定化酶仍能保持其初始活性的73%。利用MOFs对酶进行原位包埋受合成条件的限制,目前常用的MOFs主要是ZIFs系列,然而这类MOFs的孔径以微孔为主,会带来反应过程中底物传质的问题。
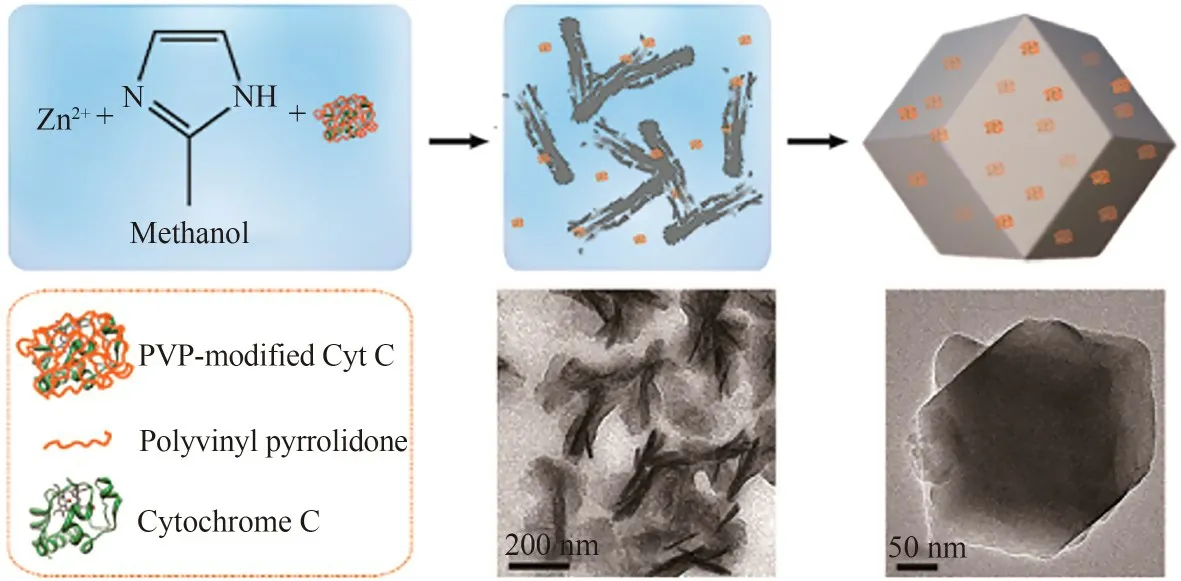
图2 采用原位合成法制备细胞色素C-ZIF-8复合物[46]Fig.2 Preparation of Cytochrome C-ZIF-8composites by an in situ approach[46]
除了原位包埋法外,先制备MOFs载体再进行酶固定化的方法也得到广泛关注[58]。Xia等[67]利用化学结合法将葡萄糖氧化酶固定于NH2-MIL-101上,以戊二醛为交联剂,使其一端通过共价键与酶分子相连,另一端连接在NH2-MIL-101上。固定化酶表现出优异的热稳定性和有机溶剂稳定性,天然葡萄糖氧化酶在60oC处理1h后活性降至初始活性的52%,同样条件下的固定化酶仍能维持初始活性的98%,同时固定化酶对乙腈、丙酮等有机溶剂的耐受性显著优于天然酶。该方法适用于大多数以MOFs为载体的酶固定化,需要对MOFs引入活性官能团,并确保参与化学结合的基团为酶分子上远离活性位点的基团,否则可能造成酶活性损失。该方法制备的固定化酶中的酶分子往往暴露在MOFs外,因此在特殊环境如胰蛋白酶、有机溶剂等条件下固定化酶的稳定性提升效果有限。此外,利用MOFs内部孔道结构对酶进行固定,能很好保留酶的活性,然而该方法要求MOFs的孔道尺寸与酶分子大小能相互匹配,如Ma等[68]将过氧化物酶(大小3.3 nm×1.7 nm×1.1 nm)固定在具有多级孔结构的介孔MOF(Tb-mesoMOF)中,该MOF空腔内分布有直径为3.9 和4.7 nm的纳米孔笼,有效防止酶的聚集。Farha等[69]设计并合成出稳定性优异的介孔MOF(NU-1003),该MOF孔径可达4.6 nm,将有肌酸酐酶固定于NU-1003中得到纳米结构酶催化剂,并用于神经毒剂的快速降解。Yaghi等[70]通过扩展有机配体的方法合成出一系列结构稳定的介孔MOFs,其孔径范围为1.4 ~9.8 nm,可用于多种酶分子的吸附固定化。
3 酶-石墨烯复合物
气相酶催化具有很好的工业应用前景,但是由于气相催化的无水环境导致酶的催化活性和稳定性都很低,难以实际应用[71]。本课题组近期研究[50]将酶包埋在亲水、富含羟基的氧化石墨烯气凝胶复合物中,如图3(a)所示。石墨烯与酶分子表面氨基酸形成的氢键起到了保持气相中酶分子构象柔性的作用,将其应用于连续流气相催化醋酸乙烯酯和香叶醇的酯交换反应,如图3(b)所示。研究发现,石墨烯气凝胶固定化的脂肪酶的表观活性比冻干的脂肪酶粉末提高了5~10倍,酶的初始活性能维持超过500h,如图3(c)所示。分子动力学模拟进一步阐释了脂肪酶-氧化石墨烯复合物的形成机理[72]。综合分子模拟和结构表征可知,氧化石墨烯与酶形成氢键取代了酶分子表面的必需水分子,这种氢键网络使得酶分子在绝干气体环境下保持结构柔性,圆二色光谱分析结果表明包埋在石墨烯中的脂肪酶保持了其二级结构。
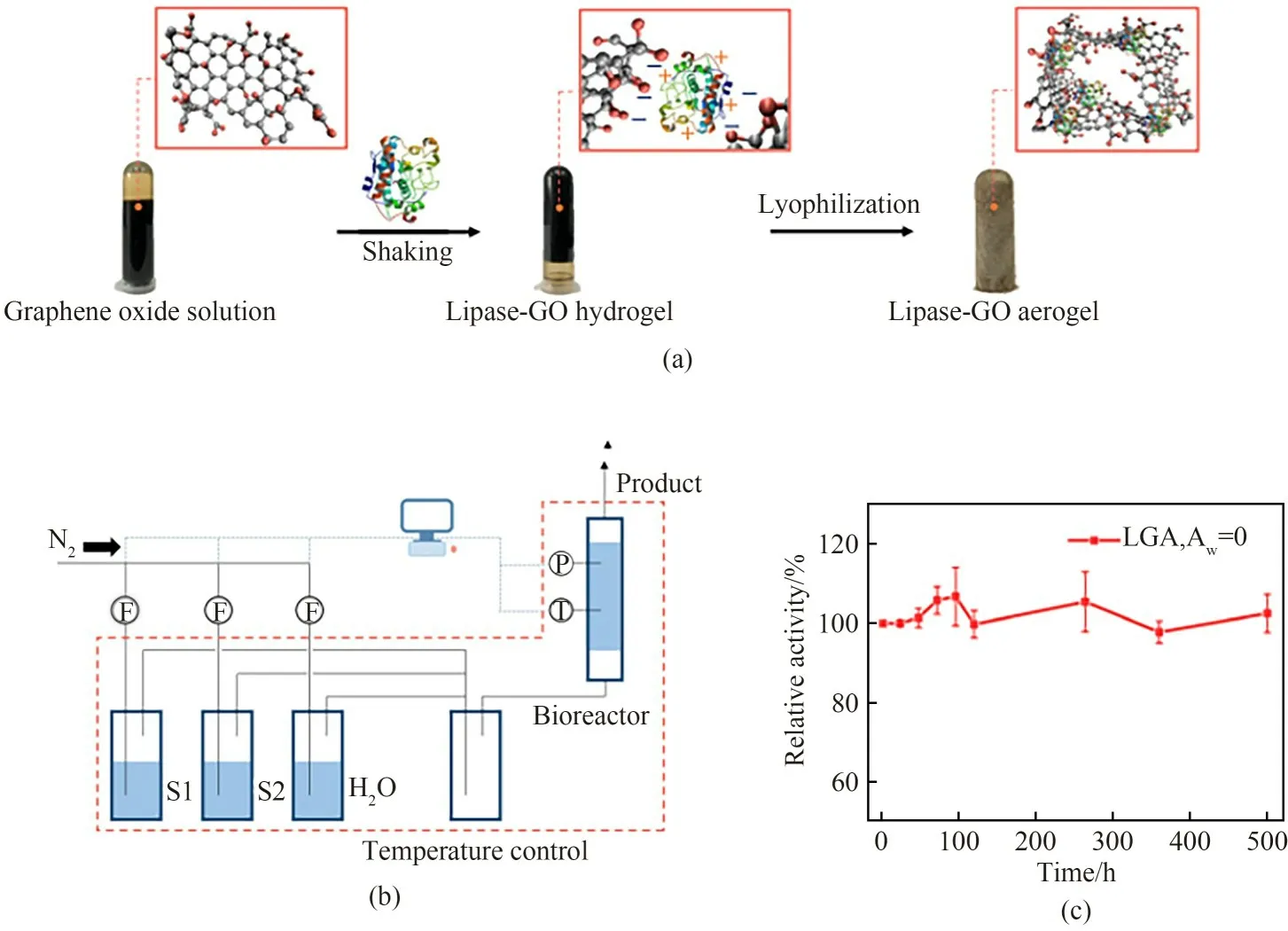
图3 脂肪酶-氧化石墨烯气凝胶复合物的制备过程(a),气态酶催化实验装置示意图(b),连续操作下脂肪酶-氧化石墨烯气凝胶的活性变化图(c)[50]Fig.3 Preparation of procedures of lipase-GO aerogel(a),schematic diagram of experimental setup for gaseous enzymatic catalysis(b),the activity of lipase-GO aerogel during a continuous operation for500h(c)[50]
4 酶-功能高分子结合物
Zhu等[37]利用Pluronic F-127对酶进行化学修饰制备了酶-Pluronic结合物,在甲苯、四氢呋喃等有机溶剂中能够很好分散,使得有机相中底物分子与酶活性中心接触的概率增加,有机相中酶的表观活性显著提高。同时,酶-Pluronic结合物具有温度响应特性,反应温度(40oC)下,结合物在有机溶剂中良好分散,当反应完成温度降至4oC时,结合物可从溶剂中沉淀,实现重复使用,在10次循环使用后,酶-Pluronic结合物的催化活性仍能保持其初始活性的95%以上。Wu等[73]将脂肪酶-Pluronic结合物用于有机介质(甲基叔丁基醚)中的不对称氨解反应,与天然脂肪酶相比,脂肪酶-Pluronic结合物的表观活性提高了11倍。Yuki等[74]将脂肪酶-Pluronic结合物应用于有机相酶催化环氧化反应,同样证实了其在有机相中的良好催化效率和稳定性。
Cheng等[75]制备了有机磷水解酶-Pluronic结合物,研究发现酶-Pluronic结合物的最适反应温度比天然酶提高了20oC,并且在pH9~11范围内的稳定性均优于天然酶。在阴离子型、非离子型和生物相容性三种类型表面活性剂存在条件下,酶-Pluronic结合物均能保持很好的催化活性。在pH9,25oC条件下,酶-Pluronic结合物在10min内能将0.1 5mmol/L的有机磷类杀虫剂完全降解。
5 纳米结构酶催化剂的构效关系研究
分子模拟技术为认识酶催化过程微观机制提供了新的工具。Cao等[76]采用分子模拟对MOFs包埋的辣根过氧化物酶和葡萄糖氧化酶双酶体系级联反应进行了研究,阐述双酶共包埋邻近效应的作用机制。研究发现,共包埋于载体中的双酶体系存在显著的邻近效应,双酶催化总效率随着酶分子间距离的缩短而显著提升,并且酶分子间的距离越短,反应速率提升越快。该研究有助于了解密闭空间中的级联反应动力学,为设计高效的多酶催化体系提供了重要指导。Wu等[49]通过调控原位包埋法中MOF前体浓度,制备了缺陷型和无定形的酶-MOF复合物。利用分子模拟结合现代表征技术阐明了缺陷对酶性能的调控机制。研究表明,通过降低有机配体与金属离子的比例导致了MOF框架的重排和有序结构的坍塌,进而产生了更大的孔隙。具有较大孔隙的MOF促进了底物传质,使酶的表观活性得到了数倍提升。
Chen等[77]建立了多尺度分子模拟和Markov状态模型相结合的酶催化过程模拟方法,揭示了CO2从本体溶液到碳酸酐酶活性位点的主要途径,以及产物HC从碳酸酐酶活性位点脱离并扩散到本体溶液中的途径[78];同时基于人工神经网络算法探索了HC与酶活性中心相互作用的机制。该方法为酶催化过程的模拟以及酶分子改造提供了重要借鉴。此外,结合现代生物波谱学技术如荧光光谱、圆二色光谱等能直接反映酶分子结构在固定化过程中的部分信息,有利于更好地研究纳米结构酶催化剂的构效关系。
6 结论与展望
纳米结构酶催化剂在实现固定化酶催化活性和稳定性的兼顾方面具有常规固定化酶所不具备的优势,同时,在非水相酶催化过程(例如气相酶催化、有机相酶催化)方面展现出突出的性能,为应用于工业催化过程的高效酶催化剂设计及构建提供了有效途径。在纳米结构酶催化剂制备过程中,如何根据工业酶催化环境、反应物、溶剂来理性设计合适的催化载体是需要阐述的关键科学问题;如何开发通用、可调、绿色并且可规模化制备的纳米固定化酶技术是需要解决的关键技术;发展能够描述纳米结构酶催化剂的催化全过程并可展示分子细节的模拟方法对于酶催化剂的设计和制备具有理论指导意义。纳米结构酶催化剂创制为计算科学、化学、材料学和生物学提供了学科交会点,而纳米结构酶催化剂的创新将会推动和促进化工工艺、装备的创新和应用。

