88例毛母质瘤临床及组织病理相关分析
许功军,黄池清,周小花,王坤,陆倩,蒋亦秀
(浙江省金华市第五医院,浙江 金华 321000)
毛母质瘤(Pilomatricoma)是一种皮肤附属器来源的良性肿瘤,临床上不多见,因皮损表现没有特征性,故易误诊及漏诊。本文回顾性分析我院经组织病理确诊的毛母质瘤的临床及组织病理特点,为提高本病的认识及诊断水平提供帮助。
1 资料与方法
1.1 临床资料 2010年1月—2019年12月在我院行手术切除及病理检查确诊的毛母质瘤88例,男47例,女41例,男女比例为 1∶0.87;发病年龄4~79岁,平均(40.3±16.61)岁,其中≤12岁 24例(27.27%),13~18岁14例(15.91%),19~59岁44例(50.0%),≥60岁 6例(6.82%);病程 2周~20年,≤1年者69例(78.41%),>1年者19例(21.59%)。
1.2 方法 研究记录患者皮损的发病部位、颜色及大小等形态特征、自觉症状、临床初诊诊断、术后复发情况等临床特征,整理并归纳分析;同时调阅组织病理切片,由2位皮肤病理诊断医师共同阅片,诊断标准参照国内外专著,复习病理切片并统计分析。
1.3 统计学分析 采用SPSS 20.0软件对数据进行整理、分析,计数资料以例数、百分比表示。
2 结果
2.1 临床表现 88例毛母质瘤患者中,发病部位以头面颈部多见,共计48例,躯干5例,四肢35例,其中上肢32例;除1例为多发结节外,其余均为单发;有1例手术切除后复发。皮损表面多为肤色肿块,见图1a,8例呈红色,5例呈淡灰蓝色,3例呈黄白色,2例呈褐色,同时有1例表面出现水疱样表现,见图1b,3例局部出现破溃,见图1c;皮损形态不一,多为圆形、椭圆形、不规则形;皮损长径≤1 cm者28例(31.82%),>1 cm 者60例(68.18%),最小长径为0.3 cm,最大长径为5.2 cm;23例有轻度疼痛或及触痛,其余无自觉症状。见表1。
2.2 初诊诊断 毛母质瘤21例,表皮囊肿27例,皮肤钙沉着症11例,皮肤纤维瘤8例,毛鞘囊肿5例,异物肉芽肿5例,角化棘皮瘤4例,脂肪瘤3例,毛发上皮瘤2例,脂囊瘤2例,临床与病理诊断符合率为23.86%。见表1。

表1 毛母质瘤患者的临床诊断与临床特征的分布情况 例(%)
2.3 组织病理检查 88例组织标本HE染色均表现典型的病理改变:大多数瘤体位于真皮深层至皮下组织,7例(7.95%)位于真皮浅层,瘤团主要由2种细胞组成:一种为基底细胞样的嗜碱性细胞,胞核为圆形或细长形,胞质少,界限模糊,常排列于瘤团的一侧或外周;一种为影细胞,界限清楚,中央有空白区,类似消失的胞核的影子,见图1d;其中69例(67.05%)可见过渡细胞,见图1e。72例(84.09%)瘤团周围有炎性细胞浸润,57例(64.77%)有异物巨细胞,钙化或钙盐沉积51例(57.95%),骨化1例(1.14%);有3例(3.41%)瘤团上方表皮缺失,与外界相通,见图1f,1例(1.14%)真皮胶原间高度水肿,淋巴管扩张,67例(76.14%)周围有结缔组织包绕。
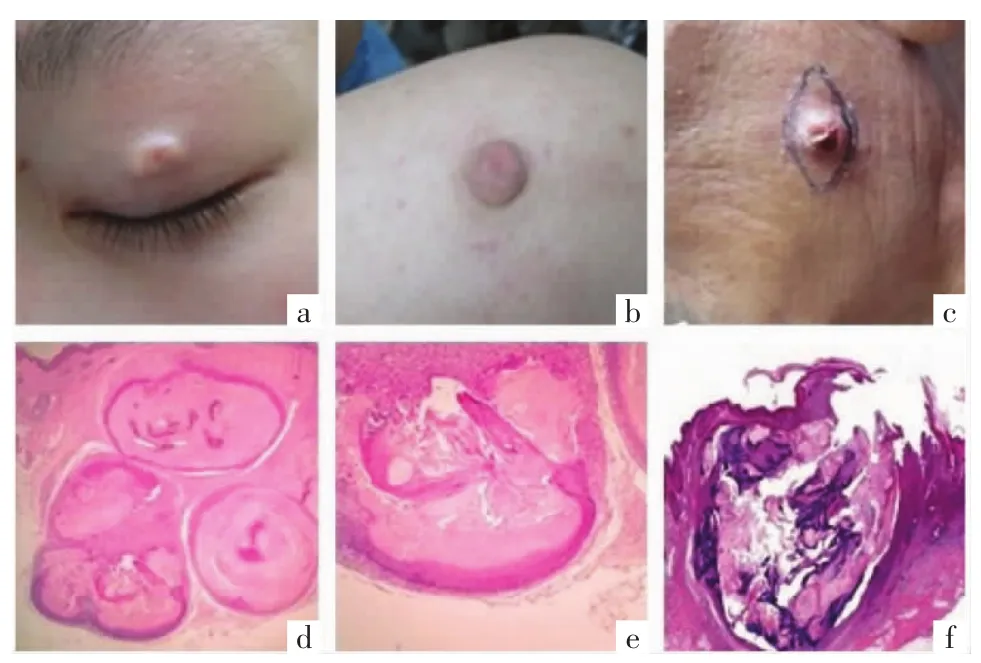
图1 毛母质瘤患者的临床及组织病理表现
3 讨论
毛母质瘤是一种向毛发细胞特别是毛皮质细胞分化,良性的皮肤附属器肿瘤。最初于1880年由Malherbe和Chenantaisin描述,后被命名为Malherbe钙化上皮瘤,1961年Forbis和Helwig证明了该肿瘤起源于毛发基质,并提出了毛母质瘤这一术语[1]。男女发病率差异无统计学意义,可发生于任何年龄,以儿童及青少年多见,但也有研究认为毛母质瘤的发病年龄呈双峰模式,即第一个高峰出现在5~15岁,第二个高峰出现在50~65岁[2],本研究中≤18岁的患者占43.18%,可能与年轻患者因美容原因来医院就诊较多有关。临床上通常表现为缓慢增大、无自觉症状的坚实、深在的结节,表面皮肤正常,偶尔可出现色素沉着表现。皮损位置偶可表浅,使被覆皮肤呈蓝红色改变,并因钙化出现黄色或者白色斑点,也可突出呈1个界限清楚的暗红色结节,本研究中有16例(18.18%)出现红蓝色或者黄白色改变,考虑与肿瘤位置较浅有关。肿瘤直径通常为0.5~6 cm,>5 cm的被定义为巨大毛母质瘤[3]。皮损通常单发,少数可多发,据报道,多发性或家族性病变可能与强直性肌营养不良、Gardner综合征、Rubinstein-Taybi综合征、Turner综合征、Soto 综合征、Kabuki综合征、关节过度活动综合征、9-三体综合征、Steinert病、颅骨发育不全、结节病、结节性硬化症等相关[2,4-6],本研究中1例为多发性病变,但没有系统性异常及家族史。皮损可发生在大多数有毛发的部位,但头颈、上肢为最常见的发生部位,本研究中头颈部的患者超过一半(54.55%),与王玲等[7]研究一致。
组织病理上表现为不规则的上皮细胞团块,边界清楚,周围由结缔组织被膜包绕;上皮细胞团块由嗜碱性细胞和影细胞组成,二者之间有过渡细胞,可伴有炎性浸润或异物反应,并可出现钙化或骨化,影子细胞是其诊断的重要依据[8]。有研究将组织病理改变分为4个阶段:早期、完全发展期、退化早期、退化晚期[9],随着病程进展,嗜碱性细胞逐渐转化为影细胞而数量减少,并逐渐出现钙化和骨化,影细胞是诊断毛母质瘤的必要条件。毛母质瘤有许多亚型,包括大疱性、穿通性、增殖性、棘层溶解性、色素性、囊性、假囊性等[10],本研究以经典型表现为主,同时发现 2例(2.27%)大疱性,3例(3.41%)穿通性毛母质瘤,其他亚型未发现,可能与本研究样本量少有关。
毛母质瘤确切的病因与发病机制尚不清楚,Wnt信号通路在毛囊发育和向毛囊分化肿瘤的发生和发展中可能发挥着重要的调节作用,β-连环蛋白是Wnt信号通路的关键分子,β-连环蛋白基因(CTNBB1)的突变已被认为参与毛母质瘤的发生[11],同时APC基因、Bcl-2基因及Wingless途径的异常表达及传导也被认为是毛母质瘤发生的重要原因[12]。近期研究发现,毛母质瘤的肿瘤细胞、成纤维细胞或巨噬细胞可分泌基质金属蛋白酶(MMP)9、MMP12,引起胶原纤维和弹力纤维降解,从而导致大疱性或穿通性毛母质瘤的外观[13-14],也有研究认为可能与肥大细胞的浸润有关[15]。
临床上需与表皮囊肿、毛鞘囊肿、脂肪瘤、隆突性皮肤纤维肉瘤、皮肤钙沉着症、异物肉芽肿、角化棘皮瘤、血管瘤、皮肤纤维瘤及皮肤转移癌等鉴别;病理上需与基底细胞癌、毛发上皮瘤、汗孔瘤、增生性外毛根鞘囊肿及神经内分泌癌等鉴别。鉴于毛母质瘤有多种不同表现,临床上被误诊并不少见,本研究中临床与病理诊断符合率为23.86%,与O'Connor等[16]报道的相近,误诊率达76.14%,最易误诊为表皮囊肿(30.68%),其次是皮肤钙沉着症(12.5%),考虑可能原因是表皮囊肿临床更常见,同时部分毛母质瘤伴有钙化后临床出现黄白色斑点,易与皮肤钙沉着症混淆。
临床上,可以借助一些特殊体征表现及辅助检查来协助诊断。在毛母质瘤肿块的表面拉伸皮肤可使结节表面变得明显,即显示多面及多角的“帐篷征”;当沿肿块边缘轻轻挤压时,可在病灶内看到皮肤的中央纵向折痕,该折痕垂直于皮肤张力线,即“皮肤折痕征”;此外按压病灶的一边会导致另一边像“跷跷板”一样从皮肤上突出,这3种体征都是诊断毛母质瘤的有用的临床线索[17]。同时作为一种低成本、非侵入性的检查方式,超声检查对于毛母质瘤的诊断有一定的临床价值。杨林等[18]研究发现,头颈部区域皮下层紧邻皮肤、不均质低回声、边缘环状低回声、直径<20 mm及合并钙化的病变,且年龄<20岁时,应考虑毛母质瘤;对于非钙化型毛母质瘤,当具备上述征象外,若年龄<10岁,直径<10 mm,亦应考虑毛母质瘤。
毛母质瘤有侵袭性生长及恶变的报道,以老年男性为主。本病不能自然消退,故首选治疗方案是手术彻底切除,同时尽量避免扩大切除。
综上所述,毛母质瘤临床表现多样,容易误诊;对于头颈部坚实的皮下肿块,尤其发生在青少年,要考虑毛母质瘤的可能性,临床检查时“帐篷征”、“皮肤折痕征”、“跷跷板”样表现是有价值的诊断线索,必要时可行超声及组织病理检查进一步证实,减少误诊。

