响应面优化超声辅助浸提藜麦多酚工艺及其抗氧化研究
朱孔飞,吴榕珍,吴子威,程丽娜,宋 茹
(浙江海洋大学食品与药学学院,浙江 舟山 316022)
藜麦(Chenopodium quinoaWilld.)属于藜科植物,起源于安第斯地区,距今已有五千多年的种植历史。1987年引入中国后,在西藏、宁夏、山西和四川等地皆有种植[1]。藜麦是一种营养价值很高的伪谷物,富含蛋白质、脂类、纤维、维生素和矿物质等物质。此外,藜麦还富含多酚、类黄酮、皂苷和植物甾醇类物质,具有多种保健功效。基于其丰富的营养价值和保健功能被联合国粮农组织(FAO)认定为惟一一种单体植物就可满足人体基本营养需求的食物,被国际营养学家称为营养黄金、超级谷物[2]。有研究表明,藜麦中含有的多酚具有抗氧化、抑菌及调节人体免疫力等多种功能活性,在食品、医药、保健品等领域应用前景广阔[3,4]。现已有研究对提取藜麦多酚的工艺大多采用乙醇—水溶液为提取剂,乙醇水溶液提取得到多酚含量高,但不利于工业安全。采用以水为提取剂,更加安全,且原料来源广,价格低廉,有利于工业生产。所以本研究以红藜麦为原材料,采用超声辅助水浸提法提取藜麦多酚,以多酚提取率为指标,探究物料粒度、液料比、提取时间和提取温度对多酚提取率的影响,优化多酚提取工艺参数,旨在提供一种高效清洁型的藜麦多酚提取方法,并对藜麦多酚抗氧化性进行研究,为藜麦多酚工业化生产应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
红藜麦,山西省静乐县田园农业综合开发有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),北京索莱宝科技有限公司;总抗氧化能力(T-AOC)测试盒,南京建成生物研究所;福林酚、没食子酸、无水碳酸钠、抗坏血酸、无水乙醇等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
TGL-16G高速离心机,上海安亭科学仪器厂;721可见分光光度计,上海菁华科技仪器有限公司;KQ5200E超声波清洗器,昆山市超声仪器有限公司;TM-767搅拌机—专业沙冰调理机,中山市海盘电器有限公司;RE2000A旋转蒸发器,上海亚荣生化仪器厂;DLSB-5/20低温冷却液循环泵,杭州惠创仪器设备有限公司;LGJ-10冷冻干燥机,河南兄弟仪器设备有限公司;SM800型酶标仪,上海永创医疗器械有限公司。
1.3 试验方法
1.3.1 没食子酸工作曲线的绘制 根据陈树俊等[5]的方法进行测定,稍作修改。具体如下:称取0.01g没食子酸,加水溶解,定容至100 mL。分别吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL没食子酸溶液于10 mL比色管中,加入0.5 mL福林酚试剂,混匀,反应5 min,然后加入1 mL的7%Na2CO3,用水定容至10 mL,放置室温避光反应1 h后,测定760 nm波长下的吸光值。以没食子酸质量浓度(μg/mL)为横坐标(x)、吸光度值为纵坐标(y)绘制标准曲线,经拟合得到线性回归方程y=0.051 9x+0.000 6(R2=0.998 2),用于计算提取液中多酚浓度。
1.3.2 样品预处理 将红藜麦粉碎,按照质量加入5倍体积的石油醚,浸提24 h脱脂,干燥至恒重,密封袋中保存备用。
1.3.3 超声辅助提取藜麦多酚单因素试验 以藜麦多酚提取率为指标,在物料粒度60目、液料比100∶1(mL/g,下同)、提取时间20 min、提取温度60℃的基础上,分别研究物料粒度20、40、60、80、100、120目,液料比25∶1、50∶1、75∶1、100∶1、125∶1、150∶1,提取时间5、10、20、30、40、50、60 min,提取温度24、30、40、50、60、70、80℃对藜麦多酚提取率的影响。
1.3.4 藜麦多酚类化合物提取率计算 参考阙淼琳等[6]方法,具体如下:取1 mL提取液,参照“1.3.1”标准曲线制作方法,测定提取液中多酚类化合物含量,计算藜麦多酚提取率。

式中,C为没食子酸浓度(μg/mL),由“1.3.1”标准曲线获得;V为样品提取液体积(mL);N为提取液稀释倍数;M为样品质量(g)。
1.3.5 响应面优化试验设计 在单因素试验结果基础上,确定超声提取温度为常温,选择物料粒度(A)、液料比(B)、提取时间(C)进行三因素三水平Box-Behnken响应面试验分析[7],以藜麦多酚提取率为响应值,采用Design-Expert 12软件对试验结果进行拟合分析,具体因素水平及水平见表1。
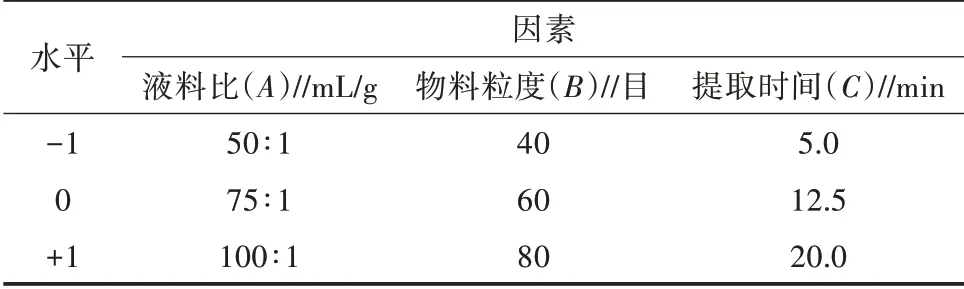
表1 Box-Behnken试验设计因素和水平
1.3.6 抗氧化活性的测定
1)DPPH自由基清除率的测定。参照Bersuder等[8]的方法进行改进,将不同浓度的藜麦多酚提取液、去离子水和0.02%DPPH乙醇液,体积比为1∶4∶1混合,室温下避光放置1 h,去离子水调零,在波长510 nm处测其吸光质(A样品),A对照是用等体积去离子水代替样品的吸光质,A样品空白是用等体积无水乙醇代替0.02%DPPH乙醇液的吸光值。DPPH自由基清除率按照式(2)计算。

2)总抗氧化能力的测定。使用总抗氧化能力测试盒进行测定。按要求准备工作液,取藜麦多酚粗提物配制成一定质量浓度的提取液备用,按操作步骤加入试剂,于520 nm处测定吸收度值(OD)。在37℃时,每分钟每毫升样品液使反应体系的吸光度值每增加0.01时,为一个抗氧化能力单位,总抗氧化能力按照式(3)计算。

1.3.7 数据处理 数据用Excel 2018软件进行处理,结果用平均值±标准差表示(n=3)。
2 结果与分析
2.1 超声辅助提取藜麦多酚单因素试验
由图1a可知,当物料粒度从20目到60目时(目数越大,固体颗粒粒径越小),多酚提取率随着藜麦粒径的减小而明显上升。由于物料粒径减小,致使藜麦颗粒表面积增大,超声时与溶剂的接触面积增大[9],对细胞壁的破坏作用增强,促进多酚化合物的溶解,提高了多酚提取率。在60~120目,当物料粒径继续减小时,多酚提取率趋向平缓,可能是由于超声波在该条件下对藜麦细胞壁的破坏作用相差不大,或藜麦多酚已较完全地溶出,继续减小物料粒径对多酚提取率几乎不产生影响[10]。由于固体颗粒粒径过小,筛选不易,因此提取藜麦多酚要控制适合的粉碎粒度。
由图1b可知,当液料比从25∶1到100∶1时,多酚提取率随着溶剂量的增加而快速上升。这是由于溶剂量较低时,藜麦颗粒和溶剂接触不充分,造成提取不完全。随着溶剂量的加大,样品颗粒与溶剂接触更为充分,提高了多酚的提取率。当液料比从100∶1到150∶1时,提取率稳定在一定范围。溶剂量过高会增加藜麦颗粒中其他水溶性杂质溶出[11],降低多酚的提取率,且溶剂量过大也不利于后续浓缩处理。
由图1c可知,当超声提取温度从24℃(室温)升高到60℃时,多酚提取率总体变化不大。当提取温度为70℃时,多酚提取率达到0.51%,可能是因为温度升高增加溶剂分子与溶质分子间动能,促进多酚溶解,从而提高了多酚提取率。但是当提取温度大于70℃时,多酚的提取率出现下降趋势,可能与温度过高导致多酚类化合物发生氧化或降解有关[12]。
由图1d可知,当超声提取时间从5 min增加到10 min时,多酚提取率随时间增加而上升,在提取时间10 min时,多酚提取率最高达到0.49%。当提取时间大于10 min时,多酚提取率出现下降趋势,可能是由于超声波机械振动产生热能促进多酚化合物的降解或促使其他物质的溶出[13],从而降低多酚的提取率。

图1 不同提取条件对藜麦多酚提取率的影响
2.2 超声辅助提取藜麦多酚响应面试验
2.2.1 响应面优化试验结果与方差分析 在单因素试验基础上,选择对藜麦多酚提取率影响大的液料比(A)、物料粒度(B)和提取时间(C)进行三因素三水平响应面分析试验,结果见表2。

表2 Box-Behnken试验设计及结果
经Design-Expert 12软件对表2试验数据进行二次多项式回归方程分析,得到Y(多酚提取率)、A(液料比),B(物料粒度),C(提取时间)的回归线方程:Y=0.410 6+0.042 4A+0.085 8B+0.004 4C+0.006 2AB+0.0085AC-0.0093BC+0.0017A2-0.0271B2+0.0092C2。回归方程中各项系数绝对值的大小和正负,分别反映各单因素对响应值的影响程度和影响方向[14]。表3方差分析结果显示模型P为0.000 2小于0.05,失拟项值0.352 8大于0.05,且模型R2=0.963 5,表示试验模型有效可行,可用于预测超声辅助藜麦提取率的高低。当P<0.05时,说明该因素对响应值影响显著。由此可知,液料比、物料粒度对藜麦多酚提取率有显著影响,而提取时间影响不显著。
2.2.2 响应面交互作用 液料比和物料粒度(AB),液料比和提取时间(AC),物料粒度和提取时间(BC)的交互作用与藜麦多酚提取率的关系见图2。由图2a可知,当液料比一定时,随着目数增大,即物料粒径减小,藜麦多酚提取率显著增大,说明物料粒度对藜麦多酚提取率有显著线性影响,即物料粒径越小,与提取液的接触面积增大,有利于提取溶剂与藜麦的充分反应,且多酚从物料内部扩散到溶剂所需时间越短,因而提取率增高,这与表3方差分析结果一致;当物料粒度一定时,藜麦多酚的提取率随着料液比的增大而增大,说明增大提取剂用量有助于多酚从物料内部扩散到溶剂中,可能与增大物料内外多酚浓度差有关。由图2b可知,当提取时间一定时,液料比增大有利于提高藜麦多酚提取率;当液料比一定时,随着超声提取时间的增大,藜麦多酚提取率的变化平缓,说明超声提取时间对藜麦提取率并无显著影响。由图3c可知,当物料粒度一定时,藜麦多酚的提取率没有随着超声提取时间的变化而发生明显改变;当提取时间一定时,藜麦多酚的提取率随着物料粒度目数的增大而显著提高,进一步说明了物料粒度对藜麦多酚提取率有显著影响,与图2a结果一致。
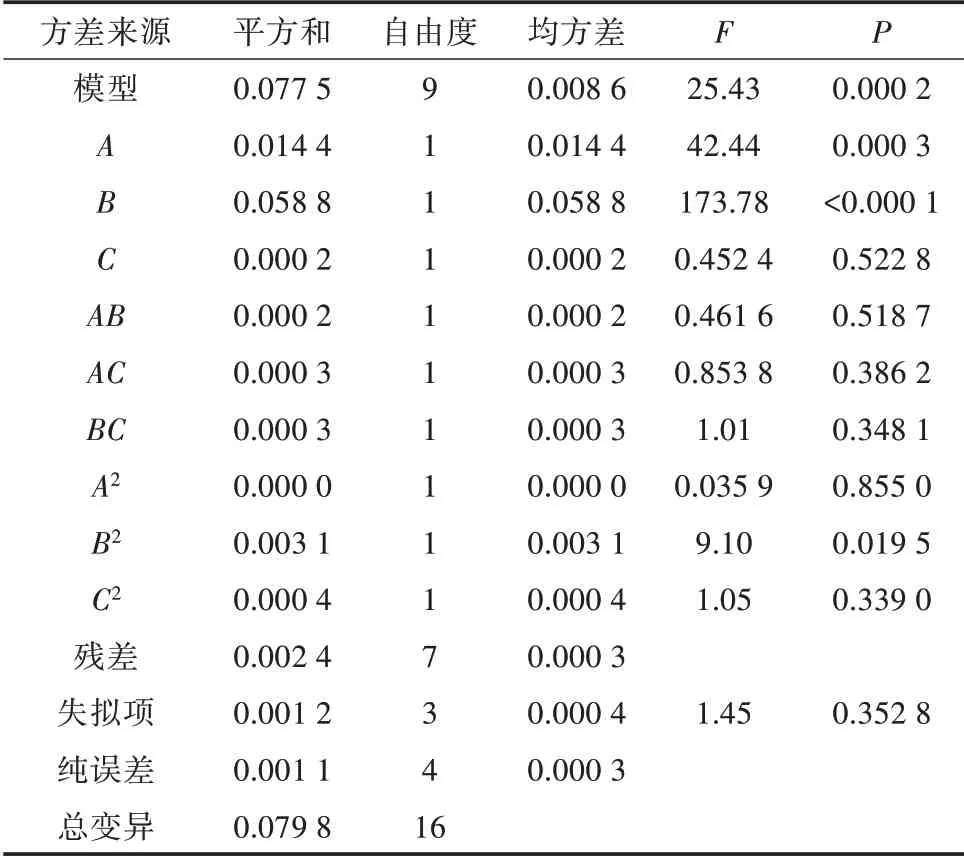
表3 响应面试验方差分析
由软件分析得出超声辅助提取藜麦多酚最佳工艺参数为液料比100∶1,物料粒度80目,超声提取时间20.0 min,在此条件下,藜麦多酚的提取率理论值达0.532%。在优化提取条件下进行了3组平行试验,验证藜麦多酚实际平均提取率达到0.526%,与理论预期值接近,表明试验确定的优化条件是合理的,可以推广用于藜麦多酚的超声辅助提取。
2.3 抗氧化能力的测定
2.3.1 DPPH自由基清除能力的测定 由图3可知,藜麦多酚和抗坏血酸清除DPPH自由基的能力在一定范围内随着质量浓度的增加而增强。拟合可得藜麦多酚和抗坏血酸线性回归方程分别为Y藜麦多酚=4.474 2X(R2=0.983)和Y抗坏血酸=4.711 5X(R2=0.985 1),计算得出藜麦多酚与抗坏血酸清除DPPH自由基的IC50分别为11.18、10.61μg/mL,说明藜麦多酚对DPPH自由基清除能力与抗坏血酸近似,其具有较好的DPPH自由基清除能力。

图3 藜麦多酚与抗坏血酸对DPPH清除率的影响
2.3.2 总抗氧化能力的测定 从表4可以看出,藜麦多酚提取液的总抗氧化能力与抗坏血酸相近,说明以水为提取剂,采用超声辅助浸提法得到的藜麦多酚提取液具有较好的总抗氧化能力。藜麦水提液中存在多种具有抗氧化活性成分,如多酚、黄酮、皂苷等,但最主要的是多酚类物质,研究表明多酚类发挥强抗氧化作用与其为自由基提供供体,阻断自由基连锁反应有关[2]。

表4 总抗氧化能力对比
3 小结
超声辅助水浸提藜麦多酚具有快速、安全、无污染优点,在研究物料粒度、液料比、提取时间和提取温度对藜麦多酚提取率影响基础上,选用物料粒度、液料比、提取时间进行三因素三水平Box-Behnken响应面试验,确定室温下超声辅助水浸提藜麦多酚的最佳工艺条件为物料粒度80目、液料比100∶1、提取时间20 min,该条件下藜麦多酚的提取率达到0.53%。藜麦多酚提取液对DPPH自由基清除率和总抗氧化能力与抗坏血酸的抗氧化能力相当。因此,藜麦多酚提取液有进一步开发作为天然抗氧化剂的应用前景。

