不同品种柑橘果实的类黄酮分离纯化及其抗氧化活性研究
朱泰霖,王慧心,陈杰标,王岳,曹锦萍,李鲜,孙崇德
(浙江大学果实品质生物学实验室/农业农村部园艺植物生长发育与品质调控重点开放实验室/园艺产品冷链物流工艺与装备国家地方联合工程实验室/园艺植物整合生物学研究与应用浙江省重点实验室,杭州 310058)
柑橘(Citrusspp.)是芸香科(Rutaceae)柑橘属(Citrus)植物,在我国拥有悠久的种植历史和丰富的种质资源。如今,我国柑橘种植逐渐趋于规模化,柑橘加工业也在不断发展。据统计,世界柑橘总产量的33%被用于果汁生产,而商业衍生产品(如鲜榨果汁、脱水产品、果酱和调味剂)需消耗大量果实并产生大量废弃物。由加工业产生的柑橘废料估计超过6 000 万t/a,其中柑橘果皮占比为40%~50%[1-3]。而柑橘果皮中富含的胡萝卜素、精油、果胶、类黄酮、柠檬苦素等生物活性物质,具有抗氧化[4]、抗过敏[5]、抗炎[6]、抗癌[7-8]、降血压[9]、降血脂[9-10]等生物活性。对柑橘果皮等加工废弃物进行合理利用,既可减少产品浪费,避免对环境污染,又可用于天然活性成分的研究开发。
柑橘类黄酮是柑橘中一种多酚类次生代谢产物,种类多样,具有品种特异性和组织特异性;通常,柑橘果皮中的类黄酮含量高于果肉[11]。迄今已从柑橘中鉴定出250多种类黄酮[12]。根据类黄酮的基本结构、官能团种类及位置,柑橘中的类黄酮主要有以下7 类:黄烷酮、黄酮、黄酮醇、黄烷醇、多甲氧基黄酮、异黄酮和花色苷[13]。虽然类黄酮在不同柑橘品种中存在种类及含量上的差异,但黄烷酮和多甲氧基黄酮是柑橘中最重要的类黄酮[14]。在不同柑橘品种中,黄烷酮的种类和含量差异较大:在柚类果皮中,含量最为丰富的是柚皮苷,而在葡萄柚果皮中,除柚皮苷外,还有较多的橙皮苷、新橙皮苷、圣草次苷、新圣草次苷等;在宽皮柑橘中,橘类中的主要黄烷酮为柚皮芸香苷和橙皮苷,其中橙皮苷含量远高于柚皮芸香苷;在橙类中,酸橙中主要的黄烷酮是柚皮苷与新橙皮苷,而在甜橙中占主导地位的则是柚皮芸香苷和橙皮苷,且2 种物质含量相近;柑类中的‘瓯柑’则比较特殊,与其他柑橘品种相比,其主要的黄烷酮是新橙皮苷[15]。多甲氧基黄酮是一类特殊的类黄酮,主要分布在柑橘油胞中,而在果肉等其他果实组织中几乎没有[16]。柑橘中主要存在的多甲氧基黄酮为川陈皮素和橘皮素。有研究表明,与其他类黄酮相比,多甲氧基黄酮在温州蜜柑等普通栽培品种中含量较少,但在‘瓯柑’等特色果实中含量较高[17]。柑橘果实中的黄酮类化合物有抗氧化、抗癌、抗炎等功能,不同柑橘种类或品种果实中的黄酮类化合物因结构不同,其抗氧化活性具有较大差异。黄烷酮组分和单体具有较强的自由基清除能力和金属离子还原作用,而多甲氧基黄酮组分和单体仅在细胞评价体系中表现出较强的抗氧化能力,其化学抗氧化能力较弱[17]。本研究以柚类、葡萄柚类、甜橙类、酸橙类、橘类和柑类的代表性品种为材料,通过建立分段分离和半制备色谱纯化方法,对不同品种柑橘果实的类黄酮提取物进行纯化,并对柑橘分段产物和单体进行抗氧化评价,旨在为柑橘类黄酮的分离纯化和开发利用提供技术储备和支撑。
1 材料与方法
1.1 试验材料
本研究所采用的6 个试验材料于2019 年采自浙江衢州、台州、金华、温州及湖北宜昌(表1)。果实采摘时均处于商品成熟期,于采收后24 h内运至浙江大学果树科学研究所实验室,挑选出大小相对一致、色泽均匀、无机械伤及病虫害的果实,用清水进行清洗,将果皮分离后立即在液氮中冷冻,然后于真空冷冻干燥机内冷冻干燥72 h,储存于-40 ℃冰箱中,备用。
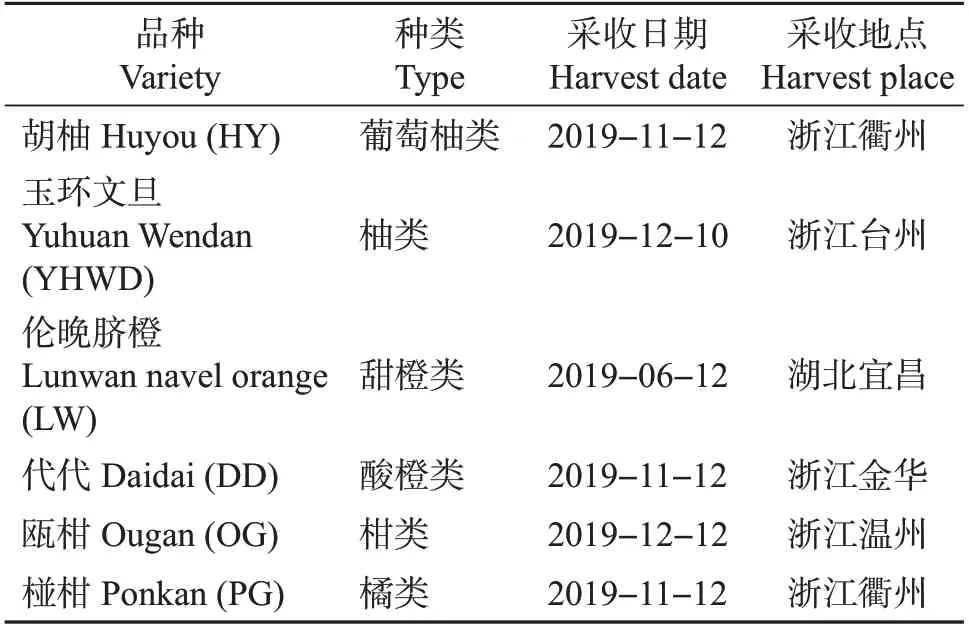
表1 果实材料、采收地点和采收日期Table 1 Fruit materials,harvest places and harvest dates
1.2 主要仪器与试剂
真空冷冻干燥机(FM 25EL-85,美国VirTis 公司),超声波药品处理机(JBT/C-YCL500T/3P,山东省济宁市金百特电子有限责任公司),高速冷冻离心机(5810R,德国Eppendorf 公司),旋转蒸发仪(Laborota 4000-efficient,德国Heidolph 公司),低温冷却循环泵(DLSB-2005,杭州大卫科教仪器有限公司),真空浓缩仪(Concentrator plus,德国Eppendorf公司),固相萃取柱(Sep-pak®C18,美国Waters 公司),固相萃取系统(SBAB-57265,美国Supelco 公司),超高效液相色谱系统(2695 泵-2996 二极管阵列检测器,美国Waters 公司),超高效液相色谱(1290 Infinity,美国Agilent公司),三重四级杆质谱联用系统[Agilent 6460,电喷雾(electrospray ionization,ESI)离子源,美国安捷伦公司],半制备型高效液相色谱仪(2535四元泵-2998二极管阵列检测器-2707自动进样器,美国Waters 公司),酶标仪(Synergy H1,美国Biotek公司)。
试验中所用色谱级甲醇、乙腈购自美国Sigma-Aldrich公司,所用水均为双蒸水,用于超高效液相色谱(ultra-high performance liquid chromatography,UPLC)及半制备型高效液相色谱(high performance liquid chromatography,HPLC)的样品在进样前均经过0.22 μm 过滤器过滤,其他分析级试剂均购自中国医药集团(上海)股份有限公司,甜橙黄酮标准品购自云南西力生物技术股份有限公司,新西兰牡荆苷、野漆树苷、圣草次苷、新圣草次苷、柚皮芸香苷、柚皮苷、橙皮苷、新橙皮苷、枸橘苷、异甜橙黄酮、川陈皮素、橘皮素、5-去甲基川陈皮素标准品均购自上海源叶生物科技有限公司。
1.3 试验方法
1.3.1 不同品种柑橘果实类黄酮粗提液的制备
分别称取6 个柑橘品种各50 g 冷冻干燥果皮粉末,按照料液质量体积比1∶20 加入80%乙醇1 000 mL,超声波辅助提取30 min,8 000 r/min 离心10 min,重复3 次后合并上清液。取1 mL 上清液置于真空浓缩仪上旋转蒸发至无有机相溶液,溶于1 mL色谱级甲醇中,经过滤膜过滤后用UPLC检测鉴定类黄酮,重复3次。将剩余上清液于37 ℃条件下减压旋转蒸发以去除乙醇相,然后加水定容至600 mL。
1.3.2 柑橘类黄酮的UPLC 分析
利用Waters 2695-2996 型UPLC 系统进行类黄酮分析,以Waters Acquity UPLC HSS T3(1.8 μm,2.1 mm×150 mm)液相色谱柱为固定相,流动相为水(流动相A)和乙腈(流动相B)。梯度洗脱程序:0~0.5 min,2%~20%B;0.5~2.5 min,20%B;2.5~8.5 min,20%~28% B;8.5~10.5 min,28%~50% B;10.5~15.0 min,50%~98% B;15.0~15.5 min,98%~2% B;15.5~16.0 min,2% B。扫描波长为200~600 nm,流速为0.4 mL/min,柱温为30 ℃,进样体积为2 μL。
将标准品用色谱级甲醇配成1 mg/mL 的母液,然后按20,2-1,2-2,…,2-78 个浓度梯度稀释,各取2 μL 进行UPLC 检测。以峰面积为横坐标、标准品浓度为纵坐标绘制标准曲线。
1.3.3 不同品种柑橘果实类黄酮分段产物的富集
首先进行固相萃取柱的动态试验,以确定不同品种柑橘果实的最佳上样量、洗脱浓度和洗脱体积。用2 倍柱体积(bed volume, BV)甲醇将Seppak®C18 固相萃取柱活化,然后用5 BV 水将其平衡。上样后用20 BV 的蒸馏水冲洗去杂,随后用不同浓度的甲醇洗脱液对不同粗提液进行洗脱,每个柑橘品种均可得到3 个不同组分的洗脱液。在37 ℃条件下,利用旋转蒸发仪将洗脱液蒸至无有机相,分别得到各分段产物粉末。
1.3.4 类黄酮的进一步纯化及鉴定
通过固相萃取柱对供试柑橘果实类黄酮进行初步分离后,进一步通过半制备型HPLC(2535四元泵-2998二极管阵列检测器-2707自动进样器)纯化各分段产物粉末。
分段产物Ⅰ及分段产物Ⅱ的色谱条件。以SunFireTMprep C18 OBDTM 制备柱(5 μm,19 mm×250 mm)为固定相;流动相为水(流动相A)和甲醇(流动相B)。梯度洗脱程序:0~10 min,10%~40%B;10~40 min,40%~60% B;40~60 min,60%~80% B;60~80 min,80%~100% B;80~90 min,100% B;90~95 min,100%~10% B。扫描波长为200~600 nm,流速为3 mL/min,柱温为25 ℃,进样体积为300 μL,进样质量浓度为100 mg/mL。分段产物Ⅲ的色谱条件:以SunFireTMprep C18 OBDTM制备柱(5 μm,19 mm×250 mm)为固定相;流动相为水(流动相A)和乙腈(流动相B)。梯度洗脱程序:
0~5 min,10%~60% B;5~20 min,60%~80% B;20~34 min,80%~86%B;34~44 min,86%B;44~48 min,86%~100% B;48~50 min,100% B;50~53 min,100%~10%B。扫描波长为200~600 nm,流速为5 mL/min,柱温为25 ℃,进样体积为200 μL,进样质量浓度为100 mg/mL。分管收集单体后,利用UPLC-ESI-串联质谱法(UPLC-ESI-tandem mass spectrometry,UPLC-ESI-MS/MS)对分离物质进行鉴定,使用UPLC-二极管阵列检测器(UPLCdiode array detector, UPLC-DAD)系统通过标准曲线法对单体纯度进行测定。
采用UPLC-串联三重四极杆飞行时间(UPLCtriple quadrupole-time of flight, UPLC-Triple-TOF)5600+液质联用仪进行质谱分析:正负离子扫描模式;扫描范围100~1 500m/z;雾化气1 和雾化气2均为379.2 kPa;气帘气241.3 kPa;离子源温度600 ℃(正),550 ℃(负);离子源电压5 500 V(正),4 500 V(负);一级扫描中,去簇电压100 V,聚焦电压10 V;二级扫描中,使用飞行时间质谱-一级预扫描和触发的二级扫描-信息依赖扫描离子积累模式(time of flight mass spectrometer-product ioninformation dependent acquisition, TOF MS-Product Ion-IDA)采集质谱数据,诱导碰撞解离(collisioninduced dissociation, CID)能量为(40±20)eV,进样前,用校正液传输系统(calibration delivery system,CDS)泵做质量轴校正,使质量轴误差小于2×10-6。
1.3.5 体外化学抗氧化能力评价
对从不同柑橘品种中分离纯化得到的分段产物和15 种单体进行化学抗氧化活性检测。根据本课题组前期报道的方法[18]进行并稍作修改。
1,1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl radical, DPPH)法:取2 μL 适当稀释(稀释后浓度如附表1 和附表2 所示,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2021.06.152)的分段产物及纯化单体溶液加到96孔板中,随后加入198 μL现配的60 μmol/L的DPPH溶液,在室温条件下避光反应2 h,用酶标仪测定其在517 nm波长下的吸光度,以6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2, 5, 7, 8-tetramethylchroman-2-carboxylic acid,Trolox)为对照作标准曲线,计算各品种分段产物及纯化单体对DPPH自由基的清除能力,抗氧化活性以水溶性维生素E当量来表示,试验重复3次。
铁离子还原抗氧化能力(ferric ion reducing antioxidant power,FRAP)法。FRAP工作液的配比:以适量双蒸水溶解无水乙酸钠(NaAc),再加入用乙酸调节pH 为3.6 的300 mmol/L 的NaAc 缓冲溶液、10 mmol/L 三吡啶基三嗪(tripyridyltriazine, TPTZ)溶液、20 mmol/L 的氯化铁(FeCl3)溶液,三者以10∶1∶1的体积比混合。取适当稀释(稀释后浓度如附表2 所示)的10 μL 分段产物及纯化单体溶液与90 μL FRAP工作液混合,加到96孔板中,在室温条件下避光反应5 min,用酶标仪测定其在593 nm 波长下的吸光度,以Trolox为对照作标准曲线,计算各品种分段产物及纯化单体对FRAP铁离子的还原能力,抗氧化活性以水溶性维生素E当量来表示,试验重复3次。
2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid),ABTS]法。ABTS 工作液的配比:将7 mmol/L 的ABTS 溶液和2.6 mmol/L 的过硫酸钾(K2S2O8)溶液按照1∶1 的体积比混合,在室温条件下避光反应12 h 后用磷酸盐缓冲液(phosphate buffered solution,PBS)稀释至D(734 nm)≈0.63 的ABTS 工作液。取适当稀释(稀释后浓度如附表1和附表2所示)的10 μL 分段产物及纯化单体溶液与200 μL ABTS 工作液混合,加到96 孔板中,在室温条件下避光反应5 min 后测定其在734 nm 波长下的吸光度,以Trolox 为对照作标准曲线,计算ABTS 自由基清除能力,抗氧化活性以水溶性维生素E当量来表示,试验重复3次。
氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)法:在96 孔板中加入25 μL 适当稀释(稀释后浓度如附表1和附表2所示)的分段产物及纯化单体溶液,再加入以PBS 溶解的150 μL 40 nmol/L 荧光素钠溶液,于37 ℃条件下避光反应10 min 后,加入25 μL 150 mmol/L 2,2′-偶氮(2-甲基丙基脒)二盐酸盐[2, 2′-azobis (2-methylpropionamidine)dihydrochloride,AAPH]溶液,测定荧光强度(激发波长485 nm,发射波长535 nm,读数间隔2 min,总时长2 h)。使用25 μL PBS 为阴性对照,以不含AAPH 的孔作为初始荧光值读数孔。以空白样品与样品之间荧光素钠衰减曲线下面积(area under the curve,AUC)的差异作为计算结果。其中第n次读数的相对荧光值(fn)=第n次荧光值(Fn)/初始荧光值(F0),AUC=2×(f0+f1+…+fn)-fn-f0,净面积(net AUC)=AUC样品-AUCAAPH+。以Trolox 为对照作标准曲线,计算ORAC 当量,抗氧化活性以水溶性维生素E当量来表示,试验重复3次。
1.3.6 数据处理与统计学分析
试验设置3个生物学重复,用SPSS 20.0软件进行数据分析,结果表示为平均值±标准差,使用GraphPad Prism 8.0软件作图。
2 结果与分析
2.1 固相萃取柱的动态试验结果
在固相萃取过程中,样品的上样体积主要由样品的浓度和萃取柱本身的吸附能力决定。根据各柑橘品种的类黄酮组分特征,最终确定‘胡柚’‘玉环文旦’‘伦晚脐橙’‘代代’‘瓯柑’‘椪柑’的最佳上样体积分别为10、12、14、6、12、14 BV。各品种分段产物用甲醇洗脱液洗脱的结果表明:分段产物Ⅰ的最佳洗脱浓度和洗脱体积分别为25%、4 BV,24%、6 BV,35%、4 BV,30%、5 BV,26%、5 BV,40%、6 BV;分段产物Ⅱ的最佳洗脱浓度分别为40%、40%、50%、40%、50%、45%,洗脱体积均为6 BV;分段产物Ⅲ的最佳洗脱浓度和洗脱体积均为80%、4 BV。
2.2 固相萃取柱的初步富集及半制备型HPLC的纯化结果
通过固相萃取柱的初步富集将各柑橘品种中的类黄酮均分为3 个分段产物,每一分段产物中的物质相对于粗提物的液相图而言较为集中,且3 个分段产物的回收率均在46.55%以上(图1~3)。
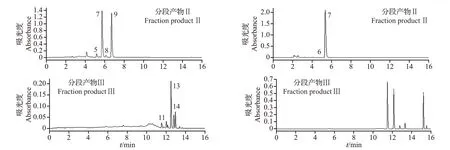
图1 ‘胡柚’‘玉环文旦’果皮的类黄酮提取物及其各分段产物液相色谱图Fig.1 Liquid chromatograms of the flavonoid extracts of ‘Huyou’ (HY) and ‘Yuhuan Wendan’ (YHWD) peels and their fraction products
利用半制备型HPLC对6个柑橘品种的各分段产物进一步纯化,按照出峰顺序收集流出液,于37 ℃条件下真空离心浓缩后得到粉末,进行UPLC检测。
2.3 不同品种柑橘果实的纯化物质鉴定及其纯度检测结果
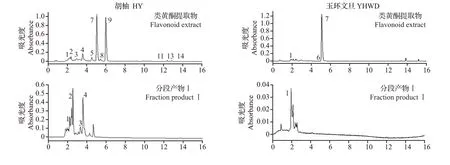

图2 ‘伦晚脐橙’‘代代’果皮的类黄酮提取物及其各分段产物液相色谱图Fig.2 Liquid chromatograms of the flavonoid extracts of ‘Luwan navel orange’ (LW) and ‘Daidai’ (DD) peels and their fraction products
通过UPLC图谱分析,由半制备型HPLC纯化后的单体可以通过出峰时间和紫外线(ultra violet,UV)吸收图谱进行初步判断,进一步通过UPLC-ESIMS/MS分析进行物质结构鉴定,结果如图4所示。
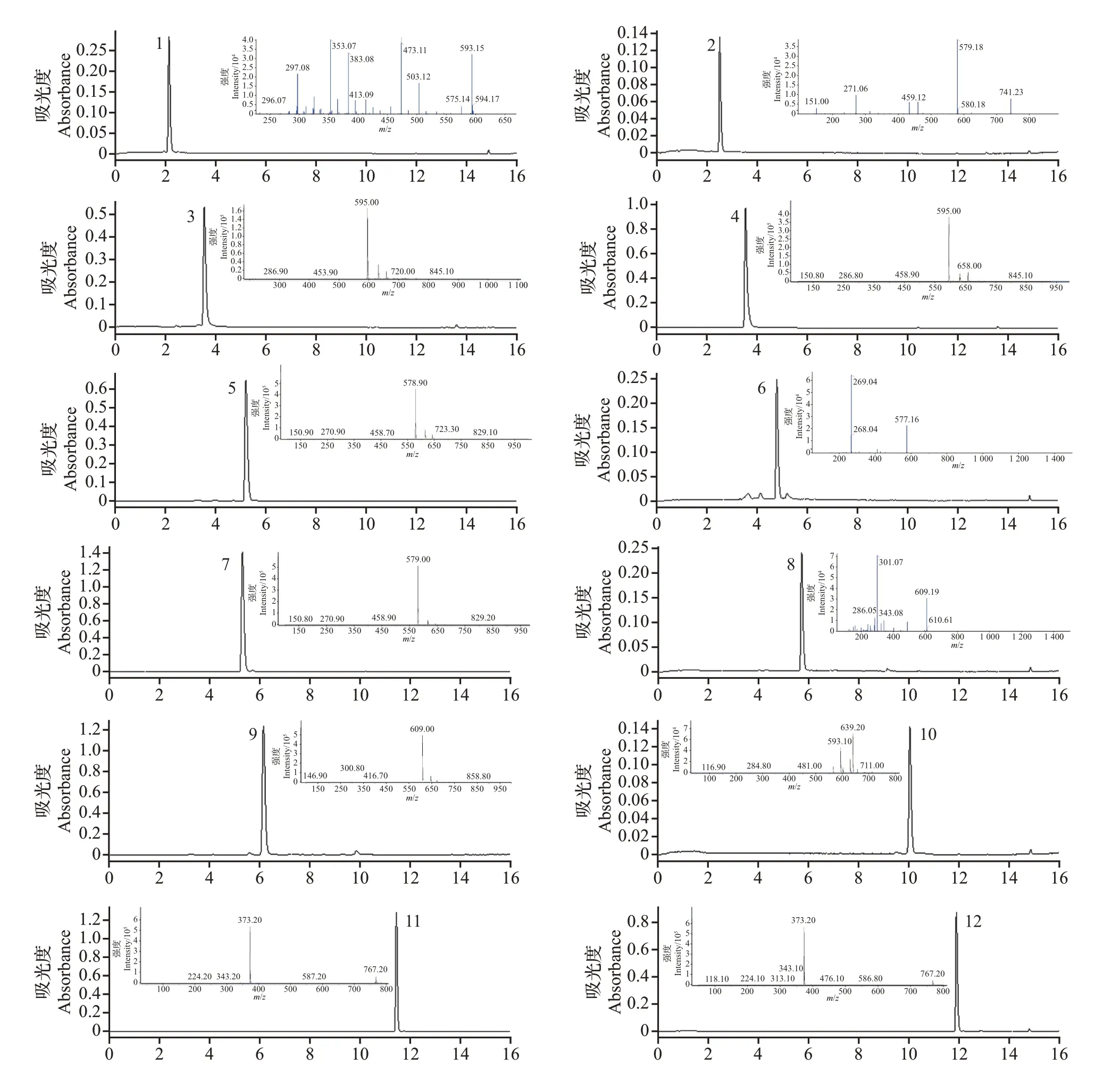
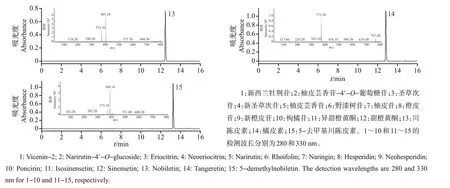
图4 利用半制备型HPLC纯化得到的15个单体的UPLC色谱图和UPLC-ESI-MS/MS质谱图Fig.4 UPLC chromatograms and UPLC-ESI-MS/MS spectra of 15 monomers purified by semi-preparative HPLC
峰1 的质荷比为593.15[M-H]-,在二级质谱片段中,503.12[M-H-C3H6O3]-、473.11[M-HC4H8O4]-、383.08[M-H-C3H6O3-C4H8O4]-为典型的离子碎片,这与新西兰牡荆苷的报道[19]相符。
峰2的质荷比为741.23[M-H]-,在二级质谱片段中,579.18[M-H-Glc]-、459.12[M-H-Glc-C8H8O]-离子碎片与柚皮芸香苷-4′-O-葡萄糖苷的报道[20]相符。

图3 ‘瓯柑’‘椪柑’果皮的类黄酮提取物及其各分段产物液相色谱图Fig.3 Liquid chromatograms of the flavonoid extracts of‘Ougan’(OG)and‘Ponkan’(PG)peels and their fraction products
峰3 的质荷比为595.00[M-H]-,具有典型的286.90[M-H-Rha-Glc]-离子碎片,与圣草次苷的报道[21]相符。
峰4 的质荷比为595.00[M-H]-,具有典型的150.80[M-H-Glc-Rha-C8H8O2]-、286.80[M-HRha-Glc]-、458.90[M-H-C8H8O2]-离子碎片,与新圣草次苷的特征碎片[20]相符。
峰5的质荷比为578.90[M-H]-,有458.70[MH-C8H8O]-、270.90[M-H-Rha-Glc]-、150.90[MH-Glc-Rha-C8H8O]-特征碎片,与柚皮芸香苷的报道[20]一致。
峰6 的质荷比为577.16[M-H]-,具有典型的268.04[M-H-Rha-Glc]-离子碎片,符合对野漆树苷的描述[20]。
峰7 的质荷比为579.00[M-H]-,具有458.90[M-H-C8H8O]-、150.80[M-H-Glc-Rha-C8H8O]-特征碎片,可确定为柚皮苷[22]。
峰8 的质荷比为609.19[M-H]-,具有301.07[M-H-Rha-Glc]-特征碎片,与橙皮苷的报道[21]相符。
峰9 的质荷比为609.00[M-H]-,具有300.80、146.90 特征峰的离子碎片,与新橙皮苷的报道[23]相符。
峰10 的质荷比为593.10[M-H]-,其具有的284.80[M-H-Rha-Glc]-、481.00特征峰的离子碎片与枸橘苷的报道[24]一致。
峰11 的质荷比为373.20[M+H]+,其具有的343.20 特征峰的离子碎片与异甜橙黄酮的报道[23]一致。
峰12 的质荷比为373.20[M+H]+,其具有的343.10、313.10 特征峰的离子碎片与甜橙黄酮的报道[23]一致。
峰13 的质荷比为403.10[M+H]+,具有373.10[M+H-2CH3]+特征碎片,可确定为川陈皮素[25]。
峰14 的质荷比为373.20[M+H]+,具有343.10[M+H-2CH3]+特征碎片,与橘皮素的报道[26]相符。
峰15 的质荷比为389.10[M+H]+,其具有的373.10[M+H-CH3]+特征碎片与5-去甲基川陈皮素的报道[25]相符。
使用UPLC 峰面积标准曲线法对15 种化合物进行纯度分析,从各品种中纯化出的单体纯度均可达到95%以上。其中:‘玉环文旦’中的特色物质为柚皮苷,最终纯度为99.56%,从该品种中纯化得到的新西兰牡荆苷、野漆树苷的最终纯度可达到98.72%、95.78%;从‘胡柚’中纯化得到的柚皮芸香苷-4′-O-葡萄糖苷、圣草次苷、新圣草次苷的纯度分别为98.42%、98.74%、99.17%;从‘伦晚脐橙’中得到的柚皮芸香苷的纯度为98.12%;从‘椪柑’中纯化得到的橙皮苷的纯度为98.00%。此外,研究发现,新橙皮苷在‘胡柚’和‘瓯柑’中均大量存在,但是在‘瓯柑’中由于其他物质的干扰较少,并且‘瓯柑’中存在大量的多甲氧基黄酮,所以选择从‘瓯柑’中纯化新橙皮苷、枸橘苷、异甜橙黄酮、甜橙黄酮、川陈皮素、橘皮素、5-去甲基川陈皮素,其纯度分别为98.56%、98.03%、98.76%、98.77%、99.15%、99.20%、97.63%。
2.4 不同品种柑橘果实的分段产物体外化学抗氧化能力测定结果
如图5所示,经过4种评价方法的测定,不同品种的类黄酮分段产物的抗氧化活性存在一定的差异性。

图5 不同柑橘品种分段产物的抗氧化活性评价Fig.5 Evaluation of antioxidant activities of fraction products of different citrus varieties
在对DPPH自由基清除能力方面,‘椪柑’和‘胡柚’分段产物Ⅰ和Ⅱ的自由基清除能力高于‘代代’‘瓯柑’‘玉环文旦’和‘伦晚脐橙’。其中‘椪柑’和‘胡柚’的分段产物Ⅰ自由基清除能力最强,分别为0.078 和0.077 g/g。同时,‘椪柑’和‘胡柚’分段产物Ⅱ的自由基清除能力显著强于除‘代代’分段产物Ⅰ外的其他各分段产物。在6 个品种中,各品种的分段产物Ⅰ的自由基清除能力均显著高于分段产物Ⅱ和分段产物Ⅲ。‘胡柚’‘伦晚脐橙’‘代代’‘瓯柑’和‘椪柑’的分段产物Ⅱ则强于分段产物Ⅲ。仅有‘玉环文旦’的分段产物Ⅲ的自由基清除能力强于分段产物Ⅱ,但仍然弱于分段产物Ⅰ。
对于FRAP,‘椪柑’分段产物Ⅰ(0.053 g/g)及‘胡柚’分段产物Ⅱ(0.053 g/g)表现出较强的铁离子还原能力;除此之外,‘胡柚’和‘代代’的分段产物Ⅰ的铁离子还原能力显著强于其他各分段产物。在‘伦晚脐橙’‘代代’和‘椪柑’3 个品种中,分段产物Ⅰ与分段产物Ⅱ的还原能力显著强于分段产物Ⅲ。在‘玉环文旦’和‘瓯柑’中,分段产物Ⅲ的铁离子还原能力强于分段产物Ⅱ,但均不如分段产物Ⅰ。
在对ABTS 自由基清除能力方面,‘瓯柑’分段产物Ⅱ(0.087 g/g)、‘椪柑’分段产物Ⅰ(0.085 g/g)与分段产物Ⅱ(0.084 g/g)表现出较强的抗氧化活性。在‘椪柑’和‘伦晚脐橙’2 个品种中,分段产物Ⅰ与分段产物Ⅱ间无明显差异,但均显著强于相应的分段产物Ⅲ。‘玉环文旦’的分段产物Ⅰ显著强于分段产物Ⅱ和分段产物Ⅲ。在‘胡柚’‘代代’和‘瓯柑’中,分段产物Ⅱ的自由基清除能力显著高于其分段产物Ⅰ和分段产物Ⅲ。其次,‘代代’的分段产物Ⅰ抗氧化活性较强,‘瓯柑’中则是分段产物Ⅲ较强,‘胡柚’的分段产物Ⅰ和分段产物Ⅲ间无明显差异。
对于ORAC,各柑橘品种表现的抗氧化活性与上述3 种方法差别较大。抗氧化能力较强的为‘瓯柑’分段产物Ⅲ(5.816 g/g)、‘胡柚’分段产物Ⅲ(5.642 g/g)、‘胡柚’分段产物Ⅱ(5.632 g/g)、‘代代’分段产物Ⅲ(5.363 g/g)及‘瓯柑’分段产物Ⅱ(5.251 g/g);除‘椪柑’外,各品种的抗氧化活性最强的为分段产物Ⅲ,其次为分段产物Ⅱ,最弱的为分段产物Ⅰ。在‘椪柑’中,分段产物Ⅱ的抗氧化活性最强,分段产物Ⅲ最弱。
为了综合评价各柑橘品种不同分段产物的抗氧化能力,本试验采用综合抗氧化能力(antioxidant potency composite,APC)指数来进行评定。APC 指数=(该方法测定值/该方法测定最大值)×100%,最终使用的APC 指数为4 种抗氧化方法APC 指数得分的平均值。6个柑橘品种的分段产物的APC指数如表2所示,18个分段产物的抗氧化APC指数整体变化范围在22.47%~93.47%之间。其中,抗氧化能力较强的为‘胡柚’分段产物Ⅱ(APC 综合指数为93.47%)、‘椪柑’分段产物Ⅰ(APC 综合指数为92.12%)、‘椪柑’分段产物Ⅱ(APC 综合指数为90.00%)、‘胡柚’分段产物Ⅰ(APC 综合指数为86.71%)。除‘玉环文旦’和‘胡柚’外,其余柑橘品种的分段产物Ⅰ和分段产物Ⅱ的APC指数相近,均高于分段产物Ⅲ。‘玉环文旦’中分段产物Ⅰ的抗氧化能力最强,分段产物Ⅱ的抗氧化能力最弱,而‘胡柚’中抗氧化能力表现为分段产物Ⅱ>分段产物Ⅰ>分段产物Ⅲ。
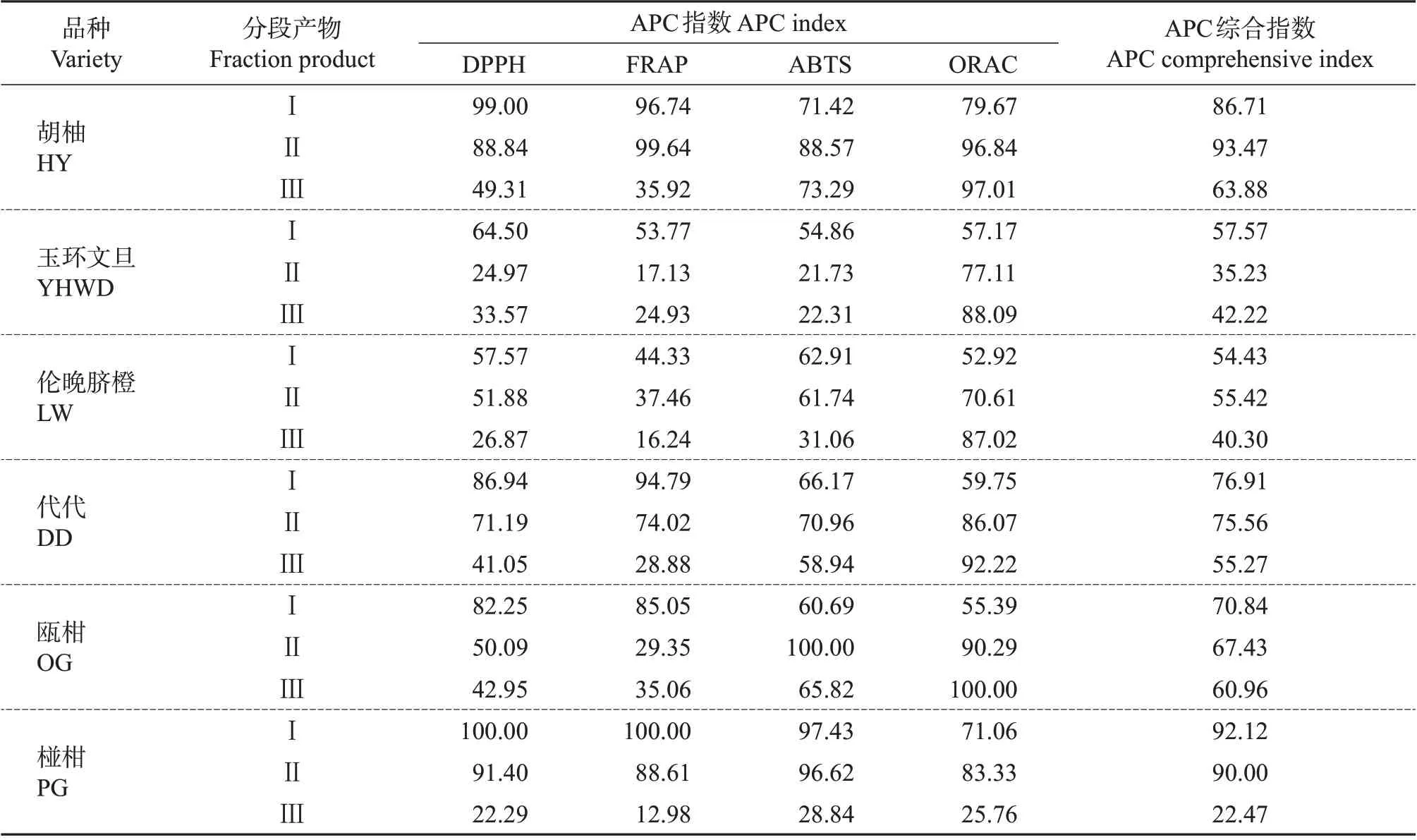
表2 不同柑橘品种分段产物抗氧化活性的APC指数Table 2 APC indexes of antioxidant activities of fraction products of different citrus varieties%
2.5 不同品种柑橘果实的纯化单体体外化学抗氧化能力测定结果
对不同柑橘品种的分段产物进行抗氧化活性测定后发现,各品种的分段产物Ⅰ和分段产物Ⅱ抗氧化活性较强,分段产物Ⅲ的主要活性物质成分为多甲氧基黄酮,其自由基清除能力和铁离子还原能力相对较弱。为了进一步探究各分段产物中所含成分的抗氧化能力,本试验对从各个品种中分离纯化得到的单体进行抗氧化活性检测,结果如图6 所示。在DPPH 和FRAP 方法中,抗氧化能力最强的均为圣草次苷和新圣草次苷,其次为橙皮苷和新橙皮苷;在ABTS方法中,新圣草次苷(2.04 g/g)、圣草次苷(0.38 g/g)及新橙皮苷(0.24 g/g)的抗氧化能力显著强于其他物质;在ORAC 方法中,抗氧化能力排序为橙皮苷(4.82 g/g)>圣草次苷(4.58 g/g)>新圣草次苷(4.50 g/g)>新西兰牡荆苷(4.02 g/g)>野漆树苷(4.00 g/g)。对4种方法进行综合比较发现:抗氧化能力较强的多为黄烷酮类化合物,而多甲氧基黄酮的抗氧化能力较弱;但是在FRAP 及ABTS的测定方法中,5-去甲基川陈皮素的值高于其他的多甲氧基黄酮及大多数黄烷酮的值。

图6 不同柑橘品种纯化单体的抗氧化活性评价Fig.6 Evaluation of antioxidant activities of purified monomers of different citrus varieties
同样,本试验通过计算抗氧化活性APC指数来综合评价纯化单体的抗氧化能力,结果如表3所示。在15 种纯化单体中,新圣草次苷(APC 综合指数为93.52%)、圣草次苷(APC综合指数为78.43%)、橙皮苷(APC综合指数为29.47%)3种黄烷酮类物质抗氧化能力较强。在其余的纯化单体中,APC综合指数范围在5%~25%之间的有8种物质,包括2种黄酮、5种黄烷酮及1种多甲氧基黄酮,剩余4种多甲氧基黄酮的抗氧化活性则较弱。
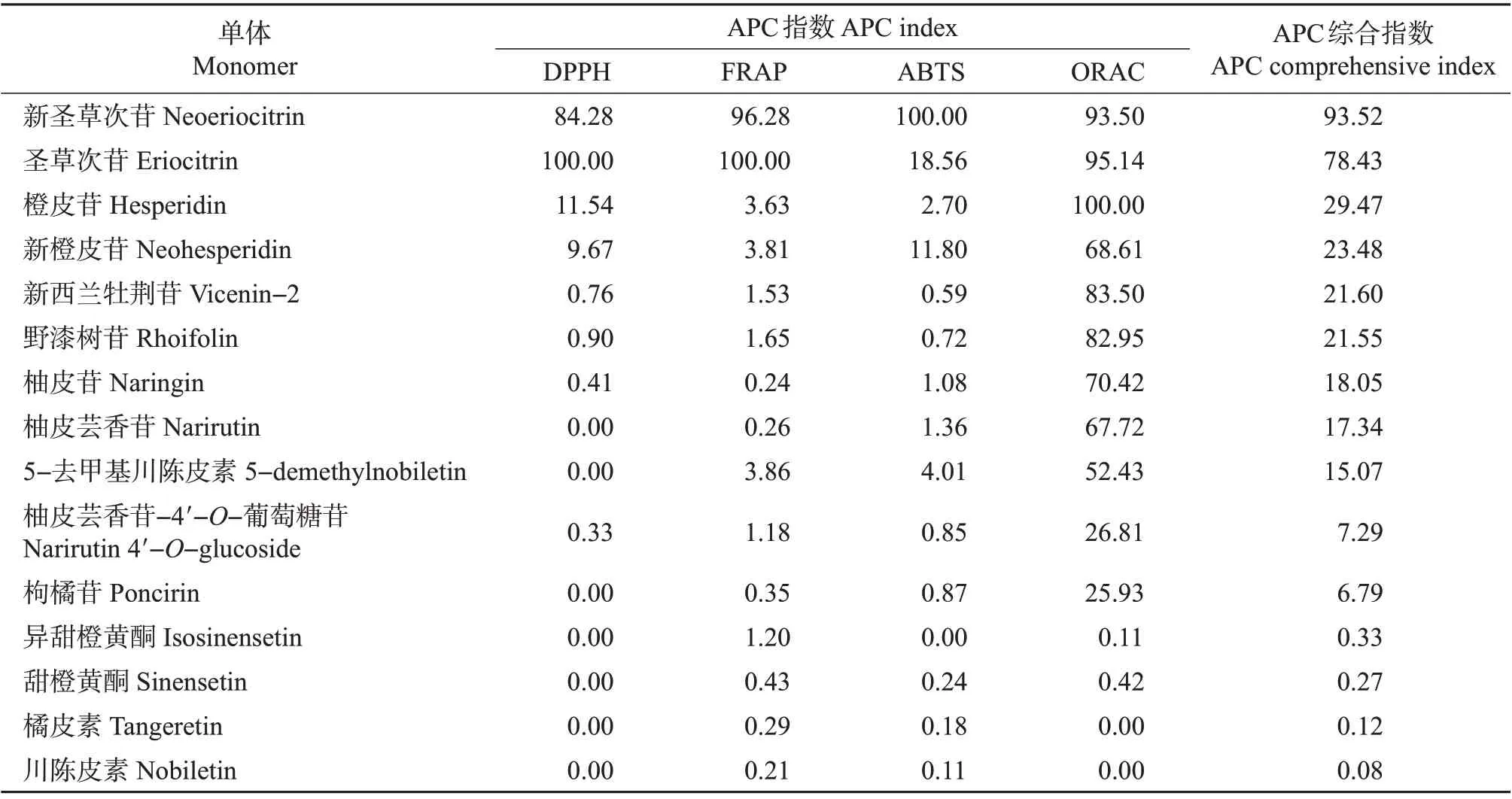
表3 不同柑橘品种纯化单体的抗氧化活性APC指数Table 3 APC indexes of antioxidant activities of purified monomers of different citrus varieties%
3 讨论
3.1 不同品种柑橘果实中类黄酮的分离纯化
根据类黄酮在不同柑橘品种中的分布特征,本研究采取“分段富集和逐一纯化”的策略,建立了具有针对性的分离纯化体系。分段富集是对单体分离纯化的预处理,有利于后续纯化实验的参数选择,并有利于缩短总体分离和纯化的时间。在前人的分离纯化研究中,研究者利用HPD100 型树脂与制备型高效液相色谱联用技术,从‘大红袍’红橘中纯化出5 种纯度均在95%以上的多甲氧基黄酮单体,总纯化时间超过10 h,并消耗大量有机试剂[27]。而本研究采用固相萃取代替树脂进行前处理,整体分离纯化时间仅需要5~6 h,不仅缩短了富集时间,也便于进行多种类黄酮的纯化。针对类黄酮分段富集产物,本研究建立的基于半制备型高效液相色谱技术的柑橘果实的类黄酮单体分离纯化体系,从6个柑橘品种的分段富集产物中共分离纯化得到15种单体,其中有4 种单体首次从柑橘果实中分离纯化得到,分别是从柚类果实中纯化得到的新西兰牡荆苷,从葡萄柚品种中纯化得到的柚皮芸香苷-4′-O-葡萄糖苷和圣草次苷,以及从柑类品种中纯化得到的异甜橙黄酮。
3.2 不同品种柑橘果实的分段产物及纯化单体的化学抗氧化能力评价
本研究发现,富含黄酮和黄烷酮的分段产物的化学抗氧化能力强于富含多甲氧基黄酮的分段产物。在15种单体中,抗氧化能力较强的依次为新圣草次苷、圣草次苷、橙皮苷及新橙皮苷,而川陈皮素、橘皮素等抗氧化能力较弱。化学抗氧化能力与类黄酮的结构密切相关:首先,当其具有大量的酚羟基时,与自由基结合可提供活泼的氢,形成更加稳定的酚类自由基,继而打断链式反应;其次,在一定条件下,类黄酮的邻位酚羟基与金属离子螯合,进而抑制脂质过氧化发生。前人研究表明,类黄酮的抗氧化活性不仅与酚羟基的数量和取代位置有关,也与C环上2、3位双键的有无有关[28],这也证实了本研究纯化单体中的新西兰牡荆苷和野漆树苷2种黄酮也具有一定的抗氧化能力的结论。川陈皮素等多甲氧基黄酮的结构特点是苯环上的羟基高度甲氧基化,酚羟基较少,从而导致其体外化学抗氧化活性较差,这可能与其分子平面结构与亲脂性被改变有关。然而,5-去甲基川陈皮素的抗氧化活性强于大多数的多甲氧基黄酮,与其他多甲氧基黄酮相比,其5位的酚羟基可能发挥了主要作用。
柑橘果实的类黄酮分段产物及单体在不同的评价体系下发挥着不同的抗氧化效果。柑橘类黄酮对DPPH 和ABTS 自由基的清除能力相似,而对ORAC抗氧化能力具有一定的差异。前2种方法中抗氧化能力较强的分段产物Ⅰ在ORAC 的抗氧化评价体系中表现出了较低水平,这可能是由于ORAC 的评价方法更偏重于水溶性物质,样品的溶解度对试验结果存在一定的影响。前人研究中也发现了相似结果[15],说明不同评价方法对抗氧化能力指标会产生不同的影响。
4 结论
本研究利用超声波辅助提取、固相萃取与半制备型HPLC 相结合的方式,建立了从不同柑橘品种中分离纯化其主要类黄酮的体系。利用固相萃取完成了柑橘类黄酮粗提物中黄酮组分(分段产物Ⅰ)、黄烷酮组分(分段产物Ⅱ)和多甲氧基黄酮组分(分段产物Ⅲ)的富集。利用半制备型HPLC从各分段产物中纯化得到了纯度高于95%的2种黄酮(新西兰牡荆苷、野漆树苷)、8 种黄烷酮(柚皮芸香苷-4′-O-葡萄糖苷、圣草次苷、新圣草次苷、柚皮苷、柚皮芸香苷、橙皮苷、新橙皮苷、枸橘苷)及5 种多甲氧基黄酮(异甜橙黄酮、甜橙黄酮、川陈皮素、橘皮素、5-去甲基川陈皮素)。但此分离体系仍然存在回收率较低的问题,如何在保证纯度的同时提高单体的回收率尚待进一步研究。
柑橘类黄酮的化学抗氧化能力与其结构有关。各柑橘品种的不同分段产物及单体间的抗氧化活性差异较大,黄酮及黄烷酮分段产物的化学抗氧化能力强于富含多甲氧基黄酮的分段产物。纯化单体中,新圣草次苷、圣草次苷、橙皮苷及新橙皮苷的化学抗氧化能力较强,川陈皮素和橘皮素的化学抗氧化能力较弱。关于柑橘类黄酮的抗氧化构效关系及作用机制有待通过细胞或动物模型深入探索,同时,类黄酮单体之间是否存在协同或拮抗关系及其在体内的效应是否相同也有待进一步研究。

