METTL10表达下调与足细胞损伤的关系
包继文,李子扬,尧欢珍,吴 蓓,周文彦,顾乐怡,王 玲
上海交通大学医学院附属仁济医院肾脏内科,上海 200127
慢性肾脏病(chronic kidney disease,CKD)是全球卫生保健中的一个重要问题。据统计,全球有超过10%的人口受到该病影响,其发病率逐年上升,容易进展到终末期肾脏病(end stage kidney disease,ESRD),导致远期疗效较差,并且医疗费用高昂[1]。蛋白尿是CKD早期常见标志[2]。足细胞损伤不仅与蛋白尿的严重程度有关,而且还与肾小球硬化发生、发展以及肾功能下降有关[3-4],是多种肾小球疾病的关键驱动因子,包括微小病变、局灶节段性肾小球硬化和糖尿病肾病等[5-7]。
足细胞是终末分化的肾小球脏层上皮细胞,在肾小球滤过屏障功能的维持中发挥重要作用。足细胞结构以黏着斑和裂隙膜为核心,调控其自身的形态和功能。足细胞的肌动蛋白细胞骨架相互联系紧密,使其能适应外界环境变化,以维持肾小球滤过屏障的完整性[8]。Nephrin、synaptpodin、podocin和Wilms’tumor 1(WT1)等蛋白既是足细胞的特异性标志物,同时也在足细胞肌动蛋白细胞骨架的调控中发挥各种关键的调控作用[9-11]。然而,足细胞损伤机制十分复杂。探索足细胞损伤过程中可能存在的新的分子及其作用机制,对于临床上诊断和治疗蛋白尿、各种肾小球疾病以及预防CKD的进展等均有重要意义。
随着科学技术的迅猛发展,生物信息学已经作为一种强大的工具,为疾病分子机制的研究提供了更为全面的视角,并且可以发现疾病潜在的生物标志物和治疗靶点[12-13]。在肾脏病领域中,有学者通过对信号通路进行全面生物信息学分析和验证实验,发现3个全新的因子,包括AHR、GRHL2和KIAA0101,可以作为透明细胞肾细胞癌潜在的生物标志物[13]。有研究通过对胰岛素敏感-足细胞组和胰岛素抵抗-足细胞组的转录组学分析,发现了一个可能参与蛋白尿相关肾脏病调控的全新基因NPY,抑制其参与的信号通路可能是未来的研究方向[14]。因此,生物信息学分析对肾脏病研究具有重要价值。
本研究通过对足细胞损伤相关芯片数据进行分析,识别足细胞损伤中的差异表达基因(differentially expressed genes,DEGs),并且对其中一个基因进行蛋白水平的验证。
1 对象与方法
1.1 足细胞损伤相关m RNA芯片数据处理及分析
从NCBI_GBO数据库(https://www.ncbi.nlm.nih.gov/gds)中下载一个足细胞损伤相关RNA芯片数据,数据集为GSE108629,其中包括了4例正常足细胞样本(正常足细胞组)和4例损伤足细胞样本(损伤足细胞组),通过主成分分析和箱线图对数据集的质量以及样本的分组情况进行控制,将芯片数据转化成表达量度。采用limma软件包和affy软件包对质控后的RNA表达谱进行组间DEGs分析。对基因表达倍数变化(fold change,FC)进行log2转换,以符合|log FC|≥2并且校正P值(q值)<0.05 作为筛选DEGs的基本条件。
1.2 主要试剂与仪器
阿 霉 素(adriamycin,ADR)(Sigma-Aldrich,美国),低温高速离心机(Eppendorf,德国),倒置荧光显微镜(ZEISS,Axio Vert A1,德国),Western blotting图像分析系统(上海天能科技有限公司,中国)。
1.3 临床样本研究
1.3.1 研究样本收集 收集2015年3月至2020年3月在上海交通大学医学院附属仁济医院进行肾活检的大量蛋白尿患者(大量蛋白尿组)。纳入标准:年龄≥18岁;24 h尿蛋白总量>3.5 g;肾活检病理结果为局灶节段性肾小球硬化或者微小病变。排除继发于其他因素的肾小球肾炎患者。
对照组为同期在该院因“血尿”或者“泡沫尿”而坚持行肾活检,尿常规检测结果为尿蛋白阴性或者24 h尿蛋白总量<1 g,且肾活检病理结果为病变轻微或者良性肾小动脉硬化症的患者。
收集患者基本信息,包括姓名、年龄、性别、身高、体质量、血压、既往疾病史和用药史等信息;患者实验室检测项目包括尿常规、肾功能、24 h尿蛋白。研究获得医院伦理委员会批准(仁济伦审[2017]084号),研究对象均签署知情同意书。
1.3.2 免疫荧光染色 石蜡切片脱蜡处理后,高温加热进行抗原修复,封闭1 h后,一抗4℃孵育过夜;次日荧光二抗常温避光孵育1 h,DAPI染细胞核。使用的抗体分别 为METTL10抗 体(1∶100,Biorbyt,美 国)、podocalyxin抗体(1∶1 000,Proteintech,中国)。
1.4 动物实验
1.4.1 阿霉素诱导小鼠肾病模型BAL/BC小鼠(雄性,6~8周龄,体质量20~22 g),购自北京斯贝福生物技术有限公司[生产许可证号为SCXK(京)2019-0020,使用许可证号为SYXK(沪)2016-0009]。所有实验小鼠均在SPF级别动物房内饲养,随机将小鼠分为2组:对照组(n=6)和阿霉素(adriamycin,ADR)处理组(n=6);ADR处理组按照10mg/kg尾静脉注射ADR诱导肾病模型,对照组尾静脉注射等体积PBS。分别在注射前(Day0)和注射14 d(Day14)时用代谢笼收集小鼠24 h尿液,于第15日处死小鼠,收集小鼠肾脏组织标本。
1.4.2 尿液白蛋白与肌酐检测 采用白蛋白和肌酐检测试剂盒(南京建成,中国),检测小鼠24 h尿液白蛋白与肌酐含量,计算尿白蛋白肌酐比值(urinary album in creatinine ratio,UACR)。
1.4.3 组织蛋白免疫印迹检测 提取小鼠肾皮质组织总蛋白,加蛋白样品至10%SDS-PAGE凝胶中分离,250mA恒流转膜70min,PVDF膜常温封闭1 h,一抗4℃孵育过夜,二抗常温孵育1 h,滴加ECL化学发光液进行条带显影。使用的抗体如下:METTL10抗体(Thermo Fisher Scientific,美国;1∶500),nephrin抗体(Abcam,美国;1∶200),synatopodin抗体(Proteintech,中国;1∶500),WT1抗体(Proteintech,中国;1∶500),podocin抗体(Proteintech,中国;1∶500),tubulin抗体(Beyotime,中国;1∶1 000),GAPDH抗体(Beyotime,中国;1∶1 000)。
1.5 统计学分析
采用SPSS 23.0 与GraphPad Prism7.0 软件进行统计学分析。其中,正态分布的定量资料采用xˉ±s表示,非正态分布的定量资料采用中位数(四分位数间距)表示;2组间样本均数的比较采用两样本独立t检验,双侧P<0.05 表示差异具有统计学意义。
2 结果
2.1 足细胞损伤模型中总DEGs分析
与正常足细胞组样本相比,在损伤足细胞组样本中共有5 353个DEGs(图1),其中有3 402个基因显著上调,1951个基因显著下调。图2展示了前50个DEGs。其中,与正常足细胞组比较,METTL10在足细胞损伤组中显著下调,差异具有统计学意义(P=0.013),见图3。

图1 足细胞损伤中的DEGs火山图Fig 1 Identification of DEGs in injured podocytes shown by the volcanoplot

图2 足细胞损伤中前50个差异表达基因聚类热图Fig 2 Heatmap for the top50 of DEGs in injured podocytes

图3 METTL10m RNA在足细胞损伤中的表达变化Fig 3 Changes of METTL10 mRNA level in damaged podocytes
2.2 大量蛋白尿患者肾小球组织中METTL10的表达
共纳入3例大量蛋白尿患者及3例对照者。对照组患者的年龄、性别、血压、血清肌酐(serum creatinine,Scr)、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)均与大量蛋白尿组匹配(均P>0.05);与对照组比较,大量蛋白尿组患者24 h尿蛋白含量显著升高,差异具有统计学意义(P=0.012),见表1。免疫荧光检测结果显示:METTL10在人体正常肾小球组织中表达,METTL10与足细胞标志物podocalyxin存在共定位;与对照组比较,METTL10在大量蛋白尿患者肾小球组织中的表达明显下降(图4)。

表1 大量蛋白尿组和对照组的人口学及基线资料Tab 1 Demographic and baseline characteristics of control group and patients with massive proteinuria

图4 免疫荧光染色检测患者肾小球组织中METTL10的表达(×400)Fig 4 Immunofluorescence staining for detection of METTL10 expression in glomerula(×400)
2.3 METTL10在ADR诱导肾病小鼠模型中的表达
经ADR或PBS尾静脉注射后,2组小鼠UACR的变化见图5。对照组小鼠Day0和Day14的UACR比较,差异无统计学意义;ADR处理组小鼠Day14的UACR较对照组显著升高,差异具有统计学意义(P=0.005)。
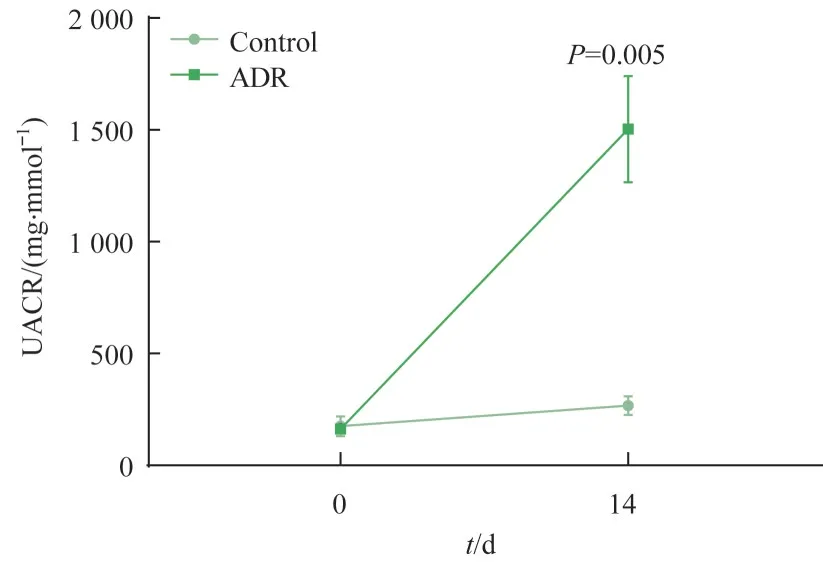
图5 2组小鼠UACR的变化Fig 5 Change of UACR in the two groups
ADR处理组小鼠肾脏组织synaptopodin、nephrin、podocin、WT1蛋白水平与对照组比较均显著下降,差异具有统计学意义(均P<0.05),见图6。免疫印迹法检测结果显示,METTL10蛋白在ADR处理组小鼠肾脏组织中的表达水平显著低于对照组(P=0.001),见图7。
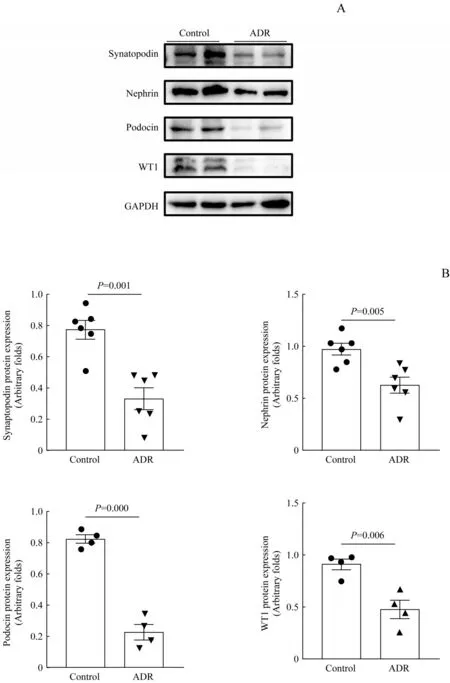
图6 小鼠肾脏组织足细胞标志物蛋白的表达(n=6)Fig 6 Expression of podocyte markers in kidney tissue of mice(n=6)
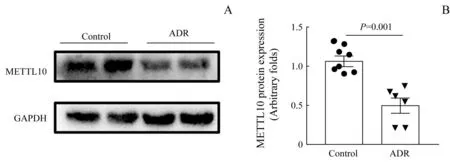
图7 小鼠肾脏组织中METTL10蛋白表达(n=6)Fig 7 Expression of METTL10 protein in kidney tissue of mice(n=6)
3 讨论
METTL10,也被命名为EEF1AKMT2,是真核细胞翻译延长因子A1(eukaryotic translation elongation factor,eEF1A1)在赖氨酸318位点的三甲基转移酶[15-17]。在一项关于CKD人群的全基因组关联分析(genome-wide association study,GWAS)中,通过细胞谱系的RNA序列分析,发现在正常小鼠肾脏的各个细胞类型中,METTL10在足细胞中的表达显著高于集合管、远端小管、近端小管等其他肾脏细胞类型[18]。综上,我们推测METTL10可能参与足细胞结构和功能的调控,在本研究中将METTL10筛选为目的基因。
本研究中,通过对GEO数据库中的一个足细胞损伤模型芯片数据的生物信息学分析,发现了众多差异表达基因,这些基因可能通过不同的生物学功能和信号通路在足细胞损伤中发挥各自的作用。我们从中筛选出了METTL10基因,同时也对筛选出的总差异表达基因进行了KEGG通路富集分析(结果未列出)。以所富集到的前15条信号通路结果为例,其中有7条信号通路(MAPK信号通路、PI3K-AKT信号通路、细胞骨架肌动蛋白调控、细胞黏附、肿瘤坏死因子信号通路、Toll样受体信号通路以及细胞因子-细胞因子受体相互作用),在目前足细胞病的相关机制中均发挥重要作用。MAPK通路参与调控足细胞凋亡,通过阻断MAPK通路可以减轻足细胞损伤[19];活化的PI3K-AKT信号通路参与调控足细胞自噬,自噬受损诱导足细胞损伤,参与糖尿病肾病及其他肾脏疾病的发生[11];足细胞参与肾小球滤过的功能依赖于其细胞骨架肌动蛋白的调控,细胞黏附则是维持足细胞骨架动力学的重要通路之一,该过程失调会导致蛋白尿发生[11];其余通路与心肌病、癌症或病毒感染有关。然而,通过本次生物信息学分析,尚未发现METTL10富集的相关信号通路。可能是由于本研究仅收集并分析了一个数据集,结果具有一定局限性。目前,关于肾病的生物信息学分析更常见的是收集多个数据集,整合性分析差异基因表达。例如,一项关于CKD诊断标志物的研究[21],通过收集多个CKD相关数据集,并按照肾小球组织和肾小管间质来源分类,同时与患者各项临床特征相联系,分别分析相应的差异基因表达以及功能模块等,分析内容更为全面和丰富。关于METTL10可能参与的信号通路,将进一步在细胞学实验中加以探索和验证。
本研究进一步对临床患者的肾活检标本进行免疫荧光染色,结果提示METTL10在人正常肾小球组织表达,且与足细胞标志物podocalyxin共染阳性,提示了METTL10在足细胞中存在特异性表达。这一现象也与相关研究[18]所述METTL10在健康小鼠肾脏足细胞中高表达的结果相符合。因而,我们推测METTL10可能与足细胞的结构和功能有关。免疫荧光染色结果还初步提示了在大量蛋白尿患者肾小球中METTL10表达下调。本研究中蛋白尿患者肾组织病理类型为局灶节段性肾小球硬化或微小病变。局灶节段性肾小球硬化作为临床上难治性肾病综合征常见的病理分型,多表现为激素治疗耐药或药物依赖,严重者会进展到不可逆的终末期肾脏病[22]。有研究表明,局灶节段性肾小球硬化的严重程度和疗效均与足细胞受损密不可分,保护足细胞是治疗局灶节段性肾小球硬化的关键;足细胞损伤是蛋白尿产生的重要环节[7]。因此,我们推测METTL10可能与蛋白尿发生和发展有关,并且提示在足细胞损伤时METTLE表达下调。
成年人肾脏中的每个肾小球结构中有500~600个足细胞[23]。足细胞作为高度分化的上皮细胞,增殖能力有限,成熟的足细胞无法进行完整的有丝分裂。损伤刺激所致的足细胞破坏,包括细胞凋亡、细胞自噬受损、细胞有丝分裂障碍(足细胞重新进入细胞周期,但有丝分裂不完全,致细胞死亡)等都可以导致足细胞数量减少,进而促使肾小球硬化的发生和发展[24]。在结构方面,各种损伤刺激最终导致足细胞损伤的共同特点是足细胞骨架蛋白系统失调,足突回缩[25]。
本研究进一步在ADR诱导小鼠肾病模型中检测到METTL10的表达下调,这与芯片数据分析和蛋白尿患者标本检测结果相一致。同时,伴随着几个重要的足细胞标志物蛋白的表达下降,其中synaptopodin是使紧密相接的足细胞骨架蛋白得以保持稳定的重要调控分子[9];nephrin和podocin是足细胞裂隙膜结构的重要成分,裂隙膜不仅在结构上作为滤过屏障阻止蛋白尿发生,还是足细胞应对各种应激的重要信号中心[10];WT1作为一个重要的转录因子,除了可以通过调控下游分子包括nephrin、podocin、Neph3等裂隙膜相关蛋白分子表达,同时也在足细胞的分化过程中扮演重要角色[11]。考虑到ADR可以同时诱导小鼠肾小球中METTL10蛋白与这几种重要的足细胞蛋白表达下降,虽然尚未确定两者之间的因果关系,仍可以得出初步结论,即METTL10表达下调有可能与足细胞损伤有关。
尽管METTL10调控eEF1A1的甲基化修饰作用尚不明确,但现有许多研究表明METTL10的底物eEF1A 1通过与肌动蛋白细胞骨架相互作用,调控蛋白翻译过程,同时也调控肌动蛋白细胞骨架动力学[26-28]。在今后研究中可以关注足细胞的METTL10是否参与其细胞骨架结构调控。有研究发现METTL10参与真核细胞的细胞周期相关蛋白的磷酸化修饰[17];也有研究提出ADR可以诱导足细胞重新进入细胞周期,进而异常的有丝分裂导致非典型的细胞死亡[29]。我们将在后续研究中通过体外实验,调控足细胞中的METTL10基因表达,构建足细胞损伤体外模型,进一步研究METTL10与足细胞的细胞周期调控之间的可能联系,从而进一步揭示METTL10在足细胞损伤中可能的调控作用及其机制。
综上,本研究初步发现了METTL10表达下调可能与蛋白尿发生及足细胞损伤有关,该结论为今后探索足细胞损伤的分子机制提供新的线索。
参·考·文·献
[1]Eckardt K U,Coresh J,Devuyst O,et al.Evolving importance of kidney disease:from subspecialty to global health burden[J].Lancet,2013,382(9887):158-169.
[2]Guo Y,Pace J,Li Z,et al.Podocyte-specific induction of Krüppel-like factor 15 restores differentiation markers and attenuates kidney injury in proteinuric kidney disease[J].J Am Soc Nephrol,2018,29(10):2529-2545.
[3]Zhou LT,Cao YH,Lv LL,et al.Feature selection and classification of urinary mRNA microarray data by iterative random forest to diagnose renal fibrosis:a two-stage study[J].Sci Rep,2017,7:39832.
[4]Cechova S,Dong F,Chan F,et al.MYH9 E1841K mutation augments proteinuria and podocyte injury and migration[J].J Am Soc Nephrol,2018,29(1):155-167.
[5]Yamamoto-Nonaka K,Koike M,Asanuma K,et al.Cathepsin D in podocytes is important in the pathogenesis of proteinuria and CKD[J].J Am Soc Nephrol,2016,27(9):2685-2700.
[6]Kriz W,Lemley KV.A potential role for mechanical forces in the detachment of podocytes and the progression of CKD[J].J Am Soc Nephrol,2015,26(2):258-269.
[7]Nagata M.Podocyte injury and its consequences[J].Kidney Int,2016,89(6):1221-1230.
[8]Perico L,Conti S,Benigni A,et al.Podocyte-actin dynamics in health and disease[J].Nat Rev Nephrol,2016,12(11):692-710.
[9]Blaine J,Dylewski J.Regulation of the actin cytoskeleton in podocytes[J].Cells,2020,9(7):1700.
[10]Torban E,Braun F,Wanner N,et al.From podocyte biology to novel cures for glomerular disease[J].Kidney Int,2019,96(4):850-861.
[11]Yu SM,Nissaisorakarn P,Husain I,et al.Proteinuric kidney diseases:a podocyte's slit diaphragm and cytoskeleton approach[J].Front Med(Lausanne),2018,5:221.
[12]Wang WN,Zhang W L,Zhou GY,et al.Prediction of the molecular mechanisms and potential therapeutic targets for diabetic nephropathy by bioinformatics methods[J].Int J Mol Med,2016,37(5):1181-1188.
[13]Butz H,Szabó PM,Nofech-Mozes R,et al.Integrative bioinformatics analysis reveals new prognostic biomarkers of clear cell renal cell carcinoma[J].Clin Chem,2014,60(10):1314-1326.
[14]Lay AC,Barrington AF,Hurcombe JA,et al.A role for NPY-NPY2R signaling in albuminuric kidney disease[J].Proc Natl Acad Sci U S A,2020,117(27):15862-15873.
[15]Falnes PØ,Jakobsson ME,Davydova E,et al.Protein lysine methylation by seven-β-strand methyltransferases[J].Biochem J,2016,473(14):1995-2009.
[16]Li Z,Gonzalez PA,Sasvari Z,et al.Methylation of translation elongation factor 1A by the METTL10-like See1 methyltransferase facilitates tombusvirus replication in yeast and plants[J].Virology,2014,448:43-54.
[17]Lipson RS,Webb KJ,Clarke SG.Two novel methyltransferases acting upon eukaryotic elongation factor 1A in Saccharomyces cerevisiae[J].Arch Biochem Biophys,2010,500(2):137-143.
[18]Hellwege JN,Velez ED,Giri A,et al.Mapping eGFR loci to the renal transcriptome and phenome in the VA Million Veteran Program[J].Nat Commun,2019,10(1):3842.
[19]Rane MJ,Zhao Y,Cai L.Krϋppel-like factors(KLFs)in renal physiology and disease[J].EBioMedicine,2019,40:743-750.
[20]卢甜美,杜玄一.足细胞损伤机制研究进展[J].现代医学,2017,45(2):311-314.
[21]Zhou LT,Qiu S,Lv LL,et al.Integrative bioinformatics analysis provides insight into the molecular mechanisms of chronic kidney disease[J].Kidney Blood Press Res,2018,43(2):568-581.
[22]尚懿纯,曹式丽,窦一田,等.局灶节段性肾小球硬化足细胞损伤生物标志物的研究进展[J].安徽医科大学学报,2017,52(1):151-154.
[23]Jefferson JA,Shankland SJ.The pathogenesis of focal segmental glomerulosclerosis[J].Adv Chronic Kidney Dis,2014,21(5):408-416.
[24]Liapis H,Romagnani P,Anders HJ.New insights into the pathology of podocyte loss:mitotic catastrophe[J].Am J Pathol,2013,183(5):1364-1374.
[25]Garg P.A review of podocyte biology[J].Am J Nephrol,2018,47 Suppl 1:3-13.
[26]Akram Z,Ahmed I,Mack H,et al.Yeast as a model to understand actinmediated cellular functions in mammals-illustrated with four actin cytoskeleton proteins[J].Cells,2020,9(3):672.
[27]Snape N,Li D,Wei T,et al.The eukaryotic translation elongation factor 1A regulation of actin stress fibers is important for infectious RSV production[J].Virol J,2018,15(1):182.
[28]Gross SR.Actin binding proteins:their ups and downs in metastatic life[J].Cell Adh Migr,2013,7(2):199-213.
[29]Li F,Mao X,Zhuang Q,et al.Inhibiting 4E-BP1 re-activation represses podocyte cell cycle re-entry and apoptosis induced by adriamycin[J].Cell Death Dis,2019,10(3):241.

