APG对糖尿病难治性溃疡创面中MMP-1、MMP-9及IMP-1水平的影响
张静,邓娟
枣庄矿业集团中心医院老年病科,山东枣庄 277000
糖尿病的并发症之一就是糖尿病溃疡,临床上治疗糖尿病溃疡的方法是局部溃疡伤口敷料和坏死组织清创,但仍有约14%~20%的糖尿病性溃疡患者在治疗后被截肢[1-4]。因此,仍然需要不断寻找一种更有效的疗法来帮助治疗糖尿病溃疡。自体富血小板凝胶法主要是以患者自身的外周静脉血为原料制得的富含自体血小板的血浆,再与凝血酶和钙剂以特定比例进行混合而成制得[5-6]。
近年来烷基糖苷(alkyl polyglycoside,APG)对糖尿病难愈性溃疡慢性创面的愈合作用的治疗研究逐渐增多,有研究表明,APG可用于治疗糖尿病难愈性溃疡[7],但鲜见APG对创面蛋白水解环境影响的相关报道,其机制也不够明确,有待进一步研究。该研究共选取2019年6月—2020年5月在该医院治疗的糖尿病皮肤溃疡的患者26例,旨在进一步研究APG治疗糖尿病难愈性溃疡的相关影响。现报道如下。
1 资料与方法
1.1 一般资料
选取在该院进行因糖尿病皮肤溃疡而住院的患者26例,根据随机数表法将其随机分为APG组和标准治疗组。其中能够获取观察到的时间节点完整肉芽组织的病例有25例(男15例,女10例),其中APG组13例,标准治疗组12例。两组患者在接受诊断时首先采取了胰岛素治疗控制体内血糖,在饮食治疗方面进一步严格控制高血压及血脂并且在临床研究期间定期进行监测,同时还要给予抗血小板、抗感染、营养神经、促进微循环改善等药物治疗;标准治疗组对局部创面进行切除腐坏性组织、切开腔隙引流减压、使用敷料等手段进行处理;APG组在标准治疗的基础上增加APG进行治疗,以创面愈合、转骨科行皮瓣移植或截肢、自动术后出院作为观测终点,总观测期为3个月。该课题的研究已得到了医院医学伦理委员会的审核,所有受试者都同意且已签署了相应的知情同意书。
1.2 试剂与仪器
APG由该院制备。人MMP-1、MMP-9检测试剂盒购自艾美捷Abnova公司;人TIMP-1 ELISA检测试剂盒购自Abcam;BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司);超声均浆器购自美国Cole-Parmer;全波长酶标仪仪器购自芬兰thermoelectronoy;低温离心机购自2008年美国版(beckman)。
1.3 方法
1.3.1标本收集及溃疡面积测量APG组的患者,在其治疗后的第0、3、6、9、15天分别取其创面内的肉芽组织,标准治疗组的患者在其治疗后的第0、6、15天分别取其创面内的肉芽组织。同时,在以上各个时间段进行测量溃疡表皮层的面积。将制作好的肉芽小块组织快速置于-80℃冰箱中冷冻保存,备用。
1.3.2组织蛋白含量和MMP-1、MMP-9、TIMP-1测定使用BCA法进行组织蛋白测定。组织在匀浆后取上清液,采用酶联免疫法分别测定其中MMP-1、MMP-9及TIMP-1的浓度,具体根据试剂盒的说明进行检测,将其所测得的浓度除以该组织中的蛋白质含量,计算各100μg的组织中MMP-1、MMP-9及TIMP-1的蛋白质含量。
1.4 统计方法
采用SPSS 22.0统计学软件对所有数据都进行统计处理分析,资料以(±s)表示,非正态分布的计量数据经对数进行转换后进行t检验。相关性的关系使用Pearson相关系数进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般情况
APG组患者一共13例,其中男的有8例,女的有5例;平均年龄(57.4±17.3)岁;糖尿病平均病程(6.7±5.2)年;皮肤溃疡病程(29.8±21.4)d;糖化血红蛋白(HbA1c)为(11.3±3.7)%;13例临床患者中发现有颈部溃疡1例,腘窝脓疡2例,糖尿病手2例,糖尿病足踝部溃疡8例(Wagner2级2例,3级1例,4级5例)。临床标准治疗组12例,男8例,女4例;平均发病年龄(61.7±11.4)岁;糖尿病的平均病程(7.9±6.5)年;皮肤溃疡病程(42±50.1)d;HbA1c(9.1±2.4)%;12例患者中有褥疮3例,糖尿病足溃疡9例(分别有Wagner 2级4例,Wagner 3级3例,Wagner 4级2例)。两组临床患者在发病年龄、糖尿病病程、皮肤溃疡发展情况及HbA1c的一般数据资料比较差异无统计学意义(P>0.05),数据资料呈非相对正态分布,经过对数进行转换后数据分析)。两组患者于当日入院后,血糖、血压、血脂均基本可以有效控制并达到一个正常值,肝肾各项正常功能都基本可以有效控制并达到正常。
2.2 两组患者治疗效果比较
APG组有11例患者全部痊愈,2例患者病情好转后转骨科进行了皮瓣移植术;标准治疗组中有5例患者痊愈,4例病情好转,2例因治疗未见有效而自动出院,1例因治疗失败转骨科截肢/趾。
2.3 治疗前后两组患者的溃疡愈合面积比较
两组患者治疗前口腔溃疡面积差异无统计学意义(P>0.05)。APG组的患者经过APG治疗后随着其处理时间的增长而使溃疡面积逐步减少,且其各个时间点之间的溃疡面积之间的对比差异有统计学意义(P<0.05);标准治疗组患者在进行治疗后的第6天和第15天的口腔溃疡面积均相对于治疗前明显缩小,且与APG组的差异有统计学意义(P<0.05)。见表1。
表1 APG组及标准治疗组在治疗前后溃疡面积比较[(±s),cm2]
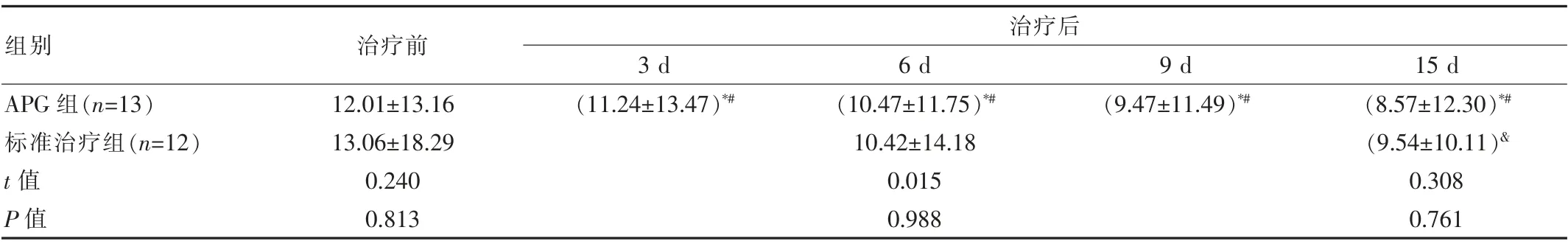
表1 APG组及标准治疗组在治疗前后溃疡面积比较[(±s),cm2]
注:*为与治疗前比较,P<0.05;#为APG组内治疗后各时间点比较,P<0.05;&为与同组治疗前和治疗6 d比较,P<0.05
组别治疗前治疗后3 d 6 d 9 d 15 d APG组(n=13)标准治疗组(n=12)t值P值12.01±13.16 13.06±18.29 0.240 0.813(11.24±13.47)*# (10.47±11.75)*#10.42±14.18 0.015 0.988(9.47±11.49)*# (8.57±12.30)*#(9.54±10.11)&0.308 0.761
2.4 两组在治疗前后肉芽组织中MMP-1、MMP-9、TIMP-1的浓度及MMP-9/TMP-1R的比较
APG组与标准治疗组患者相比,治疗前两组患者的溃疡内肉芽组织中MMP-1、MMP-9及TIMP-1蛋白质的浓度水平基本相同,差异无统计学意义(P>0.05);标准治疗组患者在进行治疗后第15天的溃疡肉芽组织中MMP-1水平明显高于治疗APG组,差异有统计学意义(P<0.05);两组间隔中MMP-9及TIMP-1水平分别在不同治疗时间点上进行比较,差异无统计学意义(P>0.05)。
在APG组中,肉芽组织中的MMP-1的蛋白质浓度在治疗后第3天 时有所降低,第6天时MMP-1蛋白质水平略有轻微回升,至第15天时,MMP-1蛋白质水平明显减少与第6天比较差异有统计学意义(P<0.05);在临床治疗过程中MMP-9浓度表现为随着时间的延长而逐步下降的趋势,但各个治疗时间地点之间的比较差异无统计学意义(P>0.05);TIMP-1水平从第3天 开始在APG进行治疗后 开始逐步升高,第6天可以达到最大值,然而与治疗前相比,从第6天 开始逐步下降,下跌至第15天 时其浓度略高于治疗前的水平,差异无统计学意义(P>0.05),差异有统计学意义(P<0.05)。
标准治疗组中,第6天 肉芽组织内MMP-1蛋白浓度在治疗后较治疗前明显升高,差异有统计学意义(P<0.05),肉芽组织内的MMP-1蛋白的浓度于第15天明显降低,但仍然远高于APG组,差异有统计学意义(P<0.05);第15天MMP-9蛋白的浓度相对于治疗前明显下降,差异有统计学意义(P<0.05);TIMP-1的浓度在各个时间点上基本保持相等的水平,差别无统计学意义(P>0.05),见表2。
表2 两组患者各时期创面肉芽组织中MMP-1、MMP-9、TIMP-1的浓度及MMP-9/TIMP-1比较(±s)
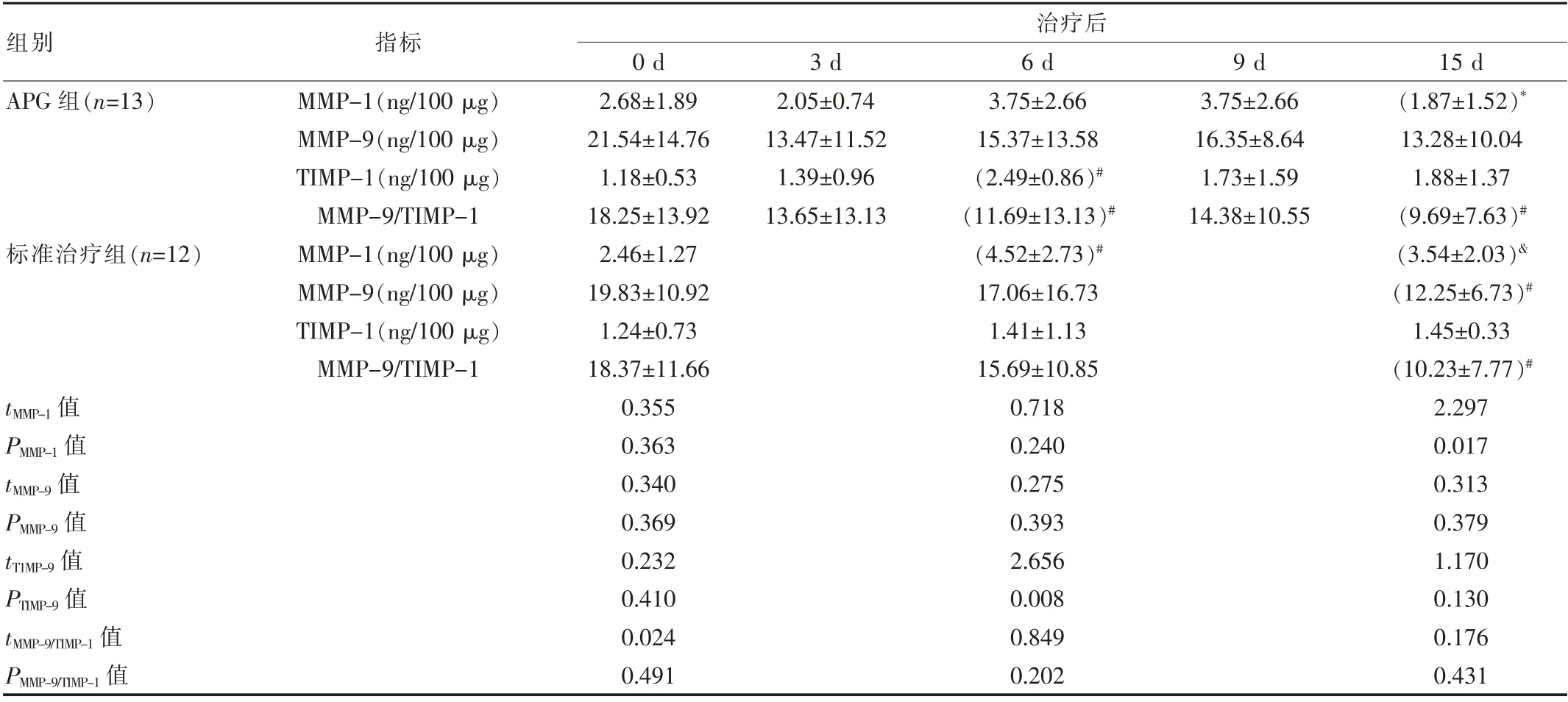
表2 两组患者各时期创面肉芽组织中MMP-1、MMP-9、TIMP-1的浓度及MMP-9/TIMP-1比较(±s)
注:*与同组第6天比较,P<0.05;#与同组第0天比较,P<0.05;&为与同时段的APG组比较,P<0.05
组别指标治疗后0 d 3 d 6 d 9 d 15 d APG组(n=13)2.05±0.74 13.47±11.52 1.39±0.96 13.65±13.13 3.75±2.66 16.35±8.64 1.73±1.59 14.38±10.55标准治疗组(n=12)MMP-1(ng/100μg)MMP-9(ng/100μg)TIMP-1(ng/100μg)MMP-9/TIMP-1 MMP-1(ng/100μg)MMP-9(ng/100μg)TIMP-1(ng/100μg)MMP-9/TIMP-1 t MMP-1值P MMP-1值t MMP-9值P MMP-9值t T1MP-9值P TIMP-9值t MMP-9/TIMP-1值P MMP-9/TIMP-1值2.68±1.89 21.54±14.76 1.18±0.53 18.25±13.92 2.46±1.27 19.83±10.92 1.24±0.73 18.37±11.66 0.355 0.363 0.340 0.369 0.232 0.410 0.024 0.491 3.75±2.66 15.37±13.58(2.49±0.86)#(11.69±13.13)#(4.52±2.73)#17.06±16.73 1.41±1.13 15.69±10.85 0.718 0.240 0.275 0.393 2.656 0.008 0.849 0.202(1.87±1.52)*13.28±10.04 1.88±1.37(9.69±7.63)#(3.54±2.03)&(12.25±6.73)#1.45±0.33(10.23±7.77)#2.297 0.017 0.313 0.379 1.170 0.130 0.176 0.431
2.5 两组溃疡肉芽组织中MMP-9/TIMP-1比值的变化及与溃疡愈合的关系
APG组患者的肉芽中的MMP-9/TIMP-1比值在治疗后第6天 和15天 的浓度均明显低于治疗前,差异有统计学意义(P<0.05),在标准治疗组中,MMP-9/TIMP-1浓度比值在治疗后第15天 时明显降低且浓度远低于治疗前,差异有统计学意义(P<0.05),但在不同治疗时间点组间的比较差异无统计学的意义(P>0.05)。肉芽细胞组织中的MMP-9/TIMP-1比值与溃疡面积的大小之间呈现正相关的关系(r=0.315,P=0.001),提示MMP-9/TIMP-1比值与溃疡的愈合程度呈现负相关的关系。
3 讨论
糖尿病的主要临床并发症之一的便是糖尿病溃疡,同时它也是临床上面临的重要挑战。目前,糖尿病溃疡的诊断与分类标准主要依据wagner分类体系和德克萨斯大学糖尿病伤口分类体系[8]。局部溃疡伤口敷料和坏死组织反复清创是糖尿病溃疡的典型临床治疗方法,但是此方法的预后不理想[9]。基于炎症或生长因子,已开发出几种方法来治疗糖尿病性伤口溃疡[4]。临床及非临床科学研究表明,这些治疗方法能够有效地解决糖尿病伤口愈合患者生活中的多种因素,包括血管的形成、细胞增殖及新陈代谢生长因子的释放等,但伤口创面愈合主要是由于多种因素的影响,需要发挥生长因子、细胞分裂、炎症因子及其他细胞外基质之间的平衡交互作用[10]。在该文中,进一步探讨当使用APG治疗糖尿病溃疡时,肉芽组织中3种因子(MMP-1、MMP-9和TIMP-1)水平随时间发展的变化。结果表明,两组肉芽组织中MMP-1、MMP-9和TIMP-1水平在研究前均处于同一水平。经APG治疗后,与标准治疗组患者相比,MMP-1水平有所降低,并且在第15天时明显减少;MMP-9水平在APG组中出现了逐渐下降的变化趋势,而在标准治疗组中则出现了明显的下降,两组间的比较差异无统计学意义(P>0.05);APG组的TIMP-1水平逐步增高,在第6天 达到了最高水平,而标准治疗组的TIMP-1在整个治疗期间几乎都是处于同一个水平,两组间比较差异无统计学意义(P>0.05);MMP-9/TIMP-1的水平有明显减少,并且该比值与溃疡面积呈正相关(r=0.319)。
APG是一种可以通过离心、分析和浓缩患者外周静脉血而获得的富血小板(PRP)血浆,它是从整个全血中提取出,由PRP与一定比例钙和凝血酶结合组成的凝聚物[11]。许多研究表明,APG可通过增加各种生长因子的浓度来促进慢性伤口的愈合[12-13]。APG是一种廉价且免疫学上安全的生长因子来源(GFs)。APG可以有效地加速愈合的过程,因此APG已被广泛应用于伤口修复领域[14]。作为第二代血小板源制剂,APG还具有一些其他优点,例如易于获得材料,生产简单,成本低,无不良反应[15]。越来越多的证据表明,APG对慢性伤口比标准护理/常规治疗更有效[16]。有研究结果表明,与标准护理/常规治疗相比,APG可显著提高糖尿病皮肤溃疡患者的治愈率,缩短治愈时间并减少患者感染的发生率[17]。此外,APG的治疗有可能会大大缩短患者的住院时间,减少住院成本,并在一定程度上减少不良事件的发生率[17]。该研究与上述研究一致,共说明APG对糖尿病难愈性溃疡有一定的疗效。
基质金属蛋白酶(MMPs)实际上是一个工蛋白大家庭,因人类需要Ca2+、Zn+等离子来作为其辅助因子而得名,主要是由结缔组织细胞,上皮细胞和巨噬细胞合成和分泌[18]。在其功能上,Ca2+、Zn+不仅使患者可以在生理和病理过程中有效地抑制和降解几乎所有的人体细胞外基质(ECM)的成分,还可以有效地调节细胞的黏附,并直接或间接地参与正常的人体生理过程,例如胚胎的发育,组织重塑和伤口修复[19]。该文研究结果与相关报道的结果一致,共同说明MMP-1、MMP-9和TIMP-1对糖尿病的溃疡起作用[20]。
已经有一些研究发现APG可能对糖尿病慢性溃疡中蛋白水解酶的失衡有潜在调控作用。许多研究表明,APG可通过增加各种生长因子的浓度来维持MMPs系统的平衡,并提供纤维蛋白网状支架[21]。在一些糖尿病性溃疡中,可能主要是由于细胞内的生长因子降低,导致蛋白质水解酶的活性普遍提升和特异性抑制药物的降低[22]。研究中发现经APG治疗后,MMP-1和MMP-9均出现了逐渐降低的趋势,而TIMP-1逐渐升高,MMP-9/TIMP-1的共同作用导致比值降低。
在该文的研究中,在APG组和标准治疗组中,肉芽组织中基质蛋白水解平衡在进行治疗时的变化趋势相似,但是使用APG对患者进行治疗并未显著地表现出明显的优势。因此,此类研究仍需更多样本量来证实这一观点。此外,机体的修补过程还很有可能会涉及除了MMP-1、MMP-9外,其他一些MMPs以及中性白细胞弹性蛋白酶、丝氨酸蛋白酶等蛋白水解酶及其一些蛋白酶抑制剂,这些因子可能在糖尿病溃疡的修补过程中也许发挥了一定的功效。因此,只是通过这项研究得出APG治疗虽然可能对糖尿病慢性溃疡中蛋白水解酶丧失的潜在影响有益,但是更多这种复杂的作用仍有待于进一步的探索和研究。

