基于柠檬酸-铕纳米配位聚合物构建荧光探针快速检测汤煲中5’-肌苷酸含量
高田毅,孙 冲,朱宏星,黄 杨,曹锦轩,王道营,
(1.宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
汤煲具有鲜美、营养价值高和保健功效等特点[1],主要呈鲜物质是鲜味氨基酸(谷氨酸、天冬氨酸等)和核苷酸(5’-鸟苷酸、5’-肌苷酸等)[2-3]。其中,5’-肌苷酸(inosine-5’-monophosphate,5’-IMP)在鲜味成分中占主导地位,在鸡肉、牛肉、猪肉中的含量分别为115、163、186 mg/100 g[4]。随着社会经济发展,国民生活水平大幅度提升,对食品品质也提出了更高要求,鲜味作为影响感官品质的重要因素,快速准确对5’-IMP含量进行检测具有重要意义。
目前,对5’-IMP的常见检测方法有薄层层析法[5]、紫外分光度法[6]、毛细管电泳[7]和高效液相色谱法[8]等。这些方法存在样品预处理复杂、操作难度高、检测成本高及仪器设备昂贵等缺点[9]。因此,亟需开发一种低成本、操作简单、快速且适用于大量现场检测的新方法,为实际产业中汤煲鲜味评价提供技术支持。
近年来,镧系金属离子与有机配体构建的镧系配位聚合物(lanthanide coordination polymers,LCPs)受到科研人员的广泛关注。LCPs是由镧系离子和有机配体构建具有延展网络结构的聚合物,由于其独特的发光性能,存在区别于有机物荧光探针的尖锐发射峰,且荧光寿命长、生物相容性好、量子产率高等特点[10-12],使LCPs在作为荧光探针方面具有独特的优势。根据检测目标物与镧系金属离子和配体之间的作用,导致荧光信号发生变化,从而达到检测目标物的目的[13]。Liu Baoxia等[14]将1,3,5-苯甲酸酯(1,3,5-benzenetricarboxylate,BTC)作为模板,以Cu2+作为信号调节器和识别单元,合成Cu-BTC/Tb荧光探针,实现对阿尔茨海默氏症的生物标志物淀粉样蛋白β肽单体的检测。Luo Yongquan等[15]基于铽与亚甲基膦酸制备多孔膦酸铽配位聚合物并将其应用于炭疽杆菌的检测,在尿液和牛血清等实际样品的检测中,表现出良好的选择性和稳定性。因此,镧系配位聚合物纳米粒子(lanthanide coordination polymer nanoparticles,LCP NPs)在生物检测方面有巨大的应用潜力。
本研究通过一步法合成柠檬酸-铕金属有机纳米配体聚合物(citrate/europium lanthanide coordination polymer nanoparticles,Cit/Eu LCP NPs),其检测原理如图1所示。发散蓝光的Cit/Eu LCP NPs与5’-IMP结合时由于—OH的伸缩振动,致使振动波和发射波重叠,Cit/Eu LCP NPs荧光信号猝灭[16]。因此,可将Cit/Eu LCP NPs作为荧光探针,通过荧光猝灭强度变化实现对5’-IMP快速准确的检测。

图1 Cit/Eu LCP NPs荧光检测5’-IMP示意图Fig.1 Schematic diagram for fluorescence detection of 5’-IMP through Cit/Eu LCP NPs
1 材料与方法
1.1 材料与试剂
三黄鸡 市购;六水合硝酸铕、4-羟乙基哌嗪乙磺酸(4-hydroxyethyl piperazine ethanesulfonic acid,HEPES) 上海阿拉丁生化科技股份有限公司;5’-IMP、天冬氨酸(Asp)、谷氨酸(Glu)(均为色谱纯) 美国Sigma-Aldrich公司;氯化铜、氯化铁、氯化亚铁、氯化钠、氯化铝、氯化镁、柠檬酸三钠、磷酸氢二钾,磷酸二氢钾(均为分析纯) 国药集团化学试剂有限公司;实验用水为超纯水(18.25 MΩ·cm)。
1.2 仪器与设备
Centrifμge 5810 R离心机 德国艾本徳公司;FE20/FG2 pH计、AL电子天平 瑞士梅特勒-托利多集团;Direct-Q3uv超纯水机 美国默克公司;Cytation5全波长酶标仪 美国伯腾公司;EVO-LS10扫描电子显微镜德国蔡司公司;Nicolet iS50傅里叶红外变换光谱仪美国赛默飞公司;D2 Phaser X射线衍射仪 美国布鲁克公司;FM-4P-TCSPC瞬态稳态荧光光谱仪美国Horiba公司;HJ-8(DF-1)集热式磁力搅拌器 常州国华公司;Alpha 1-4 LD冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 溶液的制备
100 mmol/L HEPES缓冲液制备:准确称取HEPES粉末2.38 g,转移至100 mL容量瓶中定容。用1 mol/L NaOH溶液调至pH 7.2,备用。
100 mmol/L柠檬酸三钠溶液制备:准确称取柠檬酸三钠粉末2.58 g,转移至100 mL容量瓶中定容,备用。
鸡汤制备:将整鸡内脏去除洗净,切成约4 cm×4 cm的小块称质量,按照料液比1∶2(g/mL)加入清水,选择电热砂锅慢炖模式。在炖煮过程中撇去表面浮油,将获得的鸡汤通过4 层脱脂纱布过滤,真空冷冻干燥备用。
1.3.2 Cit/Eu LCP NPs的制备
参考Liu Baoxia等[17]的方法。将5 mL硝酸铕六水合物溶液(100 mmol/L)加入2.5 mL柠檬酸三钠溶液(100 mmol/L)中搅拌,室温反应3.5 h后得到白色沉淀。将所得溶液8 000 r/min离心10 min,收集白色沉淀物并用去离子水洗涤数次以除去未反应物质。最后,将获得的Cit/Eu LCP NPs冻干备用。
1.3.3 Cit/Eu LCP NPs的表征
1.3.3.1 傅里叶变换红外光谱
采用压片法制备样品,实验参数设置:扫描波长范围为525~4 000 cm-1,分辨率为4.00 cm-1,扫描次数32。
1.3.3.2 X射线衍射
将粉末样品研磨过筛(200 目)固定在样品槽上。实验参数:扫描范围2θ为5°~85°,扫描电压20 kV,扫描电流5 mA,Kα(λ=1.541 8 Å),扫描速率4 °/min,步宽0.02°。
1.3.3.3 扫描电子显微镜
将获得Cit/Eu LCP NPs材料粉末超声溶解后,涂于载玻片表面,干燥后将载玻片固定至扫描电子显微镜的样品台上,对样品进行表面形貌的表征。实验参数设置:加速电压10 kV,真空度小于6×10-4Pa。
1.3.4 Cit/Eu LCP NPs荧光探针标准曲线的构建
将Cit/Eu LCP NPs粉末超声溶解在5 mL HEPES缓冲液中(100 mmol/L,pH 7.2),制备成Cit/Eu LCPNP悬液备用,并配制质量浓度为2.5、5、10、25、50、100、200 μg/mL 5’-IMP溶液。取500 μL不同质量浓度5’-IMP溶液、200 μL Cit/Eu LCP NPs溶液、1 mL HEPES缓冲液混合并充分振荡,并在25 ℃孵化20 min后通过全波长酶标仪测定荧光值。参数设置:发射波长(λEx)范围为300~600 nm,固定激发波长(λEm)为250 nm,荧光增益为80,激发和发射狭缝均为20 nm,步幅设置为5 nm,通过计算猝灭的荧光变化值,建立与5’-IMP质量浓度的标准曲线。
1.3.5 实际鸡汤样品中5’-IMP含量的检测
称取50 mg冻干鸡汤粉末定容至50 mL,8 000 r/min离心10 min,取上层清液。滤膜过滤(0.22 μm),去除多余的脂肪和杂质。通过向每个样品中添加0、10、50 μg/mL的5’-IMP,根据1.3.3节方法测定荧光强度,计算Cit/Eu LCP NPs荧光探针的加标回收率。
1.4 数据统计
采用IBM SPSS Statistics 25.0软件进行数据分析,采用Origin 8.5软件进行谱图绘制。
2 结果与分析
2.1 Cit/Eu LCP NPs材料的表征
为了证明Cit/Eu材料的成功制备以及Cit/Eu与IMP之间的配位作用,采用扫描电子显微镜,傅里叶红外光谱及X射线衍射对Cit/Eu LCP NPs材料表征。如图2A所示,Cit/Eu LCP NPs呈现外观圆整的纳米颗粒聚集结构,这与Xu Yuanyuan等[18]制备的一磷酸腺苷-铽镧系金属聚合物具有相似的形貌。如图2B所示,在曲线a中,1 383 cm-1处的吸收峰是由于—COOH不对称拉伸振动产生的特征峰[19];在曲线b中,随着硝酸铕的加入,1 362 cm-1处的—OH特征峰与1 395 cm-1处的C—O特征峰的峰高均明显上升,且1 588 cm-1处C=O键的伸缩振动偏移至1 562 cm-1,表明Eu3+通过羧基与柠檬酸三钠配位[20]。在曲线c中,随着5’-IMP的添加,1 078 cm-1与1 363 cm-1处的特征吸收峰显著增强,说明5’-IMP与Cit/Eu LCP NPs通过PO43-基团和O—H键配位[21-22]。如图2C所示,在2θ为27°和57°处展现出了明显的铕特征峰[23],上述结果表明Cit/Eu LCP NPs材料的成功合成。

图2 Cit/Eu LCP NPs材料的表征结果Fig.2 Characterization of Cit/Eu LCP NPs
2.2 Cit/Eu LCP NPs荧光探针荧光性能的表征
如图3A所示,由于柠檬酸对Eu3+的天线效应,在250 nm的激发波长下,305 nm处出现尖锐的荧光峰。随着5’-IMP的加入,由于—OH的伸缩振动导致了Cit/Eu LCP NPs荧光猝灭。如图3B所示,Cit/Eu LCP NPs在波长250 nm处出现明显的紫外吸收峰,当5’-IMP加入后,波长250 nm处的紫外吸收峰明显降低,证明5’-IMP与Cit/Eu LCP NPs发生配位,导致荧光猝灭,这与荧光光谱的结果一致。如图3C所示,Cit/Eu LCP NPs的荧光寿命为1.56 μs,相较于碳量子点[24]、CdS量子点[25]等纳秒级(ns)的荧光寿命,Cit/Eu LCP NPs微秒级(μs)的荧光寿命有利于消除背景荧光影响,提高光能转换效率[26-27]。
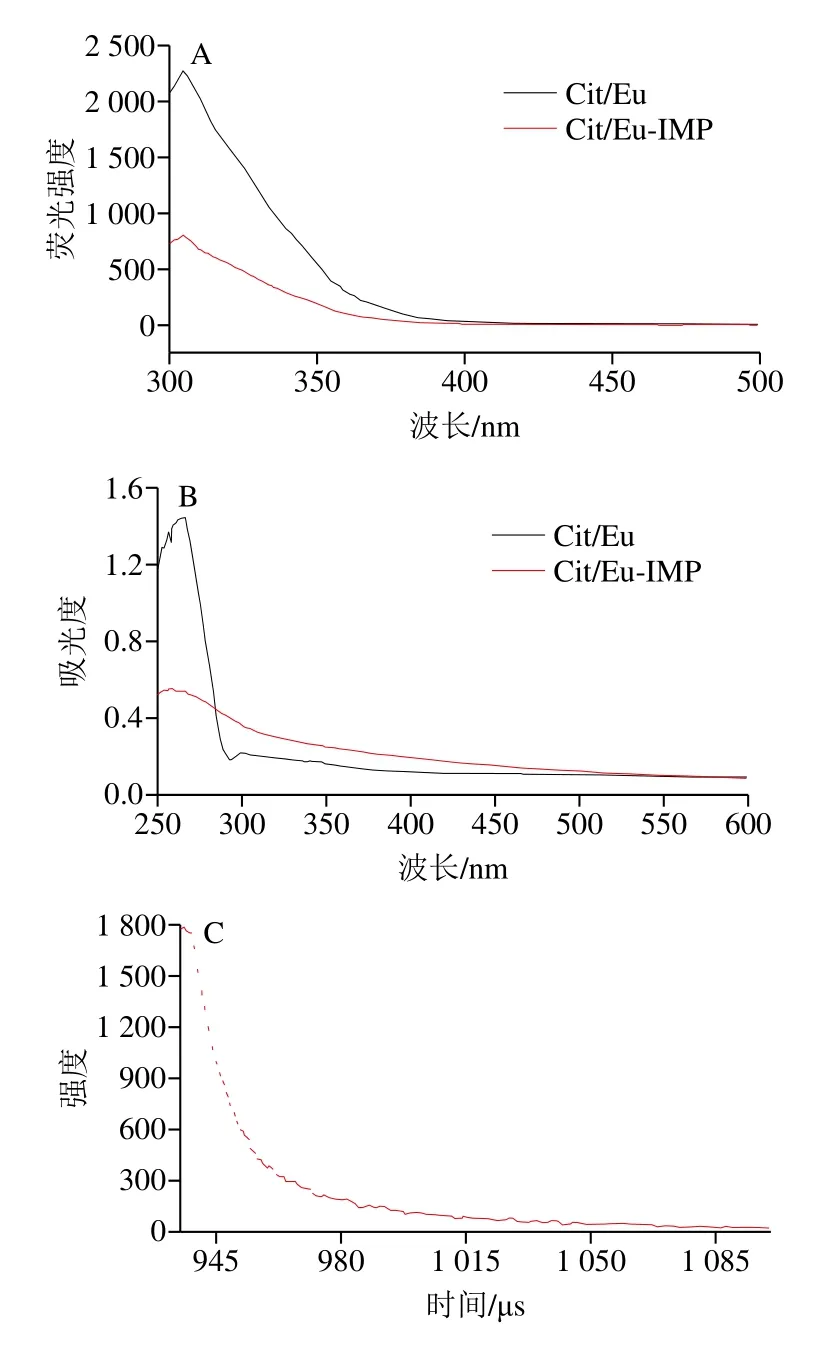
图3 Cit/Eu LCP-NPs的紫外吸收与荧光特性分析Fig.3 UV-vis absorption spectra and fluorescence characteristics of Cit/Eu LCP-NPs
2.3 Cit/Eu LCP NPs荧光探针的参数优化
不同实验参数,如缓冲液pH值、孵化时间、孵化温度等都会影响探针的性能。因此,对这些影响因素进行研究,通过荧光猝灭值(F0-F,F为待测组荧光值,F0为空白对照组荧光值)确定该荧光探针最佳的工作条件。如图4A所示,当缓冲溶液pH值在6.8~7.4范围内变化时,随着pH值升高荧光猝灭值呈现不断下降的趋势,在pH值为7.2时,荧光猝灭值最低,此时待测组荧光值达到最大。但当缓冲溶液pH值大于7.2时,荧光猝灭值上升,这是由于偏酸性体系下Cit/Eu LCP NPs表面基团发生质子化,偏碱性体系下由于氢键作用聚集Cit/Eu LCP NPs团聚导致荧光衰减,而中性缓冲液环境下其表面基团趋于稳定[28-29]。因此选择pH值为7.2作为最佳缓冲条件。如图4B所示,随着孵化时间的延长,荧光猝灭值逐渐减小,当结合时间为20 min时,荧光猝灭值已达稳定,说明Cit/Eu LCP NPs与5’-IMP结合完全。为了节省测试时间,选取20 min为最佳孵化时间。如图4C所示,随着孵化温度的上升荧光猝灭值呈不断下降趋势,并在25 ℃处达到最低,当孵化温度超过25 ℃时,荧光猝灭值则呈现趋势上升。这是由于热效应对于荧光强度的影响,温度的上升导致更多的电子填充到Eu的电子空穴中,荧光强度发生变化[30]。因此,选择最佳孵化温度为25 ℃。

图4 Cit/Eu LCP NPs荧光探针的参数优化Fig.4 Parameter optimization for Cit/Eu LCP NPs fluorescent probe
2.4 Cit/Eu LCP NPs荧光探针的选择性、重复性及稳定性分析
具有良好灵敏度的探针不仅可以有效监测目标物的浓度,而且可以有效消除探针体系中其他物质的干扰。因此,选择汤煲中常见的金属离子、鲜味氨基酸进行该探针的抗干扰性分析。如图5A所示,在相同实验条件下选择200 μg/mL的5’-IMP、Cu2+、Na+、K+、Ca2+、Mg2+、Cl-、Asp、Glu与空白组进行对照实验,根据相对荧光强度F/F0(F为待测组荧光值,F0为空白对照组荧光值)评价荧光探针的选择性。实验结果表明,5’-IMP对波长305 nm处的荧光有效猝灭,相对荧光强度为51.64%,汤煲中常见的金属离子、氨基酸相对荧光强度分别为Cu2+(96.34%)、Na+(103.99%)、K+(106.51%)、Ca2+(100.85%)、Mg2+(98.65%)、Cl-(92.79%)、Asp(95.07%)、Glu(94.69%),对Cit/Eu LCP NPs检测影响较小,说明本实验构建的荧光探针具有良好的选择性及抗干扰能力。在相同条件下对同一待测质量浓度的5’-IMP溶液进行重复检测,得到相对标准偏差为3.09%。同时,将Cit/Eu荧光探针放入4 ℃冰箱中保存,连续5 d检测其荧光强度,如图5B所示,5 d后该荧光探针可以保持初始测定值的97.39%。因此,该荧光探针拥有良好的稳定性和重复性。

图5 Cit/Eu LCP-NPs抗干扰性(A)和稳定性(B)Fig.5 Anti-interference ability (A) and stability (B) of Cit/Eu LCP-NPs
2.5 Cit/Eu LCP NPs荧光探针的性能检测
为了评估Cit/Eu LCP NPs荧光探针性能,将不同质量浓度5’-IMP溶液与Cit/Eu LCP NPs孵化后进行荧光检测。如图6所示,随着5’-IMP溶液质量浓度的增加,Cit/Eu的荧光强度呈现线性降低,以5’-IMP质量浓度为横坐标,相对荧光猝灭值为纵坐标,在2.5~200 μg/mL范围内,Cit/Eu-IMP在波长250 nm处呈现良好的线性关系,线性方程为ΔI=12.70CIMP+312.63(R2=0.993 0),检出限为0.17 μg/mL。表1列举了该荧光探针与其他5’-IMP检测方法的参数对比。由表1可见,相较于其他5’-IMP的检测方法,本实验建立的荧光探针具有较低的检出限和较宽的检测范围。

图6 不同质量浓度IMP-Cit/Eu LCP-NPs的荧光光谱(A)和IMP质量浓度与荧光强度的关系(B)Fig.6 Fluorescence spectra of Cit/Eu LCP-NPs with different concentrations of IMP (A) and relationship between IMP concentration and fluorescence intensity (B)
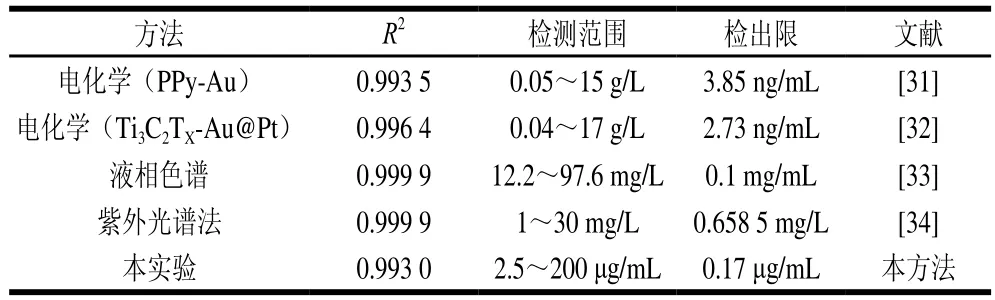
表1 不同方法测定5’-IMP质量浓度的比较Table 1 Comparison of figures of merit of different methods for the determination of 5’-IMP
2.6 实际鸡汤样品中5’-IMP含量的检测
为了验证本实验构建荧光探针的实际可行性,采用高效液相色谱法作为参比方法对鸡汤中的5’-IMP进行检测。采取加标回收实验,在鸡汤样品中加入不同质量浓度5’-IMP(0、10 μg/mL和50 μg/mL),并对其进行检测分析,如表2所示。该荧光探针测得回收率为97.85%~103.95%,相对标准偏差小于5%,该结果与高效液相色谱检测结果基本一致,表明该荧光探针可用于实际肉品汤煲样品中5’-IMP的检测。

表2 2种方法测定鸡汤样品中5’-IMP的比较Table 2 Comparison of recoveries and precision of the fluorescent probe method and HPLC for 5’-IMP in chicken broth samples
3 结 论
本研究通过一步法合成Cit/Eu LCP NPs,采用扫描电子显微镜、傅里叶变换红外光谱、X射线衍射等对Cit/Eu LCP NPs进行表征。在此基础上,构建基于Cit/Eu LCP NPs荧光探针用于汤煲中5’-IMP的检测。在最优条件下,该荧光探针的线性范围为2.5~200 μg/mL,线性方程为ΔI=12.70CIMP+312.63(R2=0.993 0),检出限为0.17 μg/mL,且该探针具有良好的稳定性、重复性和抗干扰性。在实际鸡汤样品的加标回收实验中,测得回收率为97.85%~103.95%,检测结果与高效液相色谱检测结果一致。综上所述,本实验发展出具有优良检测性能的鲜味荧光探针,为实际产业中高效快速评价提供新的思路和方法。

