小麦果糖激酶基因TaFRK与TaPFT的互作分析
张露凡,宋普文,毋柳柳,胡海燕,李成伟
(河南科技学院生命科技学院/河南省植物遗传改良与土壤修复国际联合实验室,河南新乡 453000)
小麦(TriticumaestivumL.)是世界最重要的粮食之一,也是我国重要的粮食作物,目前我国耕地面积逐渐减少,保证粮食作物高产稳产和高质量发展就显得尤为重要。同时我国也是小麦的生产大国和消费大国,小麦赤霉病的流行已经严重威胁到我国的粮食和食品生产安全[1]。
小麦赤霉病是由镰刀菌属真菌引起的一种世界性病害,流行年份会导致小麦产量下降,甚至导致绝收[2]。同时镰刀菌还会在小麦体内产生多种真菌毒素,如脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)等,人畜误食会造成严重危害[3]。
减轻小麦赤霉病危害最经济、环保的手段就是培育抗病品种[4]。但是国内外抗源较少,农艺性状较差和抗性机理不清楚阻碍了抗病品种的培育[5]。因此,挖掘小麦赤霉病抗性基因资源、创制抗赤霉病新种质以及研究小麦抗赤霉病抗性机理仍是目前小麦赤霉病的研究方向。Fhb1是在苏麦3号中发现的抗赤霉病效应和稳定性最好的位点,随后在望水白、黄方柱和日本品种Nyubai中均发现了该位点[6]。Rawat等[7]通过对苏麦3号3BS染色体上主效位点Fhb1的精细定位和图位克隆,获得了抗赤霉病扩展的基因PFT(pore-forming toxin-like)。2019年Su等[8]在Fhb1位点鉴定到一个编码组氨酸富集的钙离子结合蛋白基因TaHRC,被认为是Fhb1位点的主要抗性基因,并发现TaHRC基因沉默后小麦抗性增强,而Li等[9]将TaHRC基因过表达后发现小麦抗性增强,所以,其作用机制目前也存在分歧,同时也说明了小麦赤霉病抗性机制可能不是由一个基因控制的,可能存在其他基因的干预。He等[10]通过以PFT为诱饵筛选小麦酵母双杂文库,得到23种与PFT互作的蛋白,并通过实时定量PCR分析这些互作蛋白基因的表达模式,发现5种蛋白在植物生长和发育的各个过程中以及在抵抗生物和非生物胁迫方面发挥关键作用。
本研究先以PFT为诱饵蛋白筛选小麦酵母双杂文库,得到一个新的基因,然后通过酵母双杂交试验、双分子荧光互补试验和实时荧光定量分析,对其表达模式以及与小麦TaPFT的相互作用进行分析,以期为解析小麦赤霉病抗性机制奠定基础。
1 材料与方法
1.1 材 料
抗赤霉病小麦苏麦3号和本氏烟草均由河南科技学院河南省粮食作物基因组编辑工程技术研究中心提供。大肠杆菌DH5α感受态细胞、根癌农杆菌GV3101感受态细胞、酵母Y2HGold菌株均由本实验室保存。
1.2 方法
1.2.1 小麦RNA的提取与cDNA的合成
在小麦生长至两叶一心时,取一整株小麦用ddH2O冲洗干净后迅速放入液氮冷冻,-80 ℃保存。采用Trizol法提取小麦RNA,使用RNase-Free DNase I试剂盒去除混杂的基因组DNA,用超微量分光光度计测量RNA样品的纯度和浓度。cDNA的合成按照PrimeScriptTMII 1st Strand cDNA Synthesis Kit试剂盒(宝生物,大连)说明书进行,反转录产物于-20 ℃保存。
1.2.2 PFT互作蛋白基因的酵母筛库
将TaPFT基因连接至酵母表达载体pGBKT7上,通过酵母转化的方法导入酵母菌株Y2HGold中,涂布于SD-Trp平板培养基上, 30 ℃培养长出单克隆后,挑取单克隆接种至50 mL SD-Trp液体培养基中培养12~16 h,作为原代培菌液。利用酵母转化试剂盒(TaKaRa,大连)制备酵母感受态细胞,将前期制备好的小麦酵母双杂cDNA文库转化至酵母感受态中,并涂布于SD/-His-Leu-Trp-Ade平板培养基上,于 30 ℃培养3~7 d后,挑取单克隆进行扩繁培养,使用酵母质粒提取试剂盒(天根,北京)提取酵母质粒,并以酵母质粒为模板进行PCR扩增,扩增产物用胶回收试剂盒(天根,北京)进行回收后,送至武汉金开瑞生物工程有限公司进行测序。用ORF Finder分析表明,其中一个文库插入序列具有771 bp的完整编码框,进一步BlAST分析表明,其序列与已知小麦cDNA文库克隆Triticum aestivum clone wyr1c.pk002.o12(BT008921.2)序列具有99.48%的相似性,其编码蛋白与野生二粒小麦(Triticumdicoccoides)果糖激酶Fructokinase-2蛋白序列具有99.48%的相似性,因此推测该基因编码蛋白为Fructokinase,命名为TaFRK。
1.2.3 基因克隆
使用Primer 6.0软件设计引物TaFRK-F/R和 TaPFT-F/R(表1),扩增TaFRK和TaPFT基因的全长序列。以TaFRK和TaPFT的cDNA为模板扩增TaFRK(771 bp)和TaPFT(1 434 bp)的编码区序列。PCR反应体系为25 μL,包括模板cDNA 1 μL,上下游引物(10 μmol·L-1)各1 μL,Taq酶12.5 μL,ddH2O 9.5 μL。PCR反应程序:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火55 ℃(TaFRK:45 s;TaPFT:90 s),延伸72 ℃ 30 s,35个循环;延伸72 ℃ 7 mim,4 ℃保存。用1%琼脂糖凝胶电泳检测PCR产物。
PCR产物胶回收后分别与pMD19-T载体于16 ℃连接过夜,连接产物转化至大肠杆菌DH5α感受态细胞后,涂抹于含有Amp+抗性的培养基上,随机选取5个单克隆菌落,菌落PCR鉴定为阳性后,送至武汉金开瑞生物工程有限公司进行测序。
1.2.4 酵母双杂交分析
使用Primer 6.0软件设计的引物pGADT7-TaFRK-F/R和pGBKT7-TaPFT-F/R(表1)分别扩增TaFRK和TaPFT基因,对扩增产物进行电泳并进行回收后,将回收产物TaFRK连接至经过EcoR I和XhoI双酶切的pGADT7载体上,构建pGADT7-TaFRK重组载体;将回收产物TaPFT连接至经BamH I和EcoR I酶切的pGBKT7载体上,构建pGBKT7-TaPFT重组载体,然后将这两个重组载体分别转化至大肠杆菌DH5α感受态细胞。对单克隆进行PCR验证,将阳性克隆送至武汉金开瑞生物工程有限公司进行测序。用通用引物T7和3AD对pGADT7-TaFRK进行测序,用通用引物T7和3BD对pGBKT7-TaPFT进行测序,用DNAMAN软件对测序结果进行对比分析。

表1 本试验使用的引物Table 1 Primers used in the study
使用PEG/LiAc法转化酵母菌株Y2HGold,以pGBKT7-TaPFT和pGADT7-TaFRK共转化作为试验组,以pGBKT7和pGADT7空载体共转化作为对照组,pGBKT7-TaPFT和pGADT7、pGADT7-TaFRK和pGBKT7共转化作为阴性对照。转化后的酵母涂抹在含有X-α-Gal和AbA的 SD/-Leu/-Trp/-His/-Ade平板培养基上,于30 ℃静置培养3~ 5 d,拍照并记录。
1.2.5 双分子荧光互补分析
使用Primer 6.0软件设计的引物BiFC-TaFRK-F/R和BiFC-TaPFT-F/R(表1)分别扩增TaFRK和TaPFT基因的开放阅读框。对扩增产物进行电泳并回收。使用Gateway体系构建双分子荧光互补载体,经BP反应将回收产物TaFRK和TaPFT分别连接至pDNOR221中间载体,构建pDNOR221-TaFRK和pDNOR221-TaPFT重组载体,然后转化至大肠杆菌DH5α感受态细胞。对PCR鉴定为阳性的单克隆送至武汉金开瑞生物工程有限公司进行测序。将测序正确且含有pDNOR221-TaFRK和pDNOR221-TaPFT的单克隆分别进行摇菌提质粒后,经过MluI快切酶酶切,用回收试剂盒(天根,北京)进行回收,将目的基因经LR反应连接至YC和YN载体中,构建YC-TaFRK和YN-TaPFT载体,然后转化至大肠杆菌DH5α感受态细胞,对PCR鉴定为阳性的单克隆送至武汉金开瑞生物工程有限公司进行测序。用DNAMAN软件对测序结果进行对比分析。
将YC-TaFRK和YN-TaPFT载体分别转入农杆菌GV3101中进行摇培,待OD600约为0.6~0.8时,5 000 g离心1 min富集菌体,用无菌水洗涤菌体,再用烟草侵染缓冲液(D-glucose 250 mg,0.5 mol·L-1的MES 5 mL, 1 mol·L-1的乙酰丁香酮5 μL,0.02 mol·L-1的Na3PO4·12H2O 5 mL,加无菌水至50 mL)重悬菌体后将两种菌液等比例混合,黑暗静置2 h,然后使用注射器将菌液注射至6~8周龄的烟草叶片;同时设置对照将空载体YC和YN注射至烟草,用记号笔标记注射区域,25 ℃培养48 h后,在激光共聚焦显微镜下观察结果,并拍照。
1.2.6 接种禾谷镰刀菌后TaFRK基因的表达模式分析
按照Bai等[11]的方法用绿豆汤培养基培养禾谷镰刀菌,产生孢子后于7 000 g 离心15 min收集孢子,用无菌水冲洗2~3遍。于小麦开花期,使用移液器将15 μL禾谷镰刀菌孢子悬浮液(200个孢子·μL-1)注入穗状花序的中央小花中,接种过的穗包裹在夹层袋中,夹层袋内部用水雾化,分别在小麦接种禾谷镰刀菌0、 3、6、12、24、36、48和72 h时取样,对照组用无菌水接种小麦小穗。每个时间点收集2个小穗,取下后置于液氮中冷冻, -80 ℃保存。
为了标准化每个反应中的cDNA总量,并消除样品之间的差异,以小麦微管蛋白基因Tubulin作为内部参照。每个样品重复3次,使用2-ΔΔCT方法计算TaFRK基因的相对表达量,进行3次生物学重复。
2 结果与分析
2.1 酵母双杂交载体和双分子荧光互补载体的构建
用引物TaPFT-F/R和TaFRK-F/R扩增TaPFT和TaFRK基因的全长片段,扩增结果如图1A和图1B所示。对扩增片段进行回收,与pMD19-T载体16 ℃连接过夜后转化大肠杆菌DH5α感受态细胞,挑5个单克隆摇菌,菌液PCR验证为阳性后进行测序。将测序正确的菌液提取质粒后分别连接在pGBKT7(BamH I和EcoR I双酶切)和pGADT7(EcoR I和XhoI双酶切)载体上。经PCR检测后送测序,分别得到约1 434和771 bp的片段(图1C和图1D),与TaPFT和TaFRK的片段大小一致,表明表达载体构建 成功。
双分子荧光互补载体的构建使用Gateway体系,分别使用引物BiFC-TaPFT-F/R和BiFC-TaFRK-F/R分别扩增TaPFT和TaFRK基因的开放阅读框,经BP反应将TaPFT和TaFRK基因连接至中间载体pDNOR221,菌落PCR验证为阳性后送测序。将测序正确的载体用MluI酶切后回收,然后经LR反应将TaPFT和TaFRK分别与YN和YC载体连接,并进行测序,分别得到大小分别为1 434和771 bp的片段(图1E和1F),与TaPFT和TaFRK的片段大小一致,表明表达载体构建成功。

M:Marker DL2000;M1:Marker DL5000.图1 TaPFT和 TaFRK基因的克隆及酵母双杂交载体和双分子荧光互补载体的构建Fig.1 Cloning of TaPFT and TaFRK genes and construction of yeast two hybrid vector and bimolecular fluorescence complementary vector of TaPFT and TaFRK
2.2 酵母双杂交验证 TaFRK和 TaPFT的相互 作用
酵母双杂交是鉴定蛋白相互作用最常用的手段。将共转pGBKT7-TaPFT和pGADT7-TaFRK、pGBKT7-TaPFT和pGADT7、pGBKT7和pGADT7-TaFRK、pGBKT7和pGADT7的酵母菌菌株Y2HCold在含有X-α-Gal和AbA的SD/-His-Leu-Trp-Ade的平板培养基上进行划线培养,发现只有共转pGBKT7-TaPFT和pGADT7-TaFRK的酵母变蓝(图2)。表明TaPFT和TaFRK基因可以在酵母中发生相互作用。
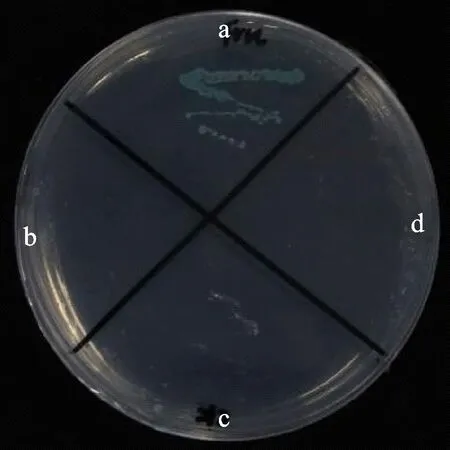
a:pGBKT7-TaPFT载体与pGADT7-TaFRK载体共转酵母涂板;b:pGBKT7-TaPFT载体与pGADT7载体共转酵母涂板;c:pGBKT7载体与pGADT7-TaFRK载体共转酵母涂板;d:pGBKT7载体与pGADT7载体共转酵母涂板。a: pGBKT7-TaPFT vector and pGADT7-TaFRK vector were co-transferred into yeast; b: pGBKT7-TaPFT vector and pGADT7 vector were co-transferred into yeast; c: pGBKT7 vector and pGADT7-TaFRK vector were co-transferred into yeast; d: pGBKT7 vector and pGADT7 vector were co-transferred into yeast.图2 酵母双杂交检测 TaFRK和 TaPFT的相互作用Fig.2 Interaction between TaPFT and TaFRK detected by yeast two-hybrid system
2.3 双分子荧光互补试验验证 TaFRK和 TaPFT的相互作用
为了进一步验证TaFRK和TaPFT是否可以在植物体内发生相互作用,利用双分子荧光互补试验探讨TaFRK和TaPFT在烟草细胞中的相互作用情况。结果(图3)发现,携带YC-TaFRK和YN-TaPFT农杆菌组合的烟草表皮细胞中可以观察到黄色荧光,且荧光主要分布在细胞质中,表明TaFRK和TaPFT在细胞质中发生了相互作用,而只携带YC和YN农杆菌组合的烟草表皮细胞中未观察到黄色荧光。
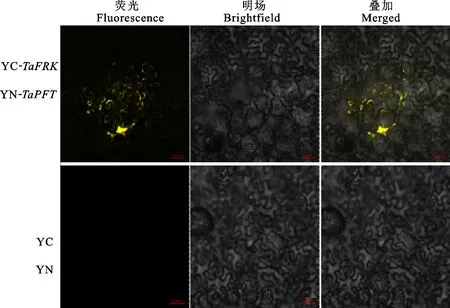
图3 双分子荧光互补实验检测 TaPFT和 TaFRK相互作用Fig.3 Interaction between TaPFT and TaFRK detected by Bi-Fluorescent Complementation
2.4 接种禾谷镰刀菌后 TaFRK的表达模式
由表2可以看出,随着时间的延长,接种禾谷镰刀菌孢子处理组TaFRK基因的相对表达量总体上呈上升趋势(除接种12 h时有所下降);而对照组TaFRK基因的相对表达量呈先上升后下降的趋势。在接种6~72 h(除接种12 h),处理组TaFRK基因的相对表达量均显著高于对照组。表明禾谷镰刀菌孢子侵染后诱导了TaFRK基因的上调表达。说明TaFRK基因可能参与小麦赤霉病抗性反应。
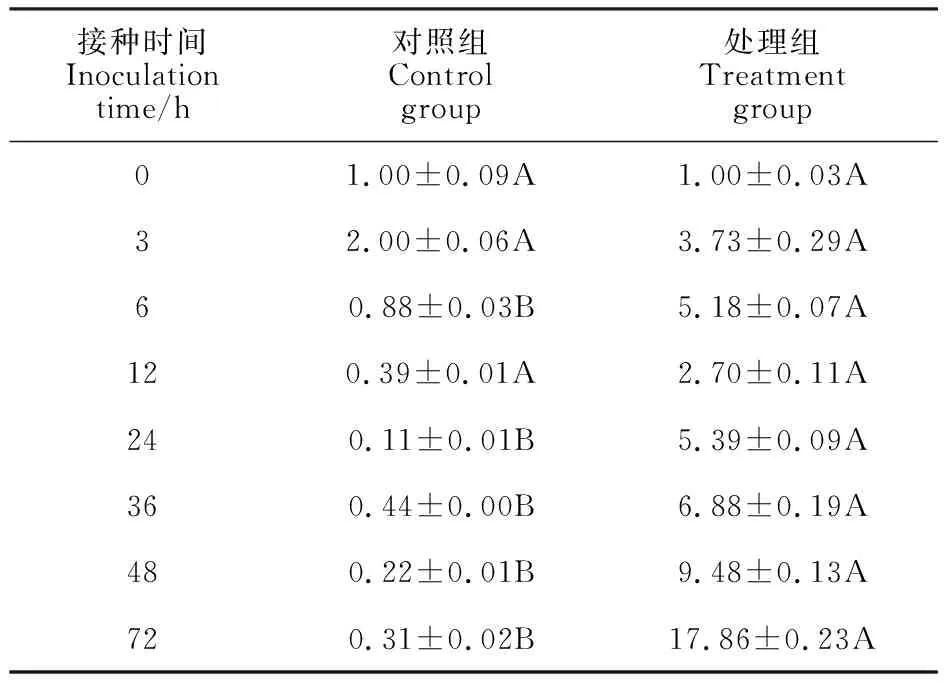
表2 接种禾谷镰刀菌后小麦小穗中TaFRK的相对表达量Table 2 Relative expression of TaFRK gene in wheat spikelets after anoculation with Fusarium graminearum spores
3 讨 论
果糖激酶(Frlctokinase,FRK)是己糖激酶的一种,不仅参与糖的代谢,还可作为糖感受器和信号分子来调控植物的生长发育[12-14],激活或阻遏植物体内相关基因的表达来影响细胞周期、光合作用、碳氢代谢、逆境响应、萌发、营养生长、生殖发育、衰老等过程[15]。Granot等[16]通过嫁接试验表明,反义抑制番茄LeFRK2可引起叶片枯萎以及茎组织中活性木质部面积明显变小。说明LeFRK2参与木质部的发育过程,且木质部发育可能与果糖有关。果糖是蔗糖的水解产物,蔗糖合成酶(SUSY)可将蔗糖裂解成UDP葡萄糖和果糖,其中UDP葡萄糖已经证明参与番茄的维管系统表达[17-18],这说明SUSY也可能与木质素发育有关。
Roach等[19]研究表明,在杨木发育过程中RNA干扰FRK2基因的表达,可增加可溶性糖的含量以及降低己糖磷酸和UDP-葡萄糖的含量,表明FRK2基因与胞壁多糖前体的碳流有关。
FRK2蛋白的活性降低也导致纤维细胞壁变薄,纤维素比例降低[19]。这一结果确立了FRK2在木材纤维素碳通量中的中心作用。
Tomassini等[20]研究表明,禾谷镰刀菌在入侵小麦时在体外产生纤维素酶、木聚糖酶等降解宿主细胞壁的酶来降解细胞壁,从而穿透和定殖宿主组织。而木质素在禾本科植物细胞壁占比20%,是一种重要的结构成分,可防御病原体的入侵,使细胞壁对细胞壁降解酶更具抵抗力,同时阻止病原体产生的毒素扩散。Lionetti等[21]研究表明,较高的S型木质素含量可能是一种与抗病性有关的细胞壁生化特性,同时也表明有利于S型木质素积累的基因可能参与了对病原菌的抗性。
Yang等[22]研究发现,苹果MdFRK2的转录受到褪黑素(N-乙酰基-5-甲氧基色胺)的抑制,较高的褪黑素浓度会抑制MdFRK2的表达和降低FRK蛋白的活性。褪黑素是植物中广泛存在的具有高度保守性的多功能小分子,当由于生物胁迫导致细胞渗漏时,可通过激活防御相关基因的表达参与植物的光周期反应、清除活性氧以及保护植物免受细菌病原体的侵害[23-24]。说明MdFRK2受褪黑素的调控,进而参与植物的抗病 过程。
本研究使用酵母双杂交和双分子荧光互补试验证明,TaFRK和抗病基因PFT能够发生互作反应,实时荧光定量研究表明,TaFRK基因表达受赤霉病侵染诱导。而FRK基因在植物细胞壁和木质素合成中起重要作用[20-21],我们推测TaPFT可能通过与TaFRK互作影响细胞壁或木质素的积累来提高植物细胞壁的抗病特性。本研究为解读小麦抗赤霉病抗性机理具有一定的参考意义,为解析TaPFT抗性机制提供新途径。

