低桔霉素红曲霉变异菌株筛选及其变异位点分析
桂艳玲,唐光甫,满海乔,赵杰宏
(贵州中医药大学,贵州省生药学重点实验室,贵州 贵阳 550025)
0 引言
【研究意义】红曲霉是我国应用广泛的传统药食两用真菌,其代谢产物有洛伐他汀、γ-氨基丁酸、麦角甾醇、红曲色素和桔霉素等,其中洛伐他汀有助于降低胆固醇含量,红曲色素广泛用于食品添加剂,而桔霉素是一种真菌毒素[1-3]。桔霉素给红曲霉及其产品造成很大的负面影响,不仅影响着我国红曲产品的进出口,也危害消费者身体健康。因此,不断挖掘桔霉素代谢调控途径,选育不产桔霉素的红曲霉菌种具有重要应用价值。【前人研究进展】目前,围绕桔霉素调控的研究主要集中在发酵条件优化[4-6]、菌种改良和遗传调控方面[7-8]。庄晓晓等[9]利用N+离子束诱变结合紫外辐照处理得到低产桔霉素菌株;王轩等[10]使用紫外和硫酸二乙酯复合诱变选育了低产桔霉素菌株。LI等[11]通过敲除CtnB基因获得桔霉素含量明显下降的红曲;HE等[7]敲除orf1和orf2基因后,桔霉素含量也显著降低。关于ctnE[12]、ctnG[13]、ctnH[14]、orf6[15]和orf7[16]基因在桔霉素代谢途径中的作用已相继报道。【研究切入点】因桔霉素、红曲色素和洛伐他汀皆属于聚酮合酶(PKS)途径的代谢产物,敲除相关基因后大多导致桔霉素和洛伐他汀同时降低,效果并不理想。为达到在消除桔霉素的同时不降低药用成分的目标,继续筛选优良菌株和功能基因非常重要。【拟解决的关键问题】通过比较基因组分析可以检测多种基因组变异,分析物种进化等[17],弄清基因组变异位点。因此,对紫色红曲霉诱变后,筛选获得桔霉素含量差异显著的菌株,通过分析其基因组变异位点,将为挖掘桔霉素代谢重要调控基因和调控途径奠定基础。
1 材料与方法
1.1 材料
紫红曲霉(Monascuspurpureus)和枯草芽孢杆菌(Bacillussubtilis)分别由贵州中医药大学生药学实验室和微生物与免疫学实验室提供。桔霉素标准品和桔霉素ELISA试剂盒购自上海纪宁实业有限公司。
1.2 诱变及形态观察
将培养7 d的红曲霉平板开盖,在15 W紫外灯下距离30 cm处照射10 min,然后往培养皿中加入无菌水冲刷孢子,得到的孢子悬液再用无菌水进行梯度稀释,从获得的每个稀释梯度吸取500 μL均匀涂布于沙氏培养基上,30℃培养24 h,挑取单孢子菌株转接到沙氏培养基上25℃培养7 d。筛选形态变异较大的菌株用粘片法进行显微形态观察,剪取小块透明胶带粘取少量菌丝放于载玻片上,在胶带上滴1滴无菌水后盖上盖玻片,在显微镜下观察各单孢子菌株的显微形态特征。
1.3 抑菌活性测定
将枯草芽孢杆菌在LB液体培养基中振荡培养活化12 h,待OD600值约为0.6时,取细菌悬液500 μL涂布LB平板。称取45℃烘干的红曲霉菌丝体0.100 g于三角瓶中,加入10 mL乙酸乙酯,封口后置于28℃摇床中140 r/min萃取2 h。用灭菌滤纸片在萃取液中浸泡24 h后取出晾干,然后放置在枯草芽孢杆菌涂布的LB平板上,每块平板内等距离放3片滤纸作为平行对照,乙酸乙酯作为阴性对照。
1.4 化学成分含量测定
1.4.1 红曲色素的色价 参照文献[18]的方法,取液态发酵菌丝体在45℃烘干后研碎,精密称取0.100 g菌丝体粉末于10 mL具塞试管,加入10 mL70%乙醇摇匀,60℃水浴1 h,取出冷却后过滤,滤液用70%乙醇稀释,测定OD505值。红曲色素色价(U/g)=(OD505×稀释倍数×浸提溶剂体积)/样品质量。
1.4.2 洛伐他汀吸光值 参照文献[19]的方法,取1 mL发酵液于50 mL三角瓶,加入9 mL70%乙醇振荡混匀,放入恒温振荡器,28℃下140 r/min振荡1 h后取出,在4 200 r/min离心5 min,精密量取1 mL上清液,加入9 mL 70%乙醇定容至10 mL,测定OD237吸光度值。
1.4.3 桔霉素含量 称取菌丝体粉末0.050 0 g,加入2 mL甲醇于具塞扁形瓶中超声8 min后,取1 mL悬浊液加入2 mL离心管中,12 000 r/min离心5 min,取样品上清液采用桔霉素 ELISA试剂盒进行测定。桔霉素标准曲线按照ELISA试剂盒制作。
1.5 基因组测序分析
选取桔霉素含量差异较大的红曲霉变异菌株与野生型(WT)菌株提取DNA,送诺禾致源生物技术公司进行基因组测序,每个菌种同时测3次重复,以野生型菌株为对照进行比较基因组分析。
2 结果与分析
2.1 变异菌株的形态特征
紫外诱变后从中分离出100余个红曲霉单孢子菌株。由图1可见,从培养7 d的形态上看,变异红曲霉菌株的性状变化较大,有黄色、棕色、红色和白色等多种颜色,菌落质地有的疏松,有的致密;菌丝有绒状、絮状和毯状,分泌色素有的非常明显,有的很少。菌落边缘不齐整,有的菌落出现不同形态的角变,表现出丰富的变异特征。可见,UV诱变产生效果较明显,便于进一步筛选有益变异株。但各变异菌株的显微形态结构(400×)并无明细变化,推测UV诱变对红曲霉的代谢影响较大。

注:显微检测400×。Note:Micro-examination 400×.图1 部分变异红曲霉菌株的形态特征Fig.1 Morphological characteristics of some variation Monascus purpureus strains
2.2 变异菌株的抑菌活性
桔霉素抑菌结果显示,各红曲霉菌株的乙酸乙酯提取物对枯草芽孢杆菌普遍有抑菌作用,其中1YM10的抑菌圈直径较大为1.97 cm,3YM29-1和1YM5的抑菌圈直径较小为1 cm(图2)。推测,1YM10的桔霉素含量较高,而3YM29-1和1YM5的桔霉素含量较低。

注:A从上至下:CK、1YM10-1、2YM4;B从上至下:CK、1YM10、3YM29-1、1YM13;C从上至下:CK、3YM5、1YM5;D从上到下:CK、3YM20、2YM10;每个样品3次重复。Note:A from top to bottom respectively indicates CK,1YM10-1 and 2YM4;B from top to bottom indicates CK,1YM10,3YM29-1 and 1YM13 ;C from top to bottom indicates CK,3YM5 and 1YM5 ;D from top to bottom indicates CK,3YM20 and 2YM10.Each sample with three replicates.图2 部分菌株提取物对枯草芽孢杆菌的抑菌活性Fig.2 Bacteriostatic activity of the extracts from some strains against Bacillus subtilis
2.3 变异菌株的化学成分
为进一步获得高产色素和洛伐他汀且桔霉素含量降低的变异菌株,筛选其中7株颜色变异较小的菌株进行化学成分含量检测显示,野生型的桔霉素含量较高,达1.673 ng/mL,其余菌株的桔霉素含量普遍降低,其中菌株3YM29-1和1YM10的桔霉素含量最低,分别为0.309 ng/mL和0.400 ng/mL,降幅分别达81.53%和76.09%(图3)。虽然变异菌株的桔霉素含量降低,但洛伐他汀和色素的含量无同步变化趋势,这可能与突变的随机性和不确定性有关。1YM10的抑菌圈较大与桔霉素含量较低的结果并不一致,推测红曲霉提取物的抑菌活性由多种化学成分共同作用。
2.4 菌株的比较基因组测序
1YM10和3YM29-1的桔霉素含量消减效果较高,其基因组测序得出。野生型平均获得Clean reads 21 717 777 bp,比对到参考基因组上(NCBI GenBank assembly accession:GCA_006542485.1)20 279 634 bp,比对率93.36%,测序深度109.87倍,覆盖度大于99%;1YM10平均获得Clean reads 17 160 064 bp,比对到参考基因组上15 989 053 bp,比对率93.18%,测序深度82.91倍,覆盖度大于99%;3YM29-1平均Clean reads 21 906 496 bp,比对到参考基因组上20 384 768 bp,比对率93.04%,测序深度111.05倍,覆盖度大于99%(表1)。获得的基因组数据能够满足比较分析的需要。
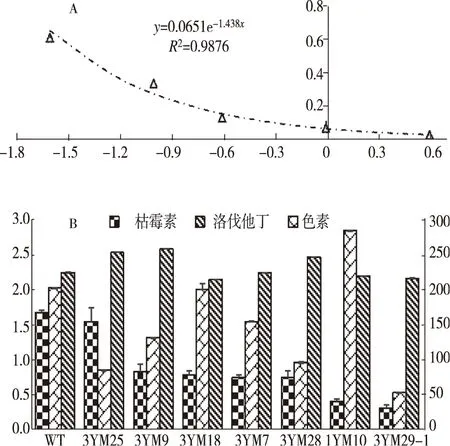
注:A 桔霉素标准曲线;B 部分菌株化学成分含量。Note:Figure A indicates the standard curve of citrinin;Figure B indicates the chemical composition content of some strains.图3 桔霉素标准曲线及部分菌株化学成分测定Fig.3 The standard curve of citrinin and chemical composition of some strains

表1 红曲霉比较基因组测序数据Table 1 Sequencing data of comparative genome of Monascus purpureus
2.5 菌株的变异位点
与参考基因组相比,9个红曲霉基因组序列上找到2 066个SNP位点和978个InDel位点,其中杂合型位点野生型有394个,1YM10有238个,3YM29-1有165个,说明各菌种的基因组并未纯合稳定,大量变异位点仍处于杂合状态,这可能是导致培养的红曲菌落有角变的重要原因。与野生型菌株相比(图4),变异菌株1YM10有47个SNP和5个InDel位点,其中15个SNP导致氨基酸变异。变异菌株3YM29-1有28个SNP和13个InDel位点,其中10个SNP导致氨基酸变异。2株变异菌株存在18个SNP和4个InDel位点共有,其中仅7个SNP位点导致氨基酸变异,涉及4个蛋白序列(表2),其中MPDQ_005104可能是磷酸转移酶家族蛋白,MPDQ_001120可能是胞外复合体亚基sec-15类似蛋白,而MPDQ_005758(81个氨基酸)和MPDQ_006301(175个氨基酸)在UniProt和NCBI无高度同源序列,功能未知。
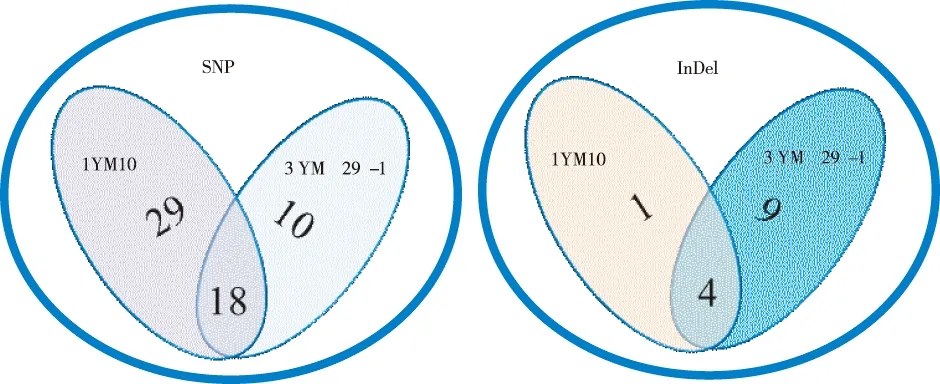
图4 比较基因组SNP(左)和InDel(右)变异位点Fig.4 Mutation site comparative genomic SNP (left)and InDel (right)mutation site
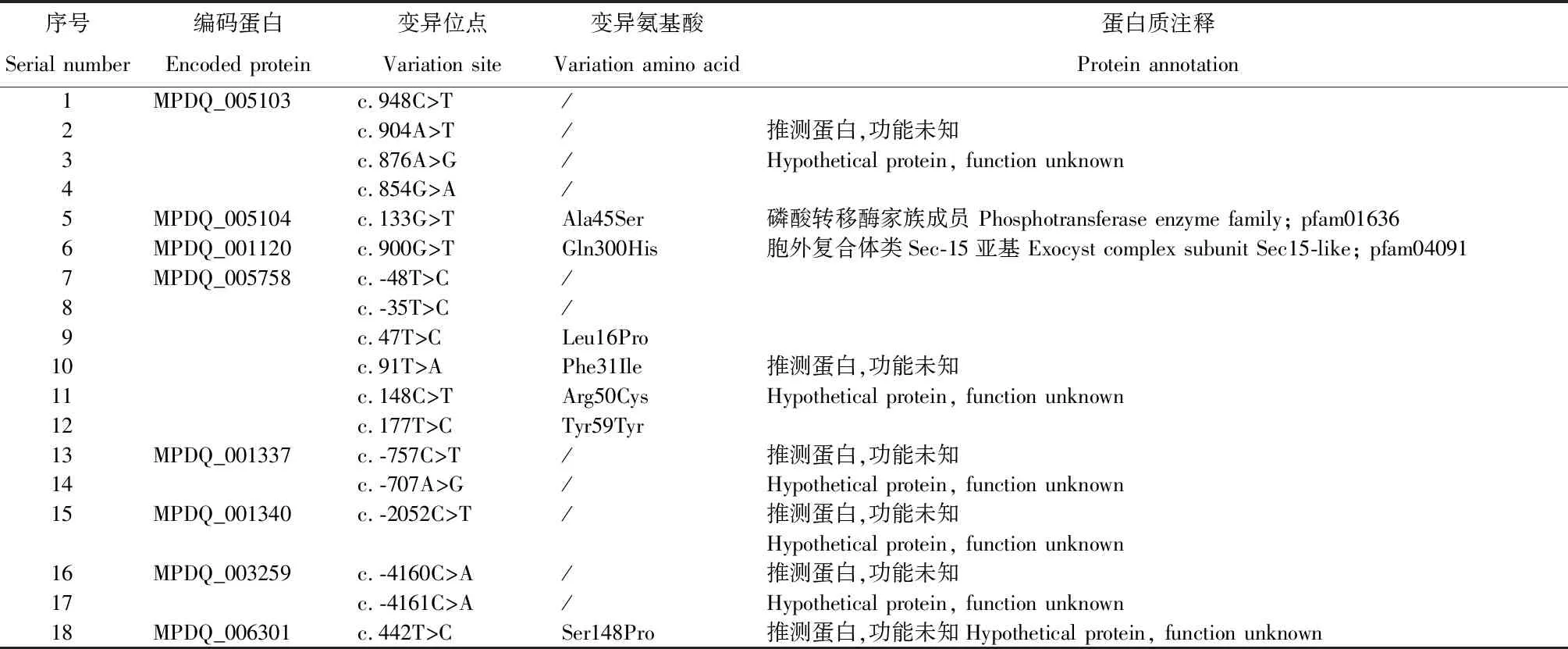
表2 变异菌株共有SNP位点分析Table 2 Analysis of common SNP sites of variation strains
3 讨论
红曲霉作为许多重要药食两用产品的菌种,对其桔霉素含量的控制尤为重要。桔霉素有抑菌作用,可通过有机试剂萃取红曲霉的化学成分,采用滤纸片法检测其对枯草芽孢杆菌的抑菌活性,以初步检验各变异菌株的桔霉素含量[20]。有研究表明,桔霉素、红曲色素和洛伐他汀皆源于聚酮合酶合成途径,3种成分的含量存在一定的相关性[21]。如何既保证有较高含量的功能性成分,又最大限度消减桔霉素,是亟待解决的关键问题。
试验对紫外诱变的红曲霉菌株进行形态和化学成分分析发现,各化学成分的含量变异具有随机性,可以获得桔霉素大幅降低而洛伐他汀和红曲色素含量不降的菌株,从而打破三者的连锁关系,说明合成3种成分的分支代谢途径不同。通过筛选获得桔霉素含量比野生型菌株降低81.53%和76.09%的菌株3YM29-1和1YM10,但1YM10菌株对枯草芽孢杆菌的抑菌活性却很高,推测与高含量的红曲色素有关。因为红曲色素作为食品添加剂也有防腐抑菌的作用[22-23],可见抑菌活性不能简单作为桔霉素含量高低的定性检测方法。
比较基因组分析发现,3YM29-1、1YM10和野生型菌株均有许多杂合位点,推测这些杂合位点有的会在形态上表现出来,从而在培养和传代的菌落上产生角变,这与红曲菌落有角变的现象相符。与野生型相比,变异菌株3YM29-1和1YM10仅7个共有的SNP位点导致4个蛋白序列出现氨基酸变异。之前尚无关于这4个蛋白序列与桔霉素代谢关系的类似报道[24]。
4 结论
通过对紫色红曲霉诱变处理,筛选出桔霉素含量降低81.53%的突变菌株3YM29-1。经比较基因组分析,获得4条功能变异蛋白,分别为磷酸转移酶家族蛋白、胞外复合体亚基sec-15类似蛋白,以及2条未知序列。获得的低桔霉素变异菌株和挖掘的新基因为深入开展桔霉素调控研究奠定基础。

