肝细胞肝癌的免疫治疗现状及研究进展①
吴虹霖 牛翔科 熊 燕 陈志凡 彭 涛
(成都大学附属医院放射科,成都610081)
原发性肝癌在最常见癌症中位居第六,在癌症相关性死亡中位居第四。2018年,全球新增原发性肝癌患者约84.1万例,肝癌相关死亡人数达78.2万,其中我国新增原发性肝癌患者约46.6万例,肝癌相关死亡人数达42.2 万。肝细胞肝癌(hepatocellular carcinoma,HCC)占原发性肝癌约75%~85%,多数HCC 患者确诊时已处于晚期,失去外科手术机会,且预后较差,五年总生存率(overall survival rate,OSR)仅为10%~18%。HCC 主要治疗手段包括手术切除、肝移植、经导管动脉化疗栓塞术(transarterial chemoembolization,TACE)和射频消融术(radiofrequency ablation,RFA),辅以全身性化疗、靶向药物治疗等,但针对无法切除的中晚期HCC 患者可供选择的治疗方式非常有限,亟待新的治疗策略。近年,随着肿瘤免疫治疗临床试验广泛开展,肿瘤免疫疗法初现成效,目前针对中晚期HCC 的免疫治疗已成为研究热点。本文将对HCC 免疫治疗的研究现状与进展进行概述,包括肿瘤疫苗、细胞因子、过继性细胞疗法(adoptive cell therapy,ACT)、免疫检查点抑制(immune checkpoint blockage,ICB)、溶瘤病毒和溶瘤细菌等治疗方法(图1)。
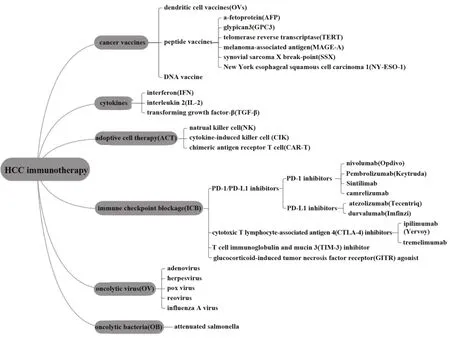
图1 HCC免疫治疗策略Fig.1 Immunotherapy strategies for HCC
1 肿瘤疫苗
肿瘤免疫疫苗法主要采用肿瘤细胞、肿瘤相关蛋白或相关肽(tumor-related antipeptide,TUMAP)、肿瘤相关抗原(tumor-associated antigens,TAAs)的表达基因等对患者进行免疫接种,促使机体产生持续抗肿瘤免疫反应。HCC 疫苗主要包括:树突状细胞(dendritic cell,DC)疫苗、多肽疫苗及DNA 疫苗。
1.1 DC 疫苗 DC 是机体抗原递呈能力最强的细胞,在激活T细胞免疫中至关重要,尤其是作用于抗原特异性细胞毒性T 细胞(cytotoxic T lymphocyte,CTL)[1]。其主要抗肿瘤机制为:①诱导机体产生大量效应T 细胞;②促进效应T 细胞迁移,并聚集于肿瘤区域;③维持已趋化的效应T 细胞长期滞留于肿瘤区域;④促进细胞因子分泌;⑤抑制肿瘤血管生成。同时,通过测量体内抗原特异性T 细胞反应可监测DC 疫苗抗肿瘤免疫效果。一项荟萃分析发现,以DC 免疫治疗作为HCC 辅助治疗的效果较好,DC 疫苗不仅增强了HCC 患者抗肿瘤免疫反应,提高了生存率,延长了生存期,且安全可行[2]。MIZUKOSHI 等[3]研究发现,与单纯接受经导管动脉栓塞术(transhepatic arterialembolization,TAE)治疗相比,接受TAE+DC 灌注治疗后患者特异性T 淋巴细胞应答与肿瘤特异性免疫应答增强。HCC 患者手术切除/RFA/TACE/经皮无水酒精注射治疗后辅以DC免疫治疗发现,DC疫苗辅助治疗可明显降低非RFA组患者肿瘤复发风险;免疫治疗组肿瘤特异性免疫应答明显增强[4]。不考虑初始治疗方式前提下,HCC 各种常规治疗辅以DC 或细胞因子诱导杀伤细胞(cytokine-induced killer cell,CIK)单药治疗及DC+CIK 联合免疫治疗可明显改善患者预后,提高OSR和减少肿瘤复发[5]。其中,DC 单药治疗可有效改善1年OSR。DC 疫苗作为HCC 辅助治疗方法已逐步用于临床。
1.2 多肽疫苗 多肽疫苗采用TAAs 呈递给主要组织相容性复合体(major histocompatibility complex,MHC)分子诱导抗肿瘤免疫反应,促使具有肿瘤特异性的T 细胞活化和增殖。目前TUMAP 和TAAs主要包括甲胎蛋白(α-fetoprotein,AFP)和磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)、端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和黑色素瘤相关抗原(melanoma-associated antigen,MAGE-A)、滑膜肉瘤X 断裂点基因(synovial sarcoma X breakpoint,SSX)、纽约食管鳞状上皮癌抗原1(New York esophageal squamous cell carcinoma 1,NY-ESO-1)。此外,来自特殊基因变异的肿瘤新生抗原也可诱导抗肿瘤免疫反应。肿瘤新生抗原是指由肿瘤基因突变而编码出的新的未知蛋白或多肽,具有良好特异性、更高异质性和可识别性。
1.2.1 AFP AFP 免疫抑制假设是基于发育胚胎血清中AFP 高水平可保护胚胎免受母体免疫攻击。AFP 可分为L1、L2 和L33 个亚型,AFP-L3 对凝集素的亲和力最高,最常见于HCC 患者。临床上,AFPL3/AFP 比值被广泛用作HCC 患者早期诊断和预后评价。HCC 发展过程中,患者AFP 值升高,高水平AFP 可能导致DC 凋亡和功能障碍,抑制NK 细胞和T 淋巴细胞增殖,从而促进肿瘤细胞免疫逃避和肿瘤进展[6]。多项研究表明,AFP 可作为HCC 免疫治疗新靶点。PANG 等[7]发现,负载人AFP 肽段的树突状细胞(human AFP-derived peptide-pulsed dendritic cells,hAFP-DCs)可有效提高小鼠抗HCC 免疫力,hAFP-DCs组小鼠均存活,而对照组则死亡,证实了hAFP-DCs 的HCC 抑制作用。刘扬等[8]发现,注射AFP 特异性CD8+T/CD4+T 淋巴细胞疫苗可有效抑制HCC生长。一项Ⅰ期临床试验研究发现,15例晚 期HCC 患者皮下注射AFP 衍生肽(AFP357 和AFP403),其中1 例完全缓解(complete remission,CR),8 例病情稳定(stable disease,SD),并在4 例患者中检测到AFP357特异性CD8+T细胞,证实AFP衍生肽作为晚期HCC 患者的抗肿瘤疫苗安全有效,AFP 可诱导产生特异性T 细胞受体[9]。一项最新动物实验发现,AFP158 特异性小鼠T 细胞受体基因可诱导人类T 细胞特异性识别和杀伤HCC 肿瘤细胞,以达到抗肿瘤效果[10]。2020年国际肝病大会(ILC)公布了基于T 细胞的首款HCC 新型TCR-T 疗法ADP-A2AFP 研究结果,发现1 例患者达到CR,且所有患者AFP 水平均下降,证实靶向AFP 的T 细胞疗法可杀死AFP 表达阳性肿瘤细胞。因此,尽管AFP免疫原性较弱,且可通过抑制DC、NK 细胞和T 淋巴细胞功能诱导免疫逃逸,但体外修饰的AFP 免疫原性和免疫应答得以增强,尤其是经AFP 修饰的疫苗对AFP 表达阳性的肿瘤细胞表现出特异性抗肿瘤免疫,为HCC 免疫治疗奠定了较好基础并表现出巨大潜力[11]。
1.2.2 GPC3 GPC3 主要存在于肝癌细胞细胞膜和细胞质,在正常成年人其他细胞中几乎不表达[12]。GPC3 可从细胞膜锚定基团上游离并释放至外周血,形成可溶性GPC3。GPC3 是重要的肝癌血清标志物,GPC3 对肝癌的诊断敏感性高于AFP,且与不良预后密切相关。GPC3 与其他标志物联合可进一步提高肝癌诊断准确率,如热休克蛋白70(heat shock protein 70,HSP70)+GPC3+谷氨酰胺合成酶(glutamine synthetase,GS)多项标记物组合可特异性区分肝细胞再生结节、早期肝癌和小肝癌(AFP表达阴性),特异性可达100%[13-16]。GPC3作为一种癌胚抗原,在占比约81% 的HCC 中特异性过表达。因此,GPC3 有望成为HCC 免疫治疗的理想靶点。采用GPC3 疫苗治疗晚期HCC 的Ⅰ期临床试验中,共33 例患者接受GPC3 肽剂量递增接种,其中30 例患者产生GPC3特异性CTL 应答,1例部分缓解(partial response,PR),19 例SD 患者中有4 例表现为肿瘤坏死或消退,但未达到PR 标准[17-18]。在多因素分析中,GPC3-肽特异性CTL 的频率是该试验中OSR的唯一预测因素,结果表明,GPC3 衍生肽疫苗具有提高OSR的潜力。随后Ⅱ期临床试验证实GPC3-肽特异性CTL 存在于外周血,且GPC3-肽特异性CTL已浸润至复发肿瘤。与单独接受手术比较,接受手术+接种GPC3 衍生肽疫苗患者肿瘤复发率明显降低[19]。GPC3 衍生肽疫苗表现出较好的抗肿瘤疗效,为HCC免疫治疗提供了新策略。
1.3 DNA 疫苗 DNA 疫苗是应用基因工程技术编码TAAs 和肿瘤特异性抗原(tumor specific antigens,TSAs)的基因,直接或经载体携带后导入机体,使其表达抗原蛋白,诱导机体在一定时限内产生持续性免疫应答,以达到抗肿瘤作用。研究发现,肿瘤DNA 疫苗是治疗恶性肿瘤的有效方式。GPC3 DNA疫苗可有效诱导C57BL/6 小鼠体内特异性抗HCC细胞免疫应答,疫苗组活化的CTL对Hepal-6、HepG2细胞的杀伤率显著高于生理盐水组及空载体组[20]。GPC3 DNA疫苗可能成为HCC免疫治疗中安全有效的新方法。
2 细胞因子
目前用于HCC 治疗的细胞因子主要包括IFN和IL-2 等。IFN-α、IFN-β 和IFN-γ 均可促进HCC 细胞凋亡。研究表明,IFN-α 治疗可提高经根治性切除术后HBV 相关HCC 患者OSR,HCC 患者在根治性切除术后行IFN-α 治疗,治疗组中位生存期为63.8个月,对照组为38.8个月(P=0.0003),中位无病生存期(disease-free survival,DFS)为31.2 个月和17.7个月(P=0.142)[21]。由CD8+Ki67+T细胞分泌的IFN-γ 可延长HCC 患者无进展生存期(progressionfree survival,PFS)和 总 生 存 期(overall survival,OS)[22]。IFN 作为HCC 切除术后的辅助治疗药物已有广泛研究,其总体效果较差且毒性高。此外,有关TGF-β 治疗109 例HCC 患者的临床Ⅱ期试验发现,TGF-β1应答者的OS较无应答者更长[23]。
3 过继性细胞疗法(ACT)
ACT 是指从肿瘤患者体内分离出具有免疫活性的细胞,在体外进行扩增或行肿瘤抗原负载后再回输至患者体内,达到抑制和杀伤肿瘤细胞目的。目前,ACT 以自然杀伤(natural killer,NK)细胞、CIK及嵌合抗原受体T 细胞(chimeric antigen receptor T cell,CAR-T)研究较多。ACT 对抑制肿瘤复发、延长OS 具有重要作用,其作为HCC 术后辅助治疗的疗效颇好。
3.1 NK 细胞 NK 细胞占肝内淋巴细胞的30%~50%,在宿主对抗病毒感染和肿瘤发展的免疫防御中发挥重要作用。NK 细胞功能失调导致HCC 发生是多种机制共同作用的结果,NK 细胞数减少和功能缺陷导致肿瘤细胞逃避免疫监控[24]。近年同种异体NK 细胞免疫治疗被广泛用于各种临床试验。不可逆电穿孔联合异体NK 细胞免疫治疗显著提高Ⅳ期HCC 患者中位总生存率(NCT03008343)[25]。另一项临床试验(NCT01147380)将从供体移植肝灌注液中提取的活化NK 细胞经静脉输注给移植肝受者,以防止受者经肝移植术后出现肝转移和肿瘤复发,该疗法安全性和可行性已在Ⅰ期试验中得到验证[26]。此外,为提高NK 细胞免疫特异性和免疫功效,对NK细胞进行基因修饰的研究也已开展。
3.2 CIK CIK 具有T 细胞和NK 细胞表型,其增殖能力较强,对肿瘤细胞具有特异性,且对正常细胞毒性较小。有关CIK 辅助治疗HCC 的研究较多且疗效较好。一项探讨DC、CIK 细胞免疫治疗联合常规临床治疗疗效的荟萃分析显示,CIK 单药治疗可显著 提 高 患者6个月/1年/3年/5年OSR(P均<0.05)。DC+CIK 联合免疫治疗可提高患者1年及5年OSR(P=0.02,P=0.05),该研究认为DC、CIK 和DC+CIK 联合免疫治疗,结合各种常规治疗,可提高HCC 患者OSR,减少肿瘤复发,明显改善预后[27]。近期研究发现,与具有较低细胞毒活性CIK 细胞患者比较,具有高细胞毒活性CIK 细胞患者无复发生存期(recurrence-free survival,RFS)和OS 显著改善。单因素和多因素分析表明,CIK 细胞的细胞毒性是RFS 和OS 的独立预后因素,提示高细胞毒活性CIK细胞可作为CIK细胞免疫治疗的生物标志物[28]。
3.3 CAR-T CAR-T 采用基因工程技术实现T 细胞受体特异性识别TAAs,提高效应T 细胞靶向性、杀伤活性及持久性,克服并打破宿主免疫耐受。CAR-T 细胞疗法已在血液系统肿瘤治疗中崭露头角,但在HCC 治疗上刚刚起步,是治疗HCC 的新兴免疫治疗手段之一。SUN 等[29]研究发现,NKG2DBBz CAR-T 细胞在体内外均可有效清除NKG2DL 高表达的HCC 细胞。HCC 患者源性异种移植模型中,GPC3-CAR T细胞具有肿瘤清除作用[30]。近期CARGPC3 T 细胞治疗晚期HCC Ⅰ期临床试验(NCT02395250、NCT03146234)发现,13 例受试者中2 例获得PR,6 个月、1年、3年OSR 分别为50.3%、42.0% 和10.5%,初步证实CAR-GPC3 T 细胞治疗的安全性,并初步展现较好的临床效果,为CAR-T细胞治疗HCC积累了宝贵经验[31]。
4 ICB
免疫细胞上表达并调节免疫激活程度的共刺激/共抑制分子称为免疫检查点,目前主要以细胞程序性死亡受体-1(programmed cell death protein-1,PD-1)/PD-L1 和细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)为治疗靶点,T细胞免疫球蛋白黏液素3(T cell immunoglobulin and mucin 3,TIM-3)和糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)也是备受关注的免疫检查点之一。目前,针对HCC 治疗的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)不断绽放异彩,部分ICIs先后获得FDA及HCC指南一致认可。
4.1 PD-1/PD-L1 抑制剂 PD-1 主要表达于活化的T 细胞、B 细胞和巨噬细胞表面,通过与其配体PD-L1和PD-L2结合抑制抗原特异性T细胞活化[32]。当肿瘤细胞表面高表达的PD-L1 与免疫细胞表面PD-1 结合时会导致肿瘤免疫逃逸[33]。而ICIs 通过阻断PD-L1、PD-L2与PD-1结合抑制下游信号通路,使肿瘤浸润淋巴细胞恢复杀伤活力,促进T 细胞识别和杀伤肿瘤细胞。PD-1 抑制剂包括纳武单抗(Nivolumab,商品名:Opdivo)、帕博利珠单抗(Pembrolizumab,商品名:Keytruda)以及国产信迪利单抗(Sintilimab,商品名:达伯舒)和卡瑞利珠单抗(Camrelizumab,商品名:艾瑞卡)。PD-L1 抑制剂有阿替利珠单抗(Atezolizumab,商品名:Tecentriq)和度伐利尤单抗(Durvalumab,商品名:Imfinzi)。
4.1.1 纳武单抗(Nivolumab) 2017年9月,Nivolumab被FDA批准为晚期HCC二线用药,用于索拉非尼(Sorafenib)治疗后复发或不耐受的晚期HCC患者。Nivolumab 疗效不受既往Sorafenib 治疗状况影响。CheckMate 040Ⅰ/Ⅱ期临床试验显示,给予214例患者(扩展组)每2 周1 次3 mg/kg Nivolumab 治疗,患者整体客观缓解率(objective response rate,ORR)为20%,疾病控制率(disease control rate,DCR)为64%,中位缓解持续时间(median duration of response,mDOR)为9.9 个月,患者6 个月OSR 为83%、9 个月OSR为74%,6个月和9个月无进展生存率为37%和28%[34]。随后Nivolumab 与Sorafenib 用于一线治疗晚期HCC 的随机大样本多中心Ⅲ期临床试验(CheckMate 459)发现,与Sorafenib 比较,Nivolumab可改善患者OS(16.4 个月vs 14.7 个月)和ORR(15% vs 7%),但OS 未达到预期阈值(P=0.0752),提示与Sorafenib相比,Nivolumab可能有效性和安全性更高[35]。
4.1.2 帕博利珠单抗(Pembrolizumab) Pembrolizumab在治疗晚期HCC中的疗效卓越。一项非随机多中心Ⅱ期临床试验(NCT02702414)发现,Pembrolizumab 用于曾接受过Sorafenib 治疗的晚期HCC 患者有效且可耐受,1 例患者(1%)CR 和17 例患者(16%)PR,同时46 例患者(44%)SD,提示Pembrolizumab 有望成为新的治疗选择。为进一步评估PFS和OS,Pembrolizumab 作为晚期HCC 治疗二线药物的Ⅲ期随机试验(NCT02702401)正在进行。2020年美国临床肿瘤学会(ASCO)公布了KEYNOTE-524研究最新结果:OS 达22 个月,ORR 达46%,证实仑伐替尼(Lenvatinib)联合Pembrolizumab 治疗不可切除的晚期HCC疗效优异。
4.1.3 信迪利单抗(Sintilimab) 一项案例报道,给予不可切除的HCC 患者Sintilimab 治疗诱发自身免疫性糖尿病,给予胰岛素治疗且血糖控制良好前提下,继续给予Sintilimab 治疗,最终达到PR,获得较好抗肿瘤反应。该报道建议在免疫治疗中药物毒性可控的前提下,如果存在有效抗肿瘤反应,应考虑继续使用PD-1抑制剂[36]。
4.1.4 卡瑞利珠单抗(Camrelizumab) Camrelizumab 是我国制药企业自主研发并在国内首个获批的PD-1 抑制剂。国内多中心开展的Camrelizumab治疗晚期HCC的Ⅱ期临床试验中,217例患者每2周或3周接受1次Camrelizumab 治疗(3 mg/kg,静滴),患者ORR 为14.7%,6个月OSR 为74.4%,其中22%患者发生与治疗相关的3/4 级不良事件。Camrelizumab 在我国晚期HCC 患者中表现出抗肿瘤活性,且毒性可控,可能成为新的治疗选择[37]。
4.1.5 阿替利珠单抗(Atezolizumab) Atezo+贝伐珠单抗(Bevacizumab,商品名:Avastin)用于未经系统治疗或不可切除的HCC患者的一项Ⅰb期研究临床试验中,与Atezo单独用药比较,Atezo+Bev联合治疗组中位PFS(5.6个月vs 3.4个月)显著改善。A组主要终点ORR 为36%,76% 患者为持续缓解中(RECIST 1.1),提示Atezo+Bev 免疫联合方案有望成为不可切除HCC 患者的一线治疗选择[38]。Atezo+Bev 联合治疗组和Atezo单药组中分别有12%和3% 患者出现治疗相关严重不良事件[39]。Atezo+Bev与Sorafenib治疗对比的Ⅲ期临床试验正在进行。
4.1.6 度伐利尤单抗(Durvalumab) 一项治疗晚期HCC的多中心Ⅱ期临床试验(NCT02519348)正在进行,目的是评估Durvalumab或替西木单抗(Tremelimumab)单药治疗及Durvalumab+Tremelimumab/Bevacizumab 联合治疗晚期HCC 的安全性、耐受性、抗肿瘤活性、药代动力学、药效学和免疫原性,该研究预计在2021年1月完成。 此外,雷莫芦单抗(Ramucirumab,商品名:Cyramza)+Durvalumab(MEDI4736)用于晚期HCC 患者的Ⅰ期临床试验(NCT02572687)已完成招募工作,目的是分析患者用药安全性与耐受性。
4.2 CTLA-4 抑制剂 CTLA-4 与抗原提呈细胞上的B7-1/B7-2 分子结合后传递抑制信号,诱导T 细胞无反应性,进而抑制抗肿瘤免疫应答。CTLA-4抑制剂可阻断CTLA-4 与B7 分子结合,恢复T 细胞活性,提高机体抗肿瘤能力。CTLA-4抑制剂有易普利单抗(Ipilimumab,商品名:Yervoy)和Tremelimumab。Ipilimumab是首个获FDA批准的ICI。Tremelimumab是一种完全阻断CTLA-4 与配体结合的人IgG2 单克隆抗体,并通过多种机制增强T 细胞活化和增殖。Tremelimumab 抗HCC 初次试验发现,PR 为17.6%,DCR 为76.4%,疾病进展时间为6.48 个月,Tremelimumab 用于晚期HCC 患者的安全性、抗肿瘤和抗病毒活性得以验证[40]。 Tremelimumab 联合TACE、RFA、冷冻消融术治疗HCC 或胆道癌的初步研究结果值得期待(NCT01853618)。
4.3 TIM-3 抑制剂 TIM-3 在辅助性T 细胞1(T help 1,Th1)和CTL细胞上高表达,与半乳糖凝集素-9(Galectin-9,Gal-9)特异性结合后促使Th1 和CTL 细胞凋亡。TIM-3 通过负调节T 细胞免疫抑制抗肿瘤免疫。TIM-3 可在HCC 组织肿瘤细胞、肿瘤浸润性T 细胞(tumor infiltrating lymphocyte,TIL)、调节性T 细胞(regulatory T cells,Tregs)和肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)中异常表达,促进肿瘤发生发展[41-42]。TIM-3 已成为HCC 治疗的有前景靶点。TIM-3也可用于评价HCC预后和疗效。TIM-3 在HCC 组织中高表达常提示预后不良[42]。接受治疗后CR 患者血清TIM-3值高于PR 患者[43]。最新研究发现,血清TIM-3 水平与不同类型肝病患者HCC 分期密切相关,此外,TACE 治疗可导致循环TIM-3 水平升高,认为TIM-3 可能在患者接受TACE 治疗后的抗肿瘤免疫中发挥作用,为联合免疫治疗和化疗栓塞奠定基础[43]。
4.4 糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)激动剂 GITR 激动剂单抗通过激活共刺激途径增强抗肿瘤免疫反应,成为肿瘤免疫治疗新靶点。临床前研究数据显示,GITR激动剂单抗在体内外表现出抗肿瘤活性,GITR 激动剂单抗可促进CD8+和CD4+效应T 细胞活性,抑制肿瘤浸润T 细胞活性。Ⅰ期临床试验报告GITR激动剂单抗(TRX518)单药治疗晚期癌症患者的安全性和免疫效应(NCT01239134)[44]。GITR 激动剂单抗和PD-1 抑制剂联合疗法的作用机制已被证实,联合PD-1/PD-L1抑制剂治疗可能克服肿瘤对抗GITR 单药耐药[44-45]。与GITR 激动剂单抗单药治疗晚期HCC 相比,GITR联合PD-1 抑制剂Nivolumab 进一步增强部分HCC患者TIL 肿瘤抗原特异性反应[46]。但GITR 激动剂单抗的安全性、药代动力学、药效学和免疫效应需进一步验证。一些临床研究正在进行中,需等待结果公布(NCT02628574、NCT03126110、NCT02740270、NCT03799003)。
ICIs在抑制肿瘤免疫逃逸同时破坏检查点分子在免疫稳态中发挥的关键作用,可能导致免疫相关不良事件(immune-relatedadverse events,irAEs),主要发生于皮肤、消化系统、内分泌腺。HCC患者ICIs治疗中,15%~30% 接受Nivolumab 的患者、8%~10%接受Pembrolizumab的患者以及17%~29%接受Nivolumab+Ipilimumab 联合治疗的患者出现皮疹,20%~27% 接 受Nivolumab 的 患 者、12%~18% 接 受Pembrolizumab 的患者和30%~45% 接受Nivolumab+Pembrolizumab 联合治疗的患者出现瘙痒,患者腹泻发生率为11%(Pembrolizumab 单药治疗)、14%(Nivolumab 单药治疗)、12%~24%(Nivolumab+Ipilimumab联合治疗)及12%(Durvalumab+Tremelimumab联合治疗)。 患者AST 增高发生率为9%~10%(Nivolumab 单药治疗)、9%~14%(Pembrolizumab 单药治疗)、13%~20%(Nivolumab+Ipilimumab 联合治疗)和17.5%(Durvalumab+Tremelimumab 联合治疗),甲状腺功能减退发生率为5%~7%(CTLA-4 抑制剂单药治疗)、7%~11%[PD-(L)1 抑制剂单药治疗]及10%[CTLA-4+PD-(L)1 抑制剂联合治疗]。尽管irAEs 发生往往提示疗效及预后良好,但对irAEs的早期识别和相应处理决策仍需探讨,以达到机体免疫平衡状态[47]。
5 溶瘤病毒和溶瘤细菌
5.1 溶瘤病毒 溶瘤病毒具有直接裂解肿瘤细胞、诱发并增强机体对肿瘤的特异性免疫应答、增强其他抗肿瘤药物效果等多种作用,但不影响正常细胞生长。与传统治疗方法相比,其特异性强、副作用小、在多种肿瘤联合免疫疗法中疗效显著[48]。通过基因修饰/改造的溶瘤病毒在HCC 治疗领域备受关注。目前用于治疗HCC 的溶瘤病毒主要有包括腺病毒、疱疹病毒和痘病毒等。
利用间充质干细胞(MSCs)的肿瘤归巢特性,外源性静脉注射由肝癌溶瘤腺病毒(HCC-oAd)转染的MSCs,即肝癌靶向载溶瘤腺病毒MSCs(HCC-oAd/MSC),正常氧和缺氧条件下均能有效体外裂解HCC 细胞[49]。研究发现,重组腺病毒可有效诱导细胞凋亡,抑制肿瘤转移,进一步动物实验表明,新型溶瘤腺病毒还能有效抑制肝癌干细胞移植瘤生长,延长小鼠生存期[50]。
T-Vec 是一种由1 型单纯疱疹病毒通过基因工程改造的溶瘤病毒,瘤内注射T-vec 和/或RFH 治疗裸鼠HCC 发现,无论体外实验还是体内实验,当T-vec 和RFH 联合治疗时,HCC 细胞存活率均降低;体内实验中联合治疗组肿瘤体积最小[51]。小鼠皮下、原位和腹腔肿瘤转移模型(BALB/cnu/nu)中,第三代溶瘤单纯疱疹病毒1 型(HSV-1)T-01 对人肝癌细胞系和肝母细胞瘤细胞系形成的肿瘤有生长抑制作用,表明T-01可作为HCC治疗的新方法[52]。
Pexa-Vec(JX-594)是一种溶瘤性和免疫治疗性牛痘病毒,在Ⅰ期临床试验中Pexa-Vec(JX-594)静脉注射和瘤内给药均具有良好耐受性[53]。随后的Ⅱ期临床试验中,Pexa-Vec(JX-594)治疗HCC 肝内反应率为62%,高剂量给药组与低剂量给药组中位生存期分别为14.1个月及6.7个月,初步验证Pexa-Vec(JX-594)对HCC治疗具有一定疗效[54]。 为证实与Sorafenib 单药治疗HCC 相比,采用Pexa-Vec+Sorafenib治疗是否能有效提高患者生存率的Ⅲ期临床试验(NCT03071094)正在进行。另外,Pexa-Vec+Nivolumab 用于一线治疗晚期HCC 的安全性和有效性研究已完成,其临床结果值得期待(NCT03071094)。
此外,临床级别溶瘤呼肠孤病毒可抑制HCV 复制,对HCC 临床前模型有效,可作为支持和补充HCV 相 关HCC 治 疗 的 替代 药物[55]。 研 究发 现,delNS1 GM-CSF 病毒以剂量依赖性方式显著抑制肿瘤生长。体外实验结果表明,delNS1-GM-CSF 对肝癌临床标本有抑制作用,再次验证甲型流感病毒可能具有成为抗肝癌溶瘤病毒治疗剂的潜力[56]。
5.2 溶瘤细菌 通过基因工程手段构建编码的减毒沙门菌经静脉导入机体后,可特异性靶向作用于肿瘤细胞,并通过消耗肿瘤细胞存活所必需的甲硫氨酸破坏肿瘤内部微环境达到杀伤肿瘤的目的。腹腔注射携带凋亡抑制基因Survivin 的特异性siRNA 减毒沙门菌可明显抑制裸鼠皮下HCC 移植瘤生长,其机制可能与细胞凋亡有关[57]。溶瘤病毒和溶瘤细菌作为新的肿瘤免疫治疗方法,正处于临床研究早期阶段,展现出巨大潜力。
6 结语
综上所述,用于HCC 的免疫治疗研究逐渐增多并不断取得进步,将使越来越多晚期HCC 患者获益。治疗药物间相互作用、药物最优剂量与给药方式值得进一步探究。多种免疫治疗组合的免疫联合方案及将免疫治疗与传统治疗结合的治疗策略是未来发展方向。亟待更多大样本多中心研究促进HCC免疫治疗发展,以探求最优治疗决策。