肿瘤环境下腺苷受体通路的免疫功能及临床意义①
胡英豪 左 坚 陶梦情 罗佳佳 王 秀
(皖南医学院中西医结合研究中心,芜湖241000)
腺苷是一种广泛分布的内源性核苷,主要由细胞内三磷酸腺苷(triphosadenine,ATP)降解而成。当机体组织处于缺血、缺氧、炎症、创伤等状态时,胞外腺苷迅速升高,以保护组织免受过度炎症损伤,并促进组织损伤后修复[1]。由于肿瘤患者体内长期存在缺氧与慢性炎症的微环境,胞外腺苷稳定处于高水平状态,这一现象导致相应的G 蛋白偶联受体持续过度激活,从而表现出免疫耐受的基本特征,进而直接促进了肿瘤细胞的增殖与转移[2]。基于上述现象,现代学者进行了大量的相关研究。本文就相关研究的进展及临床意义进行总结,以启发开展后续的机制研究与临床应用。
1 腺苷的代谢
在正常组织中,腺苷因其快速的分解代谢及利用环路,保持低浓度水平。腺苷的生成途径有:①ATP 通过CD39 转化为单磷酸腺苷(adenosine monophosphate,AMP),AMP 在CD73 的去磷酸化作用下生成腺苷;②S-腺苷同型半胱氨酸(S-adenosyl homocysteine,SAH)在S-腺苷同型半胱氨酸水解酶(S-adenosyl homocysteine hydrolase,SAHH)的作用下可逆性生成腺苷;③在某些癌症中,由补救途径释放的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)通过CD38-CD203a-CD73途径水解为腺苷[3-4]。腺苷的降解及利用途径有:①在腺苷酸激酶(adenosine kinase,AK)的作用下磷酸化为AMP;②在腺苷脱氨酶(adenosine deaminase,ADA)的作用下不可逆地转化为肌苷[5]。见图1。
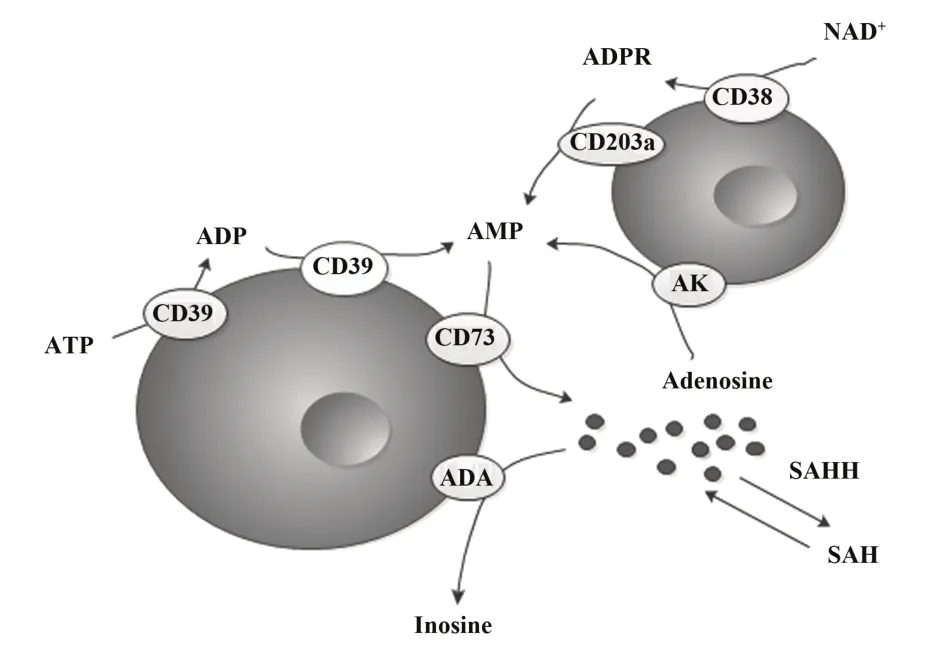
图1 腺苷代谢途径示意图Fig.1 Schematic diagram of adenosine metabolic pathways
2 肿瘤中腺苷升高的原因
缺氧、炎症等肿瘤微环境诱导CD39 和CD73 的mRNA 转录水平升高,导致相关蛋白过表达。CD39和CD73 作为细胞表面的核苷酶,CD39 催化ATP/ADP 水解,获得降解产物AMP,CD73 进一步催化AMP降解为腺苷[6]。高表达的CD39和CD73直接导致腺苷在细胞外大量蓄积。另一方面,CD38 作为ADP 核糖基环化酶,肿瘤中高水平的NAD+被CD38环化为环腺苷二磷酸核糖,并水解成ADP 核糖,胞外酶CD203a 以ADP 核糖为底物,产出AMP,最终通过CD73降解为腺苷[7]。与此同时,缺氧环境抑制了AK 的表达,通过降低由其主导的磷酸化作用,抑制了腺苷向AMP 转变的途径[8];而ADA 活性被过量腺苷抑制,无法将腺苷快速降解成肌苷[4]。上述诸多因素共同决定了肿瘤环境下胞外腺苷水平持续偏高。
3 肿瘤条件下腺苷诱发免疫抑制的基本机制
腺苷复杂的免疫调节作用主要通过与相应的G蛋白偶联受体[腺苷受体(adenosine receptor,AR)]的结合介导,后者包括A1、A2A、A2B、A3型(分别缩写为A1R、A2AR、A2BR、A3R)若干亚型[9]。基础浓度下,腺苷优先激动A1R、A2AR、A3R,而在高浓度条件下,激活A2BR[10]。由于ATP 在肿瘤内被迅速降解为腺苷,这一方面导致ATP依赖性P2嘌呤能受体介导的抗肿瘤作用被抑制[3,11]。更为重要的是,蓄积的腺苷有利于A2AR 和A2BR 的表达与激动[12]。鉴于A2AR和A2BR 在各种免疫细胞亚群上均有分布,这一现象是腺苷诱发广泛的免疫抑制作用的重要基础[3]。以下根据肿瘤免疫特征,选择与之关联最为密切的细胞类型,分述过量胞外腺苷诱发肿瘤免疫无能的具体途径。见图2。

图2 肿瘤条件下腺苷诱发的免疫抑制Fig.2 Adenosine-induced immunosuppression in tumor environments
3.1 T 淋巴细胞 T 细胞主要介导细胞免疫。Th1和CTL等效应T细胞亚群的细胞毒作用及防御性免疫功能是机体应对肿瘤威胁的重要方式。A2AR 和A2BR 的过度激动会促进细胞内cAMP 生成,这一现象增强了蛋白激酶A(protein kinase A,PKA)的活性,后者进一步抑制T 细胞抗原受体(T cell antigen receptor,TCR)及IL-2 受体触发的信号传导,下调效应T 细胞的增殖与活化[13-16]。此外,腺苷通过兴奋A2AR 可干预淋巴细胞激活的关键性分子事件发生,并通过抑制TCR 信号传导,抑制IL-2 的产生及CD25 和CD69 的表达,同时也使Fas/FasL 的表达减少,阻碍T 细胞的正常活化及免疫功能的发挥[17-18]。值得重视的是,IL-2 对活化T 细胞增殖至关重要。腺苷通过激活A2AR 和A2BR,抑制STAT5 磷酸化,下调IL-2 合成,使得癌症患者中T 淋巴细胞克隆数量减少,细胞免疫应答不足[17]。
相对于对效应T 细胞的抑制作用,腺苷对调节性T 细胞(regulatory T cell,Treg)表现出明显的上调作用。该型细胞具有免疫应答能力低下和免疫抑制两大特征,一般情况下通过抑制效应T 细胞活性发挥免疫负向调节功能,从而避免防御性免疫过度及炎症的恶性发展。有证据表明,腺苷信号可通过A2AR 途径增强Treg 的免疫抑制功能,同时促进CTLA-4 和PD-1 表达[19-20]。CTLA-4 向效应T 细胞传递抑制信号,而PD-1 促进程序性死亡,进一步抑制其活化和增殖,使肿瘤细胞获得逃避免疫。在此过程中,腺苷还可通过激活A2AR 或cAMP/PKA 通路,降低T 细胞的细胞毒性,并诱导FoxP3 表达,促进T细胞向Treg方向分化[21]。
对记忆性T 细胞而言,腺苷与A2AR 信号可调节IL-7Rα 和IL-15Rα 表达[22-23];而IL-7 与IL-15 与其相应的受体IL-7Rα、IL-15Rα 结合,在记忆性T 细胞的增殖、凋亡及细胞克隆的长期维持中发挥关键作用。与效应记忆T细胞(effector memory T cell,Tem)相比,中央记忆T 细胞(central memory T cell,Tcm)对腺苷的敏感度更高。腺苷对CD8+T细胞的免疫抑制主要作用于CD8+Tcm,通过激活A2AR/PKA,阻碍CD8+T 细胞TCR/mTORC1 的信号传导,导致随后的代谢和效应功能损害,使外周淋巴细胞和肿瘤浸润淋巴细胞的免疫能力受损[24]。
3.2 自然杀伤(natural killer,NK)细胞 NK细胞无需抗原预先致敏就能破坏靶细胞,且其杀伤无MHC限制性,应答速度快,是肿瘤免疫中的关键角色之一。A2AR 的激活可抑制NK 细胞的激活、成熟和细胞溶解潜力[3]。究其原因,腺苷对A2AR 的激动减少了穿孔素的表达,并减少大量促炎细胞因子的生成,如IFN-γ、IL-2、TNF-α、GM-GSF和MIP-1α等[12,25]。而上述物质对于NK 细胞发挥细胞毒作用至关重要。此外,在此过程中NK 细胞依赖FASL 途径产生的肿瘤细胞裂解能力也大幅下降[26]。
3.3 巨噬细胞 一般认为巨噬细胞来源于单核细胞,在不同环境因素刺激下可分化为M1 和M2 两种不同的极化类型。一般而言,M1型巨噬细胞可高效杀伤肿瘤细胞,而M2 型则促进肿瘤增殖、转移。在肿瘤微环境中,腺苷激动A1R、A2AR、A3R可抑制巨噬细胞在TLR4激动条件下释放IL-12、TNF-α、MIP-1α、NO 和超氧化物等促炎因子,从而弱化巨噬细胞的吞噬及抗原递呈功能[12-13]。而A2AR 和A2BR 的激动又有效地诱导了Arg-1、IL-10 和VEGF 的合成,从而促进巨噬细胞的M2 型极化[4,12]。上述现象导致肿瘤条件下巨噬细胞的促炎及防御性免疫活性低下,更多地呈现出了M2 型的表型和功能特征,异常分泌VEGF等生长因子,促进了肿瘤的增殖转移。
3.4 树突状细胞(dendritic cell,DC) DC是功能最强的专职抗原提呈细胞,为适应性免疫应答的主要启动者。腺苷对A2AR和A2BR的触发降低了DC启动Th1 免疫应答的能力,并促使幼稚T 细胞向Th2 和Th17 分化[12]。相对于包括A2AR 在内的其他腺苷受体,A2BR 对DC 功能的影响最为显著[25]。腺苷通过激动该受体,可诱使DC 高表达IL-6、IL-8、IL-10、VEGF、IDO、TGF-β、Arg-2 和COX-2,低表达IL-12 和IFN-γ[3,11,27]。上述表达谱的改变导致DC 发育及功能异常,降低了DC 对肿瘤抗原交叉递呈的能力[25]。这部分解释了肿瘤细胞的免疫逃逸机制。
3.5 骨髓来源的抑制细胞(myeloid-derived suppressor cell,MDSC) MDSC 是处于不同分化阶段的骨髓祖细胞和前体细胞组成的异质性群体[28]。因其具有免疫抑制、促血管新生等特性,而对肿瘤的发生、发展具有推动作用[29]。肿瘤组织内高浓度的腺苷作用于A2BR,促进了MDSC 群体的扩增[25]。也有文献报道,A2AR 的激活促进了MDSC 产生IL-10,而IL-10 作为炎症和免疫抑制因子,其过表达与肿瘤的增殖密切相关[12]。
4 腺苷信号轴与肿瘤治疗
4.1 逆转肿瘤缺氧微环境 在肿瘤微环境下,缺氧环境激活的主要转录调节因子HIF-1α 会强有力地诱导CD39、CD73表达,从而通过催化途径增加胞外腺苷的产生[4]。另一方面,缺氧下调AK,抑制腺苷的降解转化。有报道表明,通过暴露于高氧大气(60%氧)逆转缺氧,可有效地降低肿瘤内TGF-β、CTLA-4、COX-2和FoxP3表达,表现出有利于肿瘤免疫的微环境改变;与此同时,CD39、CD73、A2AR 和A2BR 的表达水平也大幅降低[20-30]。上述证据表明,缓解肿瘤组织内局部缺氧环境是抑制腺苷途径异常上调,逆转免疫无能,治疗肿瘤的可行途径。
4.2 阻断CD38、CD39、CD73 功能 作为操纵腺苷水平的主要分子,CD39、CD73 在癌细胞和免疫细胞中均广泛表达。CD73 敲除的小鼠表现出肿瘤的生长和扩散转移受阻[31]。而采用单克隆抗体或选择性抑制剂阻断CD73 信号也可产生有效的抗肿瘤活性[32]。除瘤体减小以外,还可以观察到显著的肿瘤血管新生抑制及多药耐药性降低[33-34]。与此类似,CD39 缺失的小鼠也表现出肿瘤的生长及新生血管生成受限[35-36]。不同的是,CD39 抑制除下调腺苷途径以外,还可触发eATP-P2X7-炎症体-IL-18轴,减少肿瘤内巨噬细胞的数量,增强肿瘤内T 细胞效应功能,克服抗PD-1耐药性[37]。
由于NAD+通过CD38-CD203a-CD73 途径生成腺苷,CD38 也是潜在的抗肿瘤靶点[38]。CD38 敲除与CD38 单克隆抗体治疗均表现出很好的抗肿瘤效果[39-40]。由于NAMPT 是NAD+合成的限速酶,理论上抑制NAMPT/NAD+合成途径,也有利于降低腺苷水平。现有证据也已证明,该通路是极具希望的新型肿瘤治疗靶点[41]。但考虑到NAMPT 兼具的代谢及免疫调控功能,上述治疗方案涉及的具体机制复杂,而腺苷通路调控可能仅部分涉及其中。
4.3 调控腺苷受体 鉴于腺苷受体对腺苷通路的核心作用,特异性抑制必将对该通路介导的免疫功能及肿瘤结局产生深远影响[42]。除了上述重点论述的免疫调控机制以外,该受体通路很多时候还可直接作用于肿瘤细胞,通过多种途径影响临床结局。
A1R 与多种肿瘤密切相关,如胶质瘤、黑色素瘤、肺癌、结肠癌等[43-44]。研究发现,A1R 拮抗剂DPCPX 通过下调ERK/JNK 的磷酸化抑制了肾细胞癌的增殖和迁移[45];同时可诱导P53表达,从而促进乳腺癌细胞MCF-7 凋亡[46]。但是,一项研究发现A1R 激动剂CHA 及R-PIA 对HepG2、CACO2 细胞的增殖有抑制作用,而在成纤维细胞却没有这种影响,表现出良好的特异性抗肿瘤效果[47]。上述看似矛盾的结论表明A1R通路的具体功能存在显著的组织/细胞特异性,其确切的临床意义仍有待进一步研究。
A2AR 拮抗剂主要通过上调免疫细胞功能增强体内抗肿瘤免疫反应,实现肿瘤的治疗。A2AR 拮抗剂Ciforadenant 通过阻断低氧-A2A-腺苷信号轴消除肿瘤微环境对T细胞和NK细胞的功能抑制,这对肾癌的患者的临床治疗、预后改善及提高生存率起到积极作用[48]。有研究发现,联合抑制CD73 和A2AR腺苷信号将进一步提高抗肿瘤的免疫应答[49]。此外,阻断A2AR 能抑制癌症病理性淋巴管生成,阻断肿瘤细胞通过淋巴系统扩散[50]。
A2BR 在肿瘤细胞增殖、血管生成、转移和免疫抑制作用中发挥重要作用[51]。研究发现,A2BR 的激活在体外促进了4T1.2 肿瘤细胞的趋化性,加速肿瘤体内的远端转移[52]。与此对应,敲除、阻断或拮抗A2BR 抑制了癌细胞的侵袭力,抑制肿瘤的生长迁移[53-56]。体内研究表明,免疫调节是A2BR 影响肿瘤发生、发展的重要机制途径。激动A2BR 将促进黑色素瘤小鼠模型体内肿瘤的生长,阻断A2BR 则降低了肿瘤中的MDSC 浸润并恢复T 细胞抗肿瘤的免疫能力[57]。
肿瘤中A3R 是一个矛盾的集合体,其对肿瘤的确切影响仍有待阐明。大量文献报道其在癌细胞和实体瘤中高表达,且激活A3R 可增强胶质细胞瘤的迁移与侵袭能力[58-59]。这表明阻断A3R 可能是抗肿瘤的有效策略。然而,A3R 的激动却也表现出显著的抗增殖与促凋亡效果,这一结论在乳腺癌细胞、前列腺癌细胞、黑色素瘤等肿瘤中都得到了证实[60-63]。同时,A3R 激动剂Cl-IB-MECA 与CF102 通过抑制PKA、Erk 和AKT 等癌细胞增殖信号通路,在体外可诱导多种肿瘤细胞凋亡[64]。此外,A3R 的激动增强了NK 细胞杀伤癌细胞的能力,也抑制了肿瘤内PI3K/AKT 信号通路及其下游NF-κB 通路的激活,表现出抗炎与抗癌效果[65-66]。
4.4 腺苷靶向治疗联合其他抗癌疗法 与单独阻断腺苷途径相比,联合其他治疗方案能有效地提高抗癌效果。CD73 的靶向阻断可增强抗PD-1 和抗CTLA-4 单克隆抗体的抗肿瘤活性[67];CD73-腺苷轴阻断结合放射治疗表现出CD4+T 细胞、CD8+T 细胞及IFN-γ 增加,抗结肠癌的增殖转移能力增强[68]。相似地,抑制CD38 能提高PD-L1 的抗肿瘤功效:与单独的PD-L1 靶向治疗相比,接受联合治疗的荷瘤小鼠体内显示出更高水平的CD8+T 细胞、ICOS+、CD4+T 细胞,以及更低水平的MDSC 和Treg[69]。同样,腺苷A2BR 的阻断亦能增强索拉非尼的抗肝癌效果[70]。
4.5 靶向治疗的安全性 大量文献报道了腺苷信号通路的靶向治疗在肿瘤上所表现出的积极效果,但目前对其所产生的不良反应与对肝、肾的副作用知之甚少。目前临床试验中,已知MEDI9447(CD73的单抗之一)最常见的不良反应是腹泻(8.7%)、发热(8.7%)、疲劳(6.5%)、谷丙转氨酶(ALT)升高(6.5%)、谷草转氨酶(AST)升高(6.5%)、碱性磷酸酶(ALP)升高(6.5%)[71]。其他CD39、CD73 的单克隆抗体,A2AR、A2BR 的小分子拮抗剂与A3R 的激动剂处于志愿患者招募阶段、Ⅰ期或Ⅱ期临床试验阶段,披露的也多是提高了抗肿瘤的效果,尚无公开的数据可以评估单药治疗或联合治疗的安全性。随着临床试验的进展,预计靶向治疗的安全性及耐受性的报道将会越来越多。
5 总结
腺苷介导的免疫抑制作用是保护组织免受过度炎症损伤及促进组织损伤后修复。但在肿瘤中,这一过程却被劫持,通过减弱T 细胞、NK 细胞和DC的免疫功能,增强Treg和MDSC的免疫抑制能力,以及促使巨噬细胞向M2 极化等方式,严重削弱了免疫系统的抗肿瘤功能。与此同时,腺苷诱发的A2AR与A2BR 过度激活促进了肿瘤中的血管新生,如:A2AR 刺激的巨噬细胞及A2BR 刺激的MDSC、DC 都会促使VEGF分泌增加等[72-73]。从这些角度而言,肿瘤组织内的腺苷蓄积是重要的继发性病理因素。通过对CD39-CD73-腺苷-腺苷受体途径的抗癌研究发现,降低肿瘤内腺苷的含量能使肿瘤的增殖、转移能力降低,而且还可促进肿瘤细胞的凋亡,达到很好的抗肿瘤效果。靶向腺苷通路的抗癌疗法既拓宽了治疗肿瘤的途径,还对今后联合放化疗、手术治疗、中医药治疗、分子靶向治疗等其他抗癌疗法的定向开发起到积极作用,是极具前景的肿瘤免疫治疗的新靶点。