杭州市2019年登革病毒分子流行病学研究
文艳苹,汪皓秋,于新芬,张国忠,周银燕,钱 昕
登革热(Dengue fever,DF)是由登革病毒(Dengue virus,DENV)经伊蚊叮咬而引起传播的急性传染病[1]。DENV最早起源于亚洲或非洲的非人灵长类动物,大约于500~1 000年前进入城镇循环,分别独立进化形成4种血清型(DENV-1~DENV-4)[2]。4种血清型均可引起登革热流行,血清型间氨基酸序列相似性约为65%[3]。
登革热是全球分布最广、蔓延最快、发病人数最多的虫媒病毒病。每年东南亚、美洲及环太平洋等地区有近500万人感染登革热[4],50万人因此住院治疗,2万人死于该病。我国不是登革热自然疫源地,疫情主要是由国外输入病例引起本地季节性流行。流行范围逐步从南方、西南省份扩大到东南沿海[5-7],甚至中、北部省份[8]。2019年全球登革热疫情更为严峻,东南亚多个国家的疫情规模较2018年同期呈显著上升[9-12],境外输入风险加大。本研究对2019年杭州登革热的流行特征、可能来源和分子型别进行分析,以期掌握登革热的分布规律和流行趋势,为制定防控策略提供依据。
1 材料与方法
1.1 标本来源与病例资料 医疗机构采集登革热疑似病例的非抗凝血液标本,送辖区CDC进行实验室检测。根据中华人民共和国卫生行业标准(WS 216-2018)对病例进行诊断和流行病学资料收集。流行病学数据采用SPSS 22.0软件进行分析。
1.2 实验室诊断 对患者急性期血液标本进行DENV核酸检测。采用天隆NP968核酸提取仪抽提病毒RNA,用于RT-PCR扩增,所用试剂为登革病毒通用型核酸检测试剂盒(荧光PCR法)(江苏硕世生物技术股份有限公司)。DENV RNA检测为阳性时,再采用登革病毒核酸分型检测试剂盒(荧光PCR法)(江苏硕世生物技术股份有限公司)进行型别鉴定。患者发病时间超过5 d时,则进行Ig M或IgG抗体检测,试剂为登革热Ig M抗体检测ELISA试剂盒或登革热Ig G抗体检测ELISA试剂盒(澳大利亚Panbio公司)。实验步骤参照试剂盒说明书。
1.3 E基因扩增及序列测定 根据分型结果,选择对应的E基因扩增引物[6]。采用大连Ta KaRa公司PrimeScript One Step RT-PCR Kit试 剂 盒(PR055A)进行一步法扩增。RT-PCR循环条件如下:50℃逆转录30 min,95℃灭活酶及预变性15 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,扩增40个循环;72℃延伸10 min。PCR产物测序送北京擎科新业生物技术有限公司完成。
1.4 序列分析 利用BLASTn检索NCBI和Virus Pathogen Resource(ViPR)数据库(http://www.viprbrc.org)中参考毒株。使用Clustal X 1.8软件进行核苷酸序列比对。经MEGA-X软件分析,确定本研究核苷酸序列矩阵的最佳替换模型为TN93+G,选用邻接法(neighbor-joining,NJ)构建系统进化树,Bootstrap值设为1000。选取杭州DENV-1基因IV型本地流行病毒和ViPR中同型毒株的E基因序列,利用Beast软件计算核苷酸的进化速率和最近共同祖先(the most recent common ancestor,t MRCA)。计算采用relaxed clock exponential分子钟和coalescent Bayesian skyline方法,共运行1.0×108代,每10 000代进行抽样。用Tracer分析Beast抽样产生的数据。
2 结 果
2.1 登革热流行情况 经DENV核酸和Ig M检测,2019年杭州市共确诊登革热病例212例,其中输入性病例158例,本地病例54例。输入性病例全年均有检出,以6~10月居多(117例)。输入性病例各区(县、市)都有报告,以主城区及其近郊市区检出数量居多。输入来源地包括东南亚(129例)、南亚(11例)、非洲、美洲等一些国家及我国南方省份(10例)。本地病例发病时间集中在7~11月,10个区(县、市)均有检出,其中下城区(16/54)、江干区(10/54)、上城区(7/54)、临安区(6/54)病例较多。
输入性病例患者的年龄范围为4~69岁,中位数为37岁,主要集中在21~50岁的青壮年,占输入性病例的77%(121/158);男性88例,女性70例,男女比例为1.26∶1。本地病例患者的年龄范围为1~85岁,中位 数 为39.5岁,多 为20岁 以 上 成人(50/54),年龄层分布较均衡;男性26例,女性28例,男女比例为1∶1.08。
212例登革热病例中,178例为DENV通用型核酸阳性,65例为Ig M抗体阳性,其中31例Ig M和核酸检测均为阳性;3类检测(仅检测核酸、仅检测Ig M抗体、Ig M和核酸均检测)的样本采集时间距离发病时间分别为0~5 d、5~13 d和4~10 d,中位数分别为2 d、7 d和5 d。IgG抗体检测均为阴性,DENV分型结果见表1。
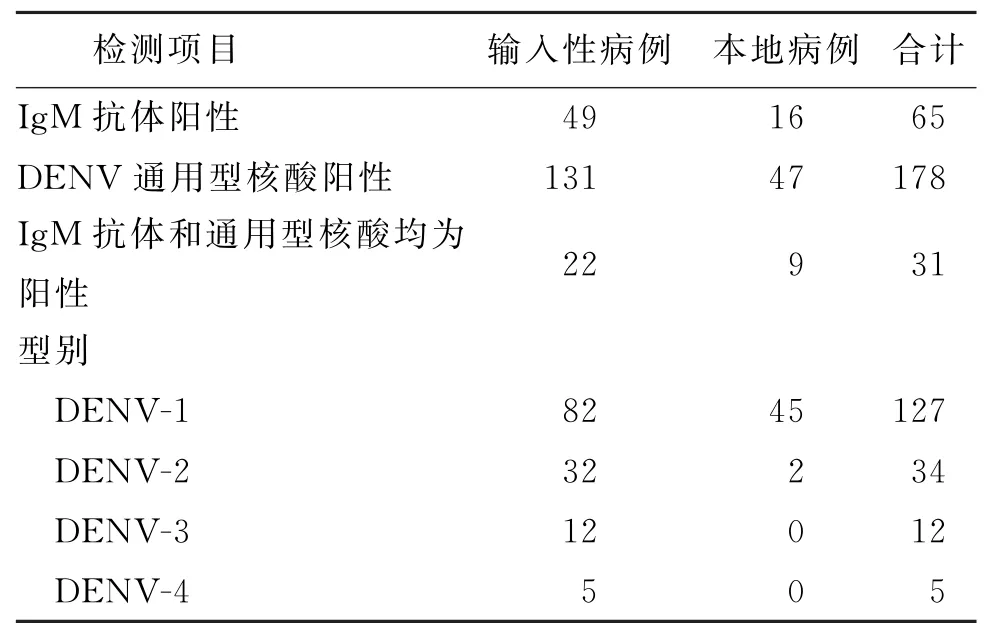
表1 杭州市2019年DENV实验室检测结果Tab.1 Detection results of DENV in Hangzhou,2019
2.2 DENV-1的E基因核苷酸序列分析 对DENV-1阳性样本进行E基因序列测定,共获得101条序列(1 485 bp)。经序列相似性比对和型别分析,发现基因I型病毒序列69条,基因IV型病毒序列30条,基因V型病毒序列2条。基因I、IV和V型病毒序列间的核苷酸一致性分别为96.0%~100%、99.9%~100%、98.3%。输入性DENV-1病毒多为基因I型(63/82)和V型(2/82),而本地病例多由基因I型(6/45)和IV型(26/45)病毒引起。基因I型相关的本地病例共报告5起,其中1起为聚集性发病(3例),另4起均只有1例病例。基因IV型相关的本地病例共报告14起,其中3起为聚集性发病(8例、8例、7例),另11起均只有1例病例。杭州DENV-1病毒的E蛋白毒力位点和糖基化位点多数与报道一致[13],仅发生E156(I)和E366(S)位点变异。
根据E基因序列一致性和样本采集时间,选取32条本地病毒序列、12条输入性病毒序列,以及从ViPR下载的不同国家、地区的DENV-1毒株序列,构建NJ进化树。结果显示,基因I型本地病毒HZ366、HZ398、HZ654、HZ582、HZ630分布于不同簇中(图1),分别与2019年广州流行株19XN29810f、19XN16197、19XN15076、19XN50601以及2019年南昌流行株JX146/2019最相似,核苷酸序列一致性分别为99.9%、100%、99.7%、99.9%和100%。基因IV型本地病毒序列聚拢成簇,与2015年菲律宾株Philippines/1508a Tw和2015年浙江流行株ZJ/29/XS/15最接近,核苷酸序列一致性分别为99.4%~99.5%和99.3%~99.4%。
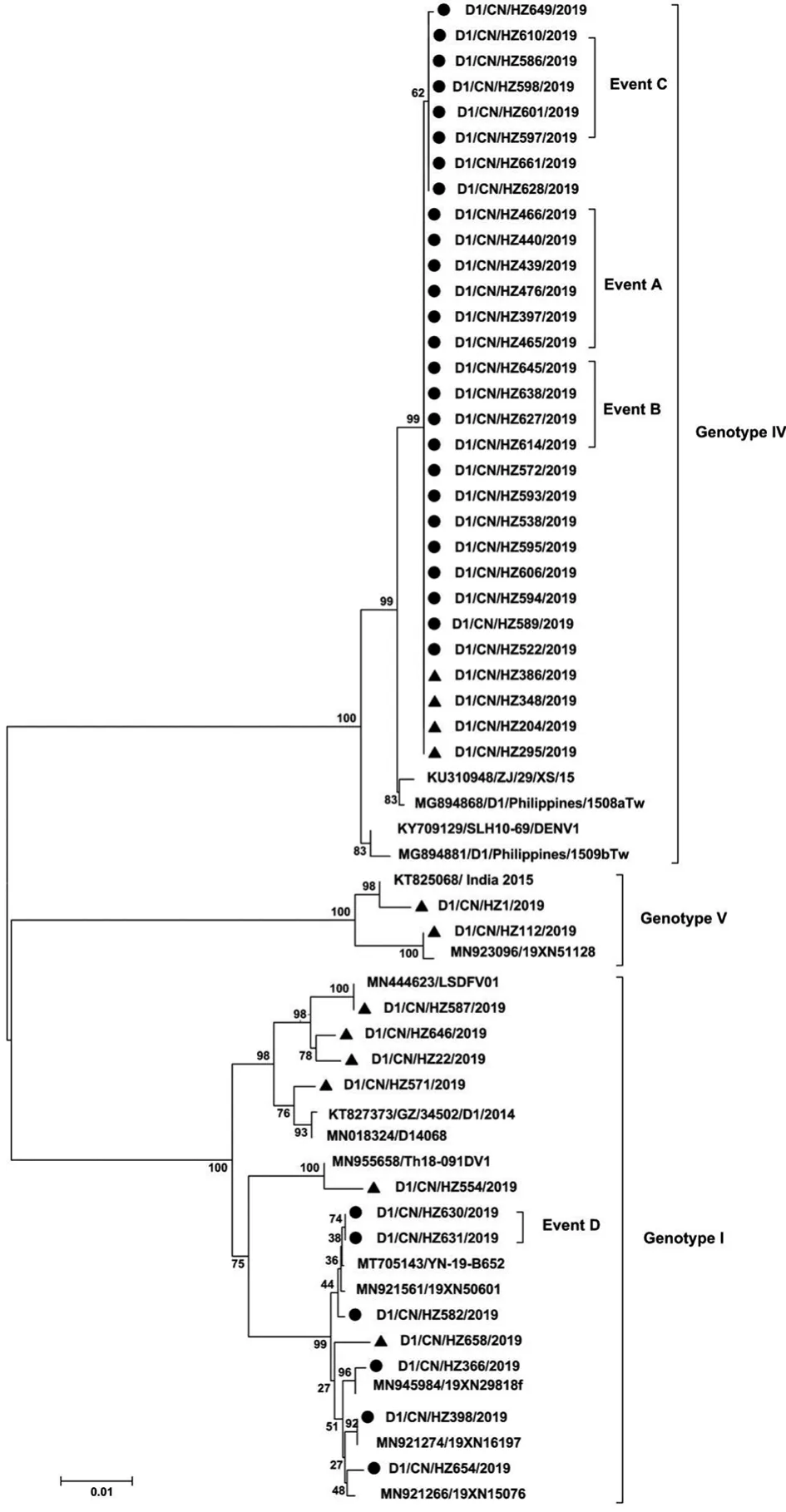
图1 2019年杭州DENV-1 E基因核苷酸进化树Fig.1 Phylogenetic tree based on the E gene of DENV-1 in Hangzhou,2019
由于基因IV型本地病毒的E基因序列高度同源,为分析溯源,选取Event A、Event C的代表性病毒序列,以及从ViPR下载的30株同型毒株(分离自1974-2016年间)序列,进行t MRCA分析。结果表明,基因IV型病毒的E基因核苷酸平均碱基替代率为9.204×10-4(95%HPD:6.179×10-4~1.243×10-3)替代/位点,Event A和Event C病毒的t MRCA出现在2017年5月(95%HPD:2015年8月至2019年7月)。
2.3 DENV-2的E基因核苷酸序列分析 对DENV-2阳性样本进行E基因序列测定,共获得25条序列(1 485 bp)。经序列相似性比对和型别分析,发现Cosmopolitan基因型病毒序列20条,Asian I基因型病毒序列5条,病毒序列间的核苷酸一致性分别是97.8%~99.8%和92.6%~100%。下载不同国家、地区DENV-2的E基因序列,构建NJ进化树。结果显示本地病毒HZ464、HZ470与2019年杭州输入性病毒HZ415聚拢成簇(图2),分布于Cosmopolitan基因型分支,三者序列相似性为100%。其次与2018年泰国株Th18-012DV2最相似,为99.7%。杭州DENV-2病毒的E蛋白毒力位点和糖基化位点保守,仅发现对应Cosmopolitan基因型的E71(A)和E390(S)位点变异[13-14]。

图2 2019年杭州DENV-2 E基因核苷酸进化树Fig.2 Phylogenetic tree based on the E gene of DENV-2 in Hangzhou,2019
2.4 DENV-3、DENV-4的E基因核苷酸序列分析
12例DENV-3阳性样本均为输入性病例,经RTPCR扩增和序列测定后,共获得10条E基因序列(1 479 bp),核苷酸序列一致性为92.6%~100%。基于E基因构建的NJ进化树中,10条序列分布于基因Ⅰ型和基因Ⅲ型两大分支中(图3),其中6例基因Ⅰ型病毒分别与2015-2016年间的菲律宾株、2017年缅甸株聚拢成簇,与病例输入地相符。另4例基因Ⅲ型病毒多与输入地周边地区的毒株序列较相似。杭州DENV-3病毒的E蛋白仅糖基化位点发生E153-155(N-E-T)突变。
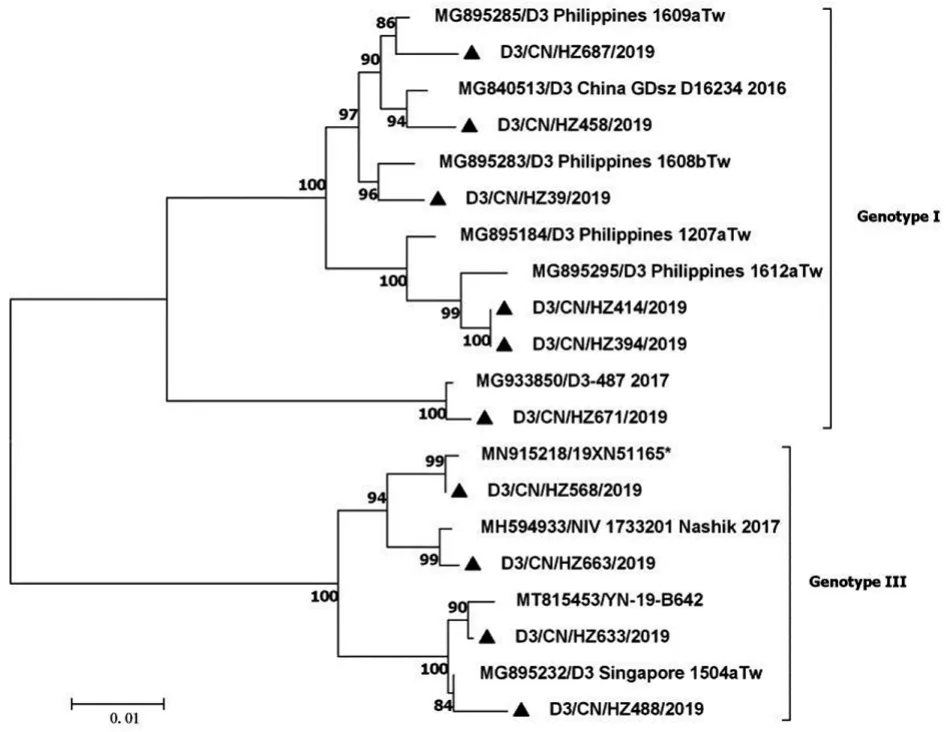
图3 2019年杭州DENV-3 E基因核苷酸进化树Fig.3 Phylogenetic tree based on the E gene of DENV-3 in Hangzhou,2019
对5例输入性DENV-4病毒进行E基因测序,共获得4条序列(1 485 bp),核苷酸序列一致性为92.4%~100%。基于E基因构建的NJ进化树中,HZ461、HZ462与2016-2017年印度株聚拢成簇(图4),为基因Ⅰ型。HZ150、HZ160与2019年印尼株聚拢成簇,为基因Ⅱ型。DENV-4病毒的E蛋白仅毒力位点发生E401(M)突变[15]。
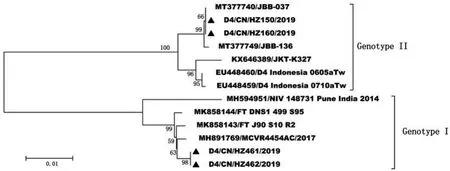
图4 2019年杭州DENV-4 E基因核苷酸进化树Fig.4 Phylogenetic tree based on the E gene of DENV-4 in Hangzhou,2019
3 讨 论
2019年东南亚国家登革热肆虐[9-12,16],尼泊尔和孟加拉更是遭遇了史上最严重的疫情[9,12],病例数高达1.4万人和10万人。疫情多以一种血清型病毒流行为主,同时混杂少量其他血清型病毒。老挝、巴基斯坦、尼泊尔等国以DENV-2流行为主[10-12],孟加拉以DENV-3流行为主[9],而印尼爪哇地区则以DENV-4流行为主[16]。受东南亚疫情影响,2019年杭州输入性病例数量增幅明显,为2018年的3倍,输入地多为东南亚国家,型别以DENV-1为主。引起杭州本地流行的DENV-1基因I型病毒与2019年广州、南昌等地的流行株序列高度相似。与此同时,2019年江西省樟树市暴发了由DENV-1引起的本地流行[17]。这说明虽然近年东南亚的流行毒株在逐年更替、变化,但DENV-1仍占较大比例,是引起我国登革热本地流行的重要型别。
杭州输入性DENV-1病毒中,虽然基因IV型仅占2.5%(4/158),但大多数本地病例均由该型引起。3起由DENV-1基因IV型病毒引起的聚集性疫情(Event A、B、C)病例数占本地病例数的42.6%(23/54),对应的发病日期分别为7月24日至8月11日、9月25日至10月19日、9月5日至9月22日。序列分析发现Event A与Event B病毒的E基因序列100%相似,且8-9月间还另有8例本地病例的E基因序列与这两起事件的序列相同,家庭住址多在Event A、B所在区。但这8例病例相互之间以及与Event A、B之间均未发现流行病学关联。究竟是短时间内输入了多例E基因序列完全一致的病毒而引起的散在流行,还是由于登革热传播途径隐蔽,未找到病例间的流行病学关联,这可能需要借助具有更快进化速率的基因序列或全基因组序列进行分析。然而,为适应媒介生物和动物宿主间的传播循环,DENV基因组多受净化选择的压力,序列保守[18]。目前,DENV进化分析多采用E基因或pr M/M-E区基因片段。M蛋白为包膜蛋白,E蛋白为糖蛋白,主要介导病毒与细胞膜融合,与病毒的宿主选择和毒力相关[2]。我们在分析基因IV型病毒序列时发现,NS2A、NS2B、NS4A、NS4B等基因的序列变异大于E基因,基于以上基因构建系统进化树也许能提供更精准的信息。
DENV-1基因IV型病毒的E基因碱基替换速率为每年6.179×10-4~1.243×10-3替代/位点,略大于DENV-1的进化速率(2.54×10-4~6.54×10-4替代/位点)[19],这可能与DENV-1各基因型进化速率存在差异有关[1]。根据此速率推算,Event A和Event C病 毒 的t MRCA应 出 现 在2017年5月(95%HPD:2015年8月至2019年7月)。鉴于2019年杭州登革热本地病例数少,Event A病毒短时间内发生突变的概率低,推测Event A和Event C为不同输入病例引起的本地传播。且2019年由泰国、菲律宾等地输入杭州的病毒与Event A-C病毒的E基因序列高度相似,说明该型病毒在东南亚分布较广,存在较大输入风险。
虽然DENV基因组多受净化选择的压力,但部分位于B细胞或T细胞表位的氨基酸位点却受微弱的正向选择压力[20],影响毒株系的分化[21]。E390位点位于E蛋白中决定细胞嗜性的结构域Ⅲ,该位点发生突变,会影响病毒的神经毒力,是决定病毒毒力的重要位点之一[22]。在DENV-2部分基因型中,E390位点呈型特异性,如Asia I基因型中该位点多为N[23],American基因型中均发生N→D突变[24],而Cosmopolitan基因型多发生N→S的突变[18]。
受蚊媒分布影响,DENV流行呈区域化的特点[1]。东南亚、南美洲的某些地区作为特定DENV型别扩散中心[25-27],向外输出病例。而距离是影响DENV传播的显著因素之一[28],流行毒株系的更替、演变往往借助人类活动向周边地区扩散[29-31]。2019年输入杭州的DENV-3基因Ⅰ型和DENV-4病毒表现出明显的地域性,而DENV-3基因Ⅲ型病毒则与新加坡、马来西亚、缅甸、柬埔寨等地病毒序列相近,呈较大范围扩散。疫源地DENV毒株系的更替往往会造成较大规模的疫情[32],增强病例的输出能力。加强病毒扩散核心区的型别监测,能给周边地区提出预警,以便采取有效的防控措施。
综上所述,受东南亚登革热疫情影响,2019年杭州登革热病例数量增幅明显,呈型别多样化、本地病例溯源复杂的特点。加强DENV分子流行特征研究,及时发现本地病例关联,确定疫点和传播来源,对疾病防控显得尤为重要。
利益冲突:无
引用本文格式:文艳苹,汪皓秋,于新芬,等.杭州市2019年登革病毒分子流行病学研究[J].中国人兽共患病学报,2021,37(12):1096-1101.DOI:10.3969/j.issn.1002-2694.2021.00.156

