PAK6、ZNF217、G蛋白偶联受体48基因在膀胱癌演进过程中的表达变化
蒋利明, 田大伟, 刘胜来, 张羽
1天津医科大学中新生态城医院外科(天津 300467); 2天津医科大学第二医院泌尿外科(天津 300211)
膀胱癌源自膀胱上皮细胞,研究显示,膀胱癌在世界范围内的发病率处于全部恶性肿瘤的前10位,在我国的发病率处于泌尿系统恶性肿瘤的首位,且其发病率呈现为逐年升高的趋势[1-2]。流行病学调查显示[3],膀胱癌可发生与各个年龄段,多发于65岁以上男性,男性高于女性,但目前受多种因素的影响,膀胱癌的发病人群逐渐年轻化,严重影响着患者的生存质量和生命健康。目前临床上对膀胱癌的发病机制尚不完全明确,且缺乏特异性评估患者疾病进展的指标,基于此背景,在本研究中,分析P21活化激酶6(PAK6)、锌指蛋白217(ZNF217)、G蛋白偶联受体48(GPR48)在膀胱癌演进过程中的表达变化,为临床上膀胱癌的诊治提供新思路。
1 资料与方法
1.1 一般资料 选取2017年12月至2019年12月于我院就诊且行手术治疗的138例膀胱癌患者,其中男67例,女71例,年龄35~68岁,平均(48.93±15.67)岁,肿瘤直径:≥5 cm 68例,<5 cm 70例;低分化84例,中分化32例,高分化22例;临床分期:Ta期38例,T1期27例,T2期22例,T3期29例,T4期22例;42例有淋巴结转移;浸润深度:肌层浸润73例,非肌层浸润65例。并对患者行为期6个月的随访统计复发情况,其中复发26例,未复发112例。所有患者及家属均对本次研究知情,签署知情同意书,并经过我院伦理委员会批准。
纳入标准:(1)经病理学组织学确诊为膀胱尿路上皮癌;(2)均未接受过放疗、化疗、免疫治疗。
排除标准:(1)其他肿瘤者;膀胱手术史者;(2)感染者;心、肺、肝等重要脏器障碍者;(3)接受过免疫、放化疗者。
1.2 方法
1.2.1 免疫组化 取手术切除的膀胱癌组织及癌旁组织(距离癌基底边缘≥5.0 cm正常膀胱组织)标本,在10%的甲醛溶液中固定,脱水、包埋后,制作5 μm组织切片,设置恒温箱温度为58℃,烘烤 2 h,在二甲苯中脱蜡处理30 min,然后浸在梯度乙醇中各5 min,之后用无菌蒸馏水洗涤5 min。加入柠檬酸钠抗原修复液在沸水中水浴20 min,冷却到室温后用PBS冲洗3次(每次5 min)。分别滴加PAK6、ZNF217、GPR48抗体(1∶200),在4℃的湿盒中过夜保存,第2天将湿盒取出后复温处理1 h,采用PBS洗片3次(每次5 min)。之后加入二氨基联苯胺(1∶50)进行显色处理1 min,最后加入蒸馏水反应终止。加入苏木素进行复染,盐酸乙醇分化后,梯度乙醇进行脱水,二甲苯冲洗片3次直至透明,采用中性树脂封片处理,显微镜下观察免疫组化染色情况。随机选取5个视野,所有病理切片均由2位以上经验丰富的医师采用双盲法进行诊断。依据染色程度和染色细胞百分比进行评估:阳性细胞数<10%为-,10%~25%为+,26%~75%为++,>75%为+++。
1.2.2 实时荧光定量PCR(RT-PCR)法 采用RT-PCR法检测癌组织、癌旁组织中PAK6、ZNF217、GPR48 mRNA的表达量,取癌组织、癌旁组织,利用Trizol法提取癌组织、癌旁组织总RNA,使用紫外分光光度仪检测所提取的RNA纯度,总RNA纯度鉴定运用聚丙烯酰胺凝胶电泳鉴定。利用PCR试剂盒合成cDNA。逆转录:14 μL模板RNA、2 μL Enzyme mix,4 μL 5×RT缓冲液,补至20 μL,PCR检测仪42℃ 1 h、95℃ 5 min,之后将所合成的cDNA置于-20℃环境下保存。反应体系为:8μL cDNA模板、10 μL SYBRP Green mix、2 μL PCR Primer mix。反应条件为:95℃ 10 min,95℃ 10 s,60℃ 1 min,40个循环。以β-actin作为内参,采用2-ΔΔCt方法计算癌组织、癌旁组织PAK6、ZNF217、GPR48 mRNA表达量。PAK6引物序列:上游:5′-CCCACCCCAAACCCTATCT-3′,下游:5′-ACACATGGATGCCTGTGACC-3′;ZNF217引物序列:上游:5′-ATGTTACTCCTCCTCCGGATG-3′,下游:5′-ACACTTGGCCTGTATCTCA-3′;GPR48引物序列:上游:5′-TGTTTCAACCTTTTAAAGACTGTAGC-3′,下游:5′-TAAAGGACTTAATGCCAAATGTGAT-3′;β-actin引物序列:上游:5′-AGGGGCCGGACTCGTCATACT-3′,5′-GGCGGCACCACCATGTACCCT-3′。
2 结果
2.1 PAK6、ZNF217、GPR48在膀胱癌组织、癌旁组织中的表达情况比较 与癌旁组织相比,癌组织中PAK6表达量显著降低,ZNF217、GPR48表达量显著升高,差异有统计学意义(P<0.05)。见表1、图1。

表1 PAK6、ZNF217、GPR48在膀胱癌组织、癌旁组织中的表达情况比较
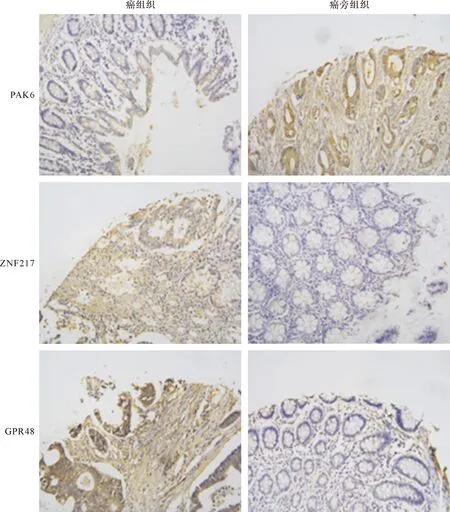
图1 PAK6、ZNF217、GPR48在膀胱癌组织、癌旁组织中的表达(免疫组化,×200)
2.2 PAK6、ZNF217、GPR48在膀胱癌演进过程中的表达情况分析 PAK6、ZNF217、GPR48表达与膀胱癌患者性别、年龄、肿瘤直径无关,差异无统计学意义(P>0.05);PAK6、ZNF217、GPR48表达与膀胱癌患者分化程度、临床分期、有无淋巴结转移、浸润深度、复发情况相关,与中高分化、Ta~T1期、无淋巴结转移、非肌层浸润、未复发患者相比,低分化、T2~T4期、有淋巴结转移、肌层浸润、复发患者的PAK6表达量降低,ZNF217、GPR48表达量升高,差异具有统计学意义(P<0.05)。见表2。

表2 PAK6、ZNF217、GPR48在膀胱癌演进过程中的表达情况分析
2.3 PAK6、ZNF217、GPR48之间相关性分析 PAK6、ZNF217、GPR48之间相关性分析显示,PAK6与ZNF217之间呈负相关(r=-0.219,P=0.010);PAK6与GPR48之间呈负相关(r=-0.309,P=0.001);ZNF217与GPR48之间呈正相关(r=0.193,P=0.023)。见图2。
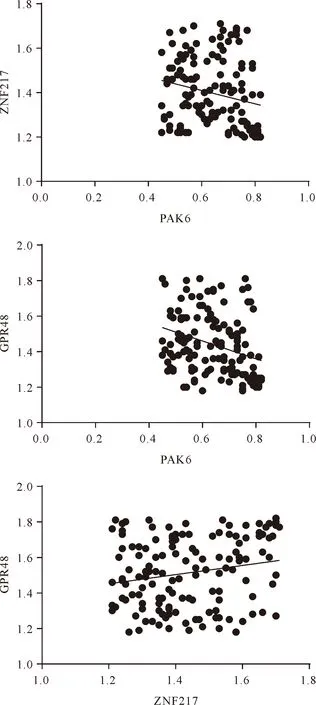
图2 PAK6、ZNF217、GPR48之间的相关性分析
3 讨论
部分研究认为,膀胱癌的发生是多种因素共同作用的结果,属于一种较为庞大、复杂的网络,在各种因素的刺激下,促进肿瘤细胞异常增殖、迁移,增殖失控,最终诱导肿瘤的进一步进展[4]。本研究为寻找促进膀胱癌演进的敏感指标,分析PAK6、ZNF217、GPR48在膀胱癌演进过程中表达变化,明确三者是否参与此病的进展,为临床上此病的诊治提供参考。
P21活化激酶(PAKs)属于一种在进化上较为保守的丝氨酸/苏氨酸蛋白激酶家族,属于小G蛋白Rho家族Cdc42、Rac1的下游靶向因子,临床上根据其结构和序列同源性分为两类,即为包括PAK1、PAK2、PAK3在内的Ⅰ类PAKs和包括PAK4、PAK5、PAK6在内的Ⅱ类PAKs,与肿瘤细胞的运动、生存、基因转录调节、细胞迁移、周期变化等生物学行为相关[5-7]。PAK6属于PAKs家族成员之一,属于一种与雄激素受体发生相互作用的激酶蛋白,其活性受p38 MAPK、MKK6所调控,具有抑制雄激素受体介导的核转录过程[8]。研究发现[9-10],PAK6在恶性肿瘤的发生发展过程中具有双重作用,在肺癌、前列腺癌、胰腺癌等癌组织中呈现为异常高表达,促进肿瘤细胞增殖失控,促进疾病进展;在肾透明细胞癌中呈现为异常低表达。研究显示[11],PAK6可经雄激素受体信号转导通路参与膀胱癌的发生发展。本研究结果显示,PAK6在膀胱癌组织中低表达,且与患者分化程度、临床分期、淋巴结转移、浸润深度、复发情况相关,此结果提示PAK6可能经雄激素受体信号转导通路刺激肿瘤细胞异常增殖,进而促进疾病进展,在此病的演进过程中具有重要的意义。
ZNF217属于kruppel样转录因子家族成员之一,具有1个富含脯氨酸基序、8个C2H2锌指基序,可经过与其特定的DNA序列结合后对特定的基因表达进行调控[12]。有研究显示[13-14],ZNF217同时也是一种组蛋白去乙酰化酶复合物的组成蛋白,可经参与多个c端结合蛋白复合物抑制相应的基因转录过程。临床研究发现,ZNF217在恶性肿瘤的发生发展中具有重要的意义,经介导多种信号转导通路参与恶性肿瘤的演进过程,ZNF217可经促进ErbB3表达降低,抑制乳腺癌细胞增殖[15]。ZNF217可经激活PI3K/AKT信号转导通路,促进卵巢癌细胞增殖[16]。另外有研究显示[17],当ZNF217出现异常高表达后,可在一定程度上促进肿瘤细胞异常增殖和迁移,促进疾病进一步进展、恶化。本研究结果显示,ZNF217在膀胱癌组织中高表达,且与患者分化程度、临床分期、淋巴结转移、浸润深度、复发情况相关,此结果提示PZNF217异常高表达与疾病进展相关,在此病的演进过程中具有重要的意义。
细胞内环境的稳定和活动与信号转导通路相关,在此过程中细胞表面的膜受体具有重要的意义,G蛋白偶联受体属于一种最大的膜蛋白家族,其具有7个跨膜结构,可经过与多种膜信号分子的特异性结合作用参与免疫反应、肿瘤发生发展、内环境稳定调节、行为、情绪控制等多种生理病理过程[18-19]。临床上将G蛋白偶联受体分为A、B、C型三种,其中GPR48属于G蛋白偶联受体家族超家族的A10亚型,其位于激素结合区域,在多种组织器官发育中具有重要的意义[20]。研究显示[21-22],GPR48其异常表达参与多种疾病的发生发展,其失活可诱发先天性AGR综合征的发生,其基因突变可增加胆道扁平细胞癌、皮肤癌的发病率,可经作用于Jmjd2a/AR信号通路诱导前列腺癌的发生。目前临床上对于GPR48与膀胱癌的关系研究较少,仅有季德才等[23]、王俊勇等[24]认为GPR48基因在膀胱癌组织中异常高表达。基于上述研究背景,本文分析GPR48与膀胱癌演进的关系,结果显示,GPR48在膀胱癌组织中高表达,且与患者分化程度、临床分期、淋巴结转移、浸润深度、复发情况相关,此结果提示GPR48异常高表达与疾病进展相关,在此病的演进过程中具有重要的意义。
另外本研究还对PAK6、ZNF217、GPR48三者之间相关性进行分析,结果显示,PAK6与ZNF217、GPR48均负相关,ZNF217、GPR48之间正相关,提示着三者可能共同参与膀胱癌的发展过程,但目前临床上对于三者与膀胱癌演进的关系研究较少,且本研究所选取的样本量较少,因此本研究结果还需后续研究进一步证实,以期望为临床上膀胱癌的诊治提供研究新方向。
综上所述,本研究发现PAK6在膀胱癌组织中低表达,ZNF217、GPR48在膀胱癌组织中高表达,与患者分化程度、临床分期、淋巴结转移、浸润深度、复发相关,参与膀胱癌的演进。

