miR-1通过PI3K/Akt/mTOR信号通路对高糖诱导的H9c2心肌细胞自噬的影响
赵瑞翔, 赵芯晨, 陆佳, 陈贤格, 毛学
1杭州市余杭区第一人民医院全科医学科(浙江杭州 311400); 2首都医科大学附属宣武医院重症医学科(北京 100032); 3嘉善县第一人民医院心血管内科(浙江嘉兴 314100); 4平阳县妇幼保健院内科(浙江温州 325401)
糖尿病心肌病能够引起微小但持续的心脏损伤,最终可发展为心力衰竭[1]。前人研究发现,高糖可促进心肌细胞自噬,激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路能够抑制自噬,缓解高糖诱导的心肌细胞损伤[2]。另外,microRNAs(miRNAs)是在真核生物中发现的一类内源性的具有基因调控功能的非编码RNA,其大小长约20~25个核苷酸,其中miR-1在糖尿病患者心脏中表达异常[3]。在小鼠缺血性心肌损伤中,miR-1表达上调,可抑制PI3K靶基因的表达,推测抑制miR-1可能是治疗小鼠缺血性心律失常的机制[4]。另外,上调miR-1表达可促使心肌细胞凋亡,并引起心肌细胞损伤[5]。miR-1还可能通过抑制PI3K/Akt信号通路,促进急性心肌梗死患者的不良心室重构[6]。研究显示,PI3K参与多种细胞功能,可与信号蛋白蛋白激酶B(protein kinase B,AKT)结合,磷酸化AKT的Ser308致使AKT活化,AKT通过下游多种途径对靶蛋白进行磷酸化而发挥作用,其中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)为其下游靶蛋白之一,且PI3K/Akt/mTOR信号通路与自噬密切相关[7]。但是,目前miR-1调控PI3K/AKT/mTOR通路对高糖高糖诱导的H9c2心肌细胞自噬的影响鲜见报道。因此,本研究2019年1月至2020年8月,使用33 mmol/L高浓度葡萄糖诱导H9c2心肌细胞同时抑制miR-1表达,观察其对细胞增殖、自噬及PI3K/AKT/mTOR通路的影响,初步探讨其分子机制。
1 材料与方法
1.1 材料 大鼠心肌细胞H9c2(目录号:GNR5)购自中国科学院典型培养物保藏委员会细胞库。主要试剂及仪器:含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基购自美国Giboc公司;RNA提取试剂盒购自北京天根生化科技有限公司;逆转录试剂盒购自美国Genecopoeia公司;双萤光素酶检测试剂盒购自北京索莱宝生物科技有限公司;qRT-PCR检测试剂盒购自上海生工生物科技有限公司;细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)购自济南远达晶美生物科技有限公司;野生型和突变型PI3K 3′ UTR萤光素酶报告基因载体(PI3K WT、PI3K MUT)、miR-1 NC(miR-27a阴性对照)、miR-1模拟物(miR-1 mimics)、miR-1抑制物(miR-1 inhibitor)以及miR-1、U6引物均由上海生工生物工程有限公司合成;Lipofectamine 3000转染试剂盒购自美国Invitrogen公司;葡萄糖、PVDF膜、β-actin鼠抗均购自美国Sigma公司;ECL显色试剂盒和BCA蛋白定量试剂盒均购自北京中山金桥生物科技有限公司;PI3K兔单克隆抗体、Beclin1兔单克隆抗体、LC3兔单克隆抗体、p-AKT兔多克隆抗体、AKT兔多克隆抗体、p-mTOR兔单克隆抗体、mTOR兔单克隆抗体、辣根过氧化物酶标记羊抗兔IgG二抗均购自美国Abcam公司;酶标仪Fax-20100购自美国INStat公司;TL988 qRT-PCR仪购自西安天隆科技有限公司;全能型凝胶成像分析系统ChemiDoc-MP购自山东三瑞科技有限公司。
1.2 方法
1.2.1 细胞培养与分组 大鼠心肌细胞H9c2使用含10%胎牛血清的DMEM培养基(含100 U/mL青霉素和100 μg/mL链霉素),置于37℃、5% CO2培养箱中培养,待细胞生长密度达80%~90%左右时,进行传代培养。
将H9c2细胞随机分为4组:正常组使用普通培养基培养,未转染;诱导组使用含33 mmol/L葡萄糖[8]的培养基培养;miR-1 NC组细胞转染miR-1 NC后,使用含33 mmol/L葡萄糖的培养基培养;miR-1 inhibitor组细胞转染miR-1 inhibitor后,使用含33 mmol/L葡萄糖的培养基培养。在加入葡萄糖诱导前48 h,使用Lipofectamine 3000转染试剂盒分别转染细胞miR-1 NC或miR-1 inhibitor。
1.2.2 qRT-PCR检测正常H9c2细胞和高糖诱导的H9c2细胞中miR-1表达水平 葡萄糖诱导24 h后,采用RNA抽提试剂盒提取细胞总RNA,逆转录试剂盒得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒详细说明书配置PCR反应体系并设定反应程序。以U6作为内参,根据2-ΔΔCt算法,计算miR-1表达水平。miR-1和U6引物序列见表1。

表1 qRT-PCR引物序列
1.2.3 生物信息学预测和双萤光素酶验证miR-1和PI3K的靶向关系 采用Genecard数据库(https://www.genecards.org/)对miR-1和PI3K的结合位点进行预测。取对数生长期的H9c2细胞接种于96孔板,常规培养24 h后,将细胞分为miR-1 mimics+PI3K WT组、miR-1 NC+PI3K WT组、miR-1 mimics+PI3K MUT组和miR-1 NC+PI3K MUT组,每组设6个复孔,使用Lipofectamine 3000转染试剂盒进行细胞共转染。转染48 h后,使用双萤光素酶检测试剂盒检测萤光素酶活性,具体操作按照试剂盒说明书进行,验证miR-1和PI3K的靶向关系。
1.2.4 CCK-8法检测各组H9c2细胞增殖活性 收集各组细胞,每孔各取100 μL接种至96孔板中,按照CCK-8检测试剂盒说明书,加入浓度为10%的CCK-8溶液,继续培养2 h后,使用Fax-20100酶标仪测定各孔在450 nm波长下的OD值。依据公式:细胞增殖率(%)=(实验组OD450nm-空白组OD450nm)/(对照组OD450nm-空白组OD450nm),计算各组H9c2细胞的增殖率。
1.2.5 透射电子显微镜观察各组H9c2细胞自噬形态 收集各组细胞,加入2.5%戊二醛溶液4℃过夜固定,磷酸盐缓冲液清洗,1%锇酸溶液4℃固定2 h后,低浓度到高浓度丙酮溶液梯度脱水,依次进行渗透、包埋、聚合、切片和染色等步骤后,于透射电子显微镜下观察各组细胞自噬形态。
1.2.6 共聚焦显微镜观察各组H9c2细胞自噬流 将各组H9c2细胞置于35 mm共聚焦皿中培养,当生长密度达60%~80%时,将mRFP-GFP-LC3双荧光标记自噬腺病毒滴加如培养皿中,然后置于37℃的培养箱中培养2 h,更换培养基后,继续培养24 h后,置于共聚焦显微镜中观察自噬流变化。其中绿色荧光(GFP)和红色荧光(RFP)相融合后形成的黄色荧光(Merge)即为自噬小体。
1.2.7 Western blot法检测各组H9c2细胞中自噬相关蛋白及通路蛋白表达水平 收集各组细胞,使用蛋白提取试剂盒提取总蛋白。使用BCA蛋白定量试剂盒对蛋白进行定量,然后依次进行SDS-聚丙烯酰胺凝胶电泳(PAGE)、转PVDF膜、脱脂奶粉封闭、1∶2 000浓度稀释后的Beclin1、LC3-Ⅰ、LC3-Ⅱ、p65、PI3K、p-AKT、AKT、p-mTOR、mTOR、β-actin一抗4 ℃过夜孵育、含辣根过氧化物酶缀合的二抗(1∶5 000)中室温孵育2 h,用ECL显色试剂盒显色,以β-actin内参,全能型凝胶成像分析系统分析蛋白表达水平。

2 结果
2.1 正常心肌细胞和高糖诱导的心肌细胞中miR-1和PI3K蛋白表达水平比较 与正常组相比,诱导组细胞中miR-1表达水平显著升高(P<0.05),PI3K蛋白表达水平显著降低(P<0.05)。见图1和表2。

图1 对照组和诱导组中PI3K蛋白表达(Western blot)

表2 细胞中miR-1和PI3K蛋白表达水平比较
2.2 抑制miR-1对高糖诱导的心肌细胞H9c2增殖活性的影响 与正常组相比,诱导组H9c2细胞miR-1水平显著升高,细胞增殖率显著降低(P<0.05);与诱导组和miR-1 NC组相比,miR-1 inhibitor组H9c2细胞miR-1水平显著降低,细胞增殖率显著升高(P<0.05)。见表3。
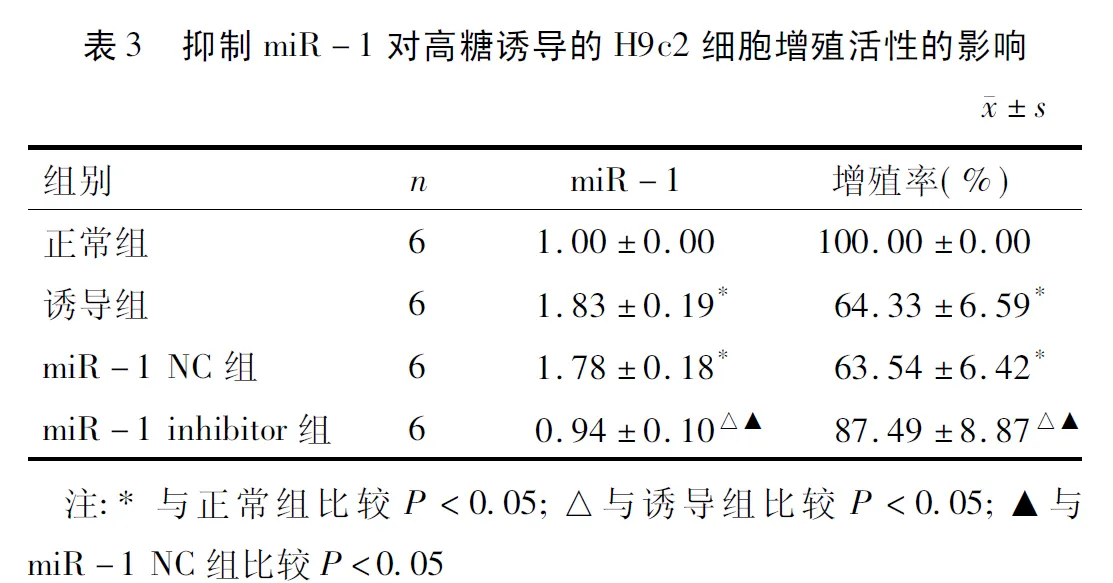
2.3 抑制miR-1对高糖诱导的心肌细胞H9c2自噬的影响 正常组H9c2细胞未见明显自噬小体形成,与正常组相比,诱导组H9c2细胞自噬小体增多;与诱导组和miR-1 NC组相比,miR-1 inhibitor组H9c2细胞自噬小体减少。见图2~3。
注:箭头代表自噬小体;A:正常组;B:诱导组;C:miR-1 NC组;D:miR-1 inhibitor组

图3 各组H9c2细胞自噬小体荧光图
2.4 抑制miR-1对高糖诱导的心肌细胞H9c2自噬相关蛋白的影响 与正常组相比,诱导组H9c2细胞Beclin1表达水平和LC3-Ⅱ/LC3-Ⅰ比值显著升高,p62蛋白表达水平显著降低(P<0.05);与诱导组和miR-1 NC组相比,miR-1 inhibitor组H9c2细胞Beclin1表达水平和LC3-Ⅱ/LC3-Ⅰ比值显著降低,p62蛋白表达水平显著升高(P<0.05)。见图4和表4。
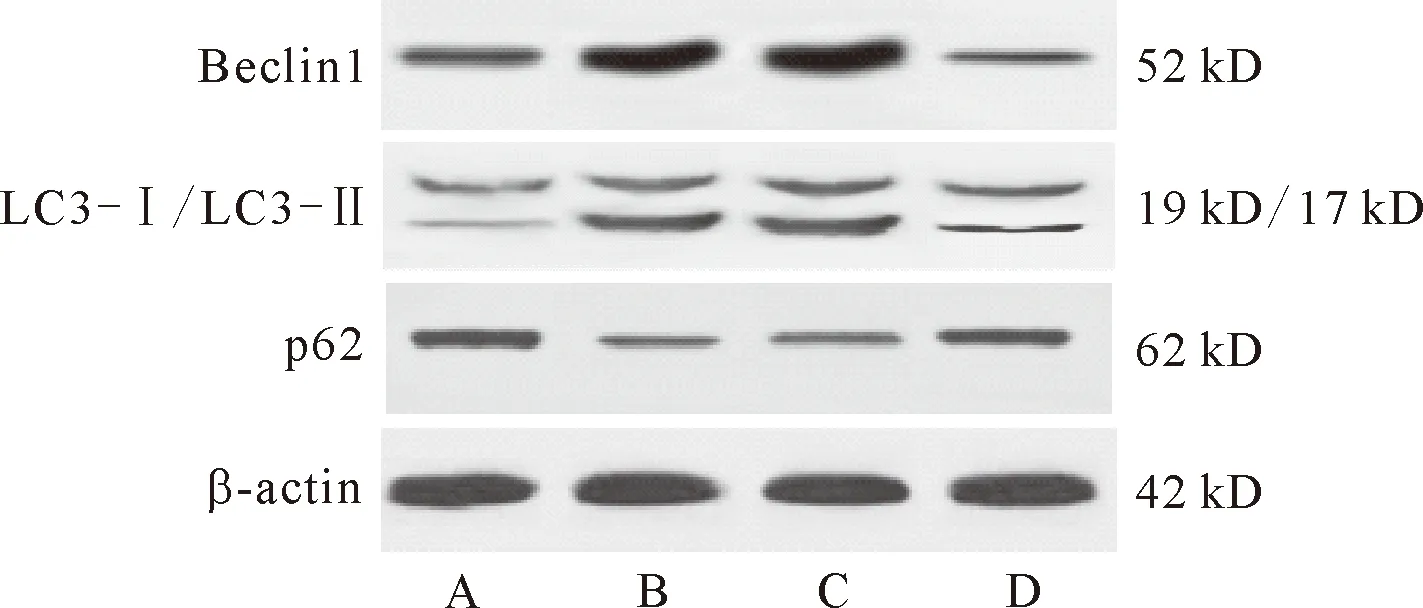
注:A:正常组;B:诱导组;C:miR-1 NC组;D:miR-1 inhibitor组

表4 各组细胞中Beclin1和P62蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值比较
2.5 下调miR-1对高糖诱导的心肌细胞中PI3K/Akt/mTOR信号通路蛋白表达的影响 与正常组相比,诱导组H9c2细胞PI3K蛋白表达及Akt、mTOR蛋白磷酸化水平显著降低(P<0.05);与诱导组和miR-1 NC组相比,miR-1 inhibitor组H9c2细胞PI3K、Akt、mTOR蛋白磷酸化水平升高(P<0.05)。见图5和表5。
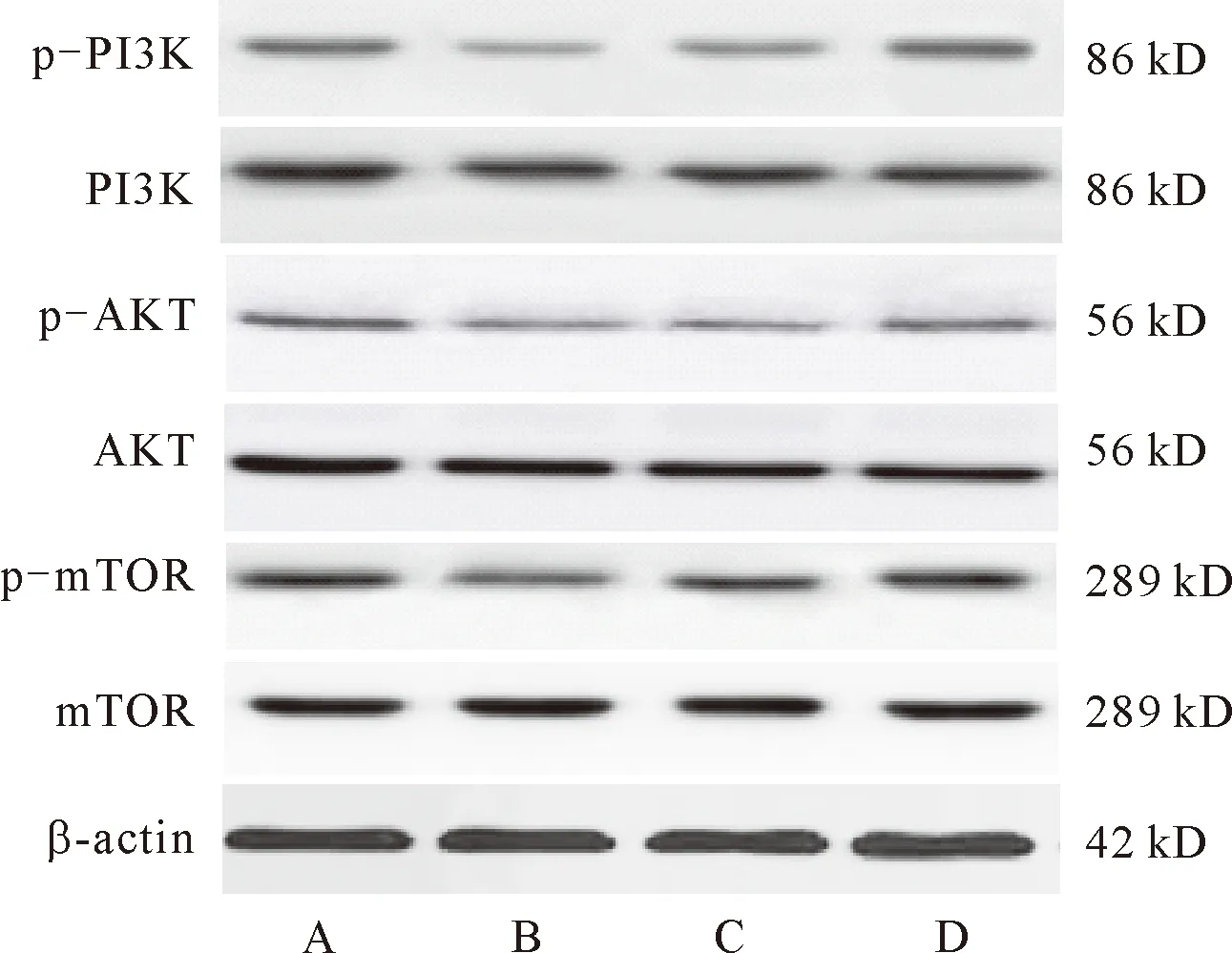
注:A:正常组;B:诱导组;C:miR-1 NC组;D:miR-1 inhibitor组

表5 各组细胞中PI3K蛋白表达及Akt和mTOR蛋白磷酸化水平比较
2.6 miR-1和PI3K基因靶向关系的预测与验证 生物信息学预测结果显示,miR-1序列上存在与PI3K3′UTR结合的连续位点。我们运用双萤光素酶实验对其进行验证,发现共转染miR-1 mimics和PI3K WT报告载体时,细胞萤光素酶活性受到明显抑制(P<0.05);而共转染miR-1 mimics和PI3K-MUT报告载体及转染miR-1 NC和PI3K WT或PI3K MUT报告载体的细胞,萤光素酶活性无抑制作用(P>0.05)。见图6~7。

注:WT:wild-type,野生型;MUT:mutant-type,突变型;UTR:untranslated region,非翻译区
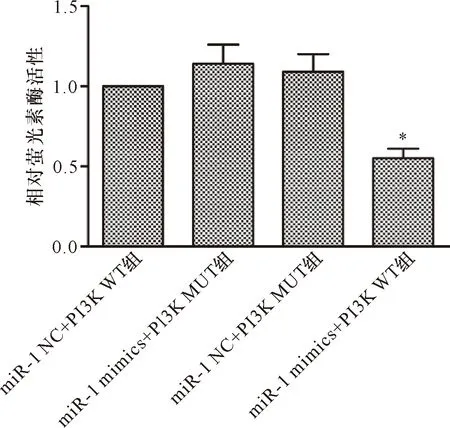
注:WT:wild-type,野生型;MUT:mutant-type,突变型;*与miR-1 NC+PI3K WT组比较P<0.05
3 讨论
糖尿病心肌病是糖尿病患者在排除冠心病、高血压和冠状动脉粥硬化等疾病后,产生的心肌代谢紊乱,心肌间质增生和微血管病变等特异性疾病[9]。
另外,Delfan等[10]研究发现miR-1在糖尿病患者心脏中表达水平显著升高,而高强度间歇训练能够抑制miR-1表达,进而降低糖尿病性心肌病的发生率。本研究以大鼠心肌细胞H9c2细胞为研究对象,使用33 mmol/L葡萄糖诱导心肌细胞H9c2后发现,高糖诱导可使H9c2细胞中miR-1表达水平显著升高,且显著降低细胞增殖率,提示高糖引起的miR-1异常表达可抑制心肌细胞增殖。
miR-1基因沉默对高糖诱导的心肌细胞损伤具有抑制作用,其机制可能与细胞自噬有关[11]。肝孤核受体激动剂可缓解高糖诱导的H9c2细胞损伤,而miR-1过表达却消除了肝孤核受体激动剂发挥的缓解作用[12],并且miR-1已被证实是治疗糖尿病心肌病的主要靶点[13]。另外,自噬蛋白Beclin1、LC3-Ⅰ、LC3-Ⅱ表达水平可反映自噬程度,自噬溶酶体降解底物p62表达的增加与自噬水平呈负相关[14]。而高糖环境可引起视网膜血管内皮细胞自噬[15]。本研究发现,高糖诱导的心肌细胞H9c2中,Beclin1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值显著升高自噬小体增多,p62蛋白表达水平显著降低,提示高糖诱导的H9c2心肌细胞自噬活性增强,但其中的机制尚需进一步研究。
PI3K/Akt/mTOR信号通路与高糖诱导的心肌细胞自噬密切相关[16],抑制PI3K/Akt信号通路,降低p-Akt水平,可促使大鼠肝星状细胞自噬的发生,引起细胞损伤[17];激活PI3K/Akt/mTOR信号转导通路,可通过抑制自噬,明显改善缺氧预处理对高糖心肌细胞缺氧/复氧损伤的保护作用[18]。本研究结果显示,高糖诱导的心肌细胞H9c2中,PI3K、Akt、mTOR蛋白磷酸化水平显著降低,提示,高糖诱导下H9c2心肌细胞中PI3K/Akt/mTOR信号通路处于抑制状态。Chen等[19]研究发现胰岛素能够通过Akt的激活改善氧化应激下miR-1诱导的H9c2细胞损伤。而Wu等[20]研究发现增加miR-1的表达,可抑制心肌损伤细胞PI3K/Akt/mTOR信号通路。为进一步探究miR-1和PI3K间的靶向关系,本研究使用生物信息学预测和双萤光素酶验证发现,miR-1和PI3K间存在靶向关系。本研究进一步通过将miR-1 inhibitor转染至H9c2细胞后,使用高糖诱导,发现抑制miR-1可显著降低高糖下H9c2细胞中miR-1水平、Beclin1蛋白表达水平以及LC3-Ⅱ/LC3-Ⅰ比值,减少自噬小体,显著提高细胞增殖率、p62蛋白表达水平以及PI3K、Akt、mTOR蛋白磷酸化水平,提示抑制miR-1表达,可通过激活PI3K/Akt/mTOR信号通路,抑制H9c2细胞自噬。
综上所述,高糖诱导可使心肌细胞中miR-1表达水平升高,而抑制miR-1表达,可能通过激活PI3K/Akt/mTOR信号通路,进而抑制H9c2细胞自噬。但是高糖诱导的心肌细胞中的作用机制较为复杂,尚需深入研究。

