熏烟联合H1N1流感病毒感染对小鼠气道灌洗液免疫细胞的影响*
蔡甜甜, 吴蕾, 陈瑞凤, 杜秋伶, 范龙, 王奇, 林琳, 于旭华△
1广州中医药大学第二临床医学院呼吸科(广东广州 510030); 2广州医科大学附属第一医院广州呼吸健康研究院呼吸疾病国家重点实验室/国家呼吸系统疾病临床医学研究中心(广东广州 510180); 3广州中医药大学 (广东广州 510006)
吸烟是导致慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发生的重要原因,而呼吸道病毒感染是诱发COPD急性加重的重要因素[1]。病毒感染的免疫应答是宿主自我保护的基本防线。目前国内对香烟暴露联合流感病毒感染的研究报道较少。因此,2018年8月至2020年5月,本研究通过通过短期香烟烟雾暴露及气道流感病毒滴注的方法,观察攻毒后7 d内小鼠气道灌洗液免疫细胞分类计数、免疫细胞氧化应激能力以及灌洗液蛋白浓度的变化,为后续研究提供实验基础。由于呼吸道病毒感染是导致COPD由稳定期向急性期过度的特殊病理阶段,因此本研究一方面旨在明确吸烟对呼吸道病毒感染后宿主免疫应答的影响,另一方面也探讨呼吸道病毒感染在诱发COPD急性加重过程中的免疫病理改变,为研发针对本阶段预防COPD急性加重的药物提供研究基础。
1 材料与方法
1.1 药物及试剂 大前门过滤嘴香烟(烟碱含量 0.8 mg,焦油量11 mg /支,上海烟草集团有限责任公司出品)。毒株为H1N1(A/PR/8/34)流感病毒鼠肺适应株(MEM溶媒),由广州市呼吸健康研究院提供,于-80℃低温保存。Kwik-Diff(Thermo Fisher Scientific,No.9990700),Acridine Orange hydrochloride Solution(Sigma, No.8097-10ML),Ethidium bromide(Sigma, No.E1510-10ML),TRIzol® Reagent(life technologies, No.15596026)。PDB(2-丁酸佛波醇酯;Sigma aldrich,No.P1269)和L-012(8-氨基-5-氯-7-苯基-2,3-二氢吡啶并[3,4-d]哒嗪-1,4-二酮;Wako Pure ChemicalIndustries,No.120-04891),BCA蛋白测定试剂盒(Thermo Fisher Scientific,No.UH289368)。
1.2 仪器 多功能台式冷冻离心肌(Allegra X-22R),显微镜(BX61+DP720,Olympus),酶标仪(Tacan)。
1.3 实验动物 由斯贝福(北京)生物技术有限公司购置6~8 周龄雌性SPF级Balb/c小鼠,动物许可证号:NoSCXK(京)2016-0002,所有操作和实验流程均遵守《实验动物管理条例》。自由饮水和摄食,适应性饲养3 d后开始进行实验。
1.4 动物的分组及造模
1.4.1 动物分组 选取SPF级雌性Balb/c小鼠,随机分成7组:分别为假熏烟假攻毒组,假熏烟攻毒组(6PFU),假熏烟攻毒组(12PFU),假熏烟攻毒组(24PFU),熏烟联合攻毒组(6PFU),熏烟联合攻毒组(12PFU),以及熏烟联合攻毒组(24PFU)。
1.4.2 熏烟方法 熏烟方法参考本课题组前期熏烟方法[2-3],小鼠置于18 L熏烟箱中进行熏烟,以6 mL/s的速度抽取香烟烟雾至60 mL注射器,随即将烟雾注入熏烟箱中。每天3次予以被动吸烟,于9am、12am、3pm进行,每次3支大前门香烟(20支/包,烟碱含量0.8 mg,焦油量11 mg/支,一氧化碳含量13 mg/支),每次持续1 h,连续4 d后进行后续实验。假熏烟小鼠放入另一干净且相同大小的塑料箱内,不做熏烟处理,其余操作同熏烟组小鼠。
1.4.3 攻毒方法 小鼠进行常规喂养,于第5天进行攻毒。用1 mL注射器共抽取2 mL异氟烷均匀洒在麻醉瓶中,随后将小鼠置于麻醉瓶中旋紧瓶盖,待小鼠出现深快呼吸后取出,迅速向小鼠鼻内滴注PR8病毒30 μL/只。假攻毒组鼻内滴注MEM培养基 30 μL/只,其余操作同攻毒组小鼠。分别观察攻毒后3、5、7 d小鼠变化。
1.5 样本制备 小鼠用4%戊巴比妥钠腹腔注射安乐死,切开气管处皮毛,充分暴露气管,插入气管灌洗管(剪成楔形的24 G静脉留置针),分4次抽取0.4、0.3、0.3、0.3 mL的PBS并回抽(共约1 mL),用于细胞计数,分类计数及蛋白含量检测。
1.6 检测内容
1.6.1 小鼠支气管肺泡灌洗液细胞计数和细胞分类计数的测定 将气道灌洗液混匀,加入20 μL AO/EB工作液混匀,将细胞计数板置于荧光显微镜下进行有核细胞计数,剩余灌洗液进行涂片离心,Kwik-Diff染色。通过形态区分进行细胞分类计数。
1.6.2 小鼠支气管肺泡灌洗液细胞ROS产生速率的检测 选用不透光的黑色96孔板,每孔加入50 μL细胞混悬液、150 μL L-O12工作液和20 μL PDB工作液。检测前加入20 μL PDB进行刺激。之后立即选择Luminescence功能进行化学发光测定,激发波长488 nm,发射波长520 nm,每孔测定1 s,共30个循环,间隔45 s。通过50 μL细胞悬液的细胞总数和细胞密度计算ROS的产生速率,用相对光单位(RLU)表示。
1.6.3 小鼠支气管灌洗液蛋白浓度测定 运用BCA蛋白定量试剂盒检测各灌洗液中的蛋白含量,用酶标仪检测562 nm波长下的吸光度,最后根据标准曲线计算出各个样品的蛋白浓度。
1.7 统计学方法 采用prism7.0统计软件,多组比较采用one-way ANOVA方法进行比较,进一步两两比较,采用Tukey检验。实验结果以均数±标准误表示,以P<0.05为差异有统计学意义。
2 结果
2.1 熏烟联合病毒感染对小鼠灌洗液中细胞计数的影响 攻毒3 d后,与假熏烟假攻毒组相比,假熏烟攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.01)、巨噬细胞计数(P<0.01)、中性粒细胞计数(P<0.05)和淋巴细胞计数(P<0.05)均明显升高,熏烟联合攻毒组(6PFU)和熏烟联合攻毒组(12PFU)气道灌洗液巨噬细胞计数明显增多(P<0.01);熏烟联合攻毒组(24PFU)气道灌洗液巨噬细胞计数(P<0.01)、淋巴细胞计数(P<0.05)明显增多。见表1。
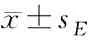
表1 攻毒3d后气道灌洗液细胞总数及细胞分类计数
攻毒5 d后,与假熏烟假攻毒组相比,假熏烟攻毒组(12PFU)小鼠气道灌洗液巨噬细胞计数明显增多(P<0.05),假熏烟攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.05)和巨噬细胞计数(P<0.05)明显增多,熏烟联合攻毒组(6PFU)小鼠气道灌洗液巨噬细胞计数明显增多(P<0.05),熏烟联合攻毒组(12PFU)小鼠气道灌洗液细胞总数(P<0.01)、巨噬细胞计数(P<0.01)明显增多,熏烟联合攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.01)、巨噬细胞计数(P<0.01)、中性粒细胞计数(P<0.01)和淋巴细胞计数(P<0.01)明显增多。并且与假熏烟攻毒组(24PFU)小鼠相比,熏烟联合攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.01)和中性粒细胞总数明显增多(P<0.05)。见表2。

表2 攻毒5 d后气道灌洗液细胞总数及细胞分类计数
攻毒7 d后,与假熏烟假攻毒组相比,假熏烟攻毒组(12PFU)小鼠气道灌洗液细胞总数(P<0.01)、巨噬细胞计数(P<0.01)和中性粒细胞计数(P<0.01)明显增多,假熏烟攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.01)和巨噬细胞计数(P<0.01)明显增多;熏烟联合攻毒组(24PFU)小鼠气道灌洗液细胞总数(P<0.01)、巨噬细胞计数(P<0.01)明显增多。与熏烟联合攻毒组(12PFU)相比,假熏烟联合攻毒组(12PFU)小鼠气道灌洗液细胞总数(P<0.05)、巨噬细胞计数(P<0.05)和中性粒细胞计数(P<0.01)明显增多。见表3。
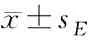
表3 攻毒7 d后气道灌洗液细胞总数及细胞分类计数
2.2 熏烟联合病毒感染对小鼠气道灌洗液细胞ROS产生的影响 与假熏烟假攻毒组相比,假熏烟攻毒组(24PFU)在病毒感染3 d后小鼠气道灌洗液中ROS明显升高(P<0.05),假熏烟攻毒组(12PFU)在病毒感染7 d后小鼠气道灌洗液中ROS明显升高(P<0.01);熏烟联合攻毒组(24PFU)在病毒感染5 d后小鼠气道灌洗液中ROS明显升高(P<0.01)。与假熏烟攻毒组(24PFU)相比,熏烟联合攻毒组(24PFU)在病毒感染5 d后小鼠气道灌洗液中ROS明显升高(P<0.05);与熏烟联合攻毒组(12PFU)相比,假熏烟联合攻毒组(12PFU)在病毒感染7 d后小鼠气道灌洗液中ROS明显升高(P<0.01)。见表4。

表4 ROS的产生 (1 000个细胞·s)
2.3 熏烟联合病毒感染对小鼠灌洗液蛋白浓度的影响 与假熏烟假攻毒组相比,在病毒感染3 d后,假熏烟攻毒组(6PFU、12PFU、24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.01);熏烟联合攻毒组(6PFU、12PFU、24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.01)。
在病毒感染5 d后,假熏烟攻毒组 (6PFU、12PFU、24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.01);熏烟联合攻毒组(6PFU、12PFU、24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.01)。
在病毒感染7 d后,假熏烟攻毒组(6PFU、12PFU、24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.05,P<0.01);熏烟联合攻毒组(24PFU)小鼠气道灌洗液蛋白浓度明显升高(P<0.01)。见表5。

表5 灌洗液蛋白浓度表达量
3 讨论
本研究主要是观察香烟烟雾短期(4 d)暴露对流感病毒感染小鼠气道灌洗液免疫细胞数量,产生ROS的能力以及灌洗液蛋白浓度的影响。研究中的香烟烟雾的产生方法,模拟人类吸烟的频率和速度,并且造成和人类吸烟者相似的CoHb水平,从而说明此种暴露方式下的小鼠香烟暴露程度和人类具有相似的水平[4]。不同于以往病毒性肺炎所需的病毒诱导滴度,COPD中病毒感染尽管可诱导一定程度的气道炎症,但可能并没有造成严重的肺损伤。因此本实验选用了较低的病毒滴度进行感染[5-6]。
病毒作为病原体入侵气道上皮细胞,气道上皮细胞可表达多种模式识别分子以识别病原体,从而激活信号通路并释放抗病毒物质及炎症因子,同时又会迅速募集附近免疫细胞到达受损、感染部位,对病原体进行杀伤和清除快速引起机体免疫反应[7-8]。研究表明,H1N1流感毒株感染导致假熏烟小鼠和熏烟小鼠气道细胞总数及分类计数在感染初期(第3天)呈滴度依赖性升高。然而,24PFU H1N1流感病毒在假熏烟小鼠气道内诱导的免疫细胞的总数和分类计数略高于熏烟小鼠(P>0.05)。随着感染时间的推移,尽管24PFU H1N1流感病毒导致假熏烟小鼠气道灌洗液细胞总数逐渐升高,但与第3天相比,第7天小鼠气道中性粒细胞数量下降,而巨噬细胞和淋巴细胞数量明显增多,说明气道炎症逐渐由急性期向慢性期恢复期过度。然而在熏烟小鼠体内,流感病毒(24PFU)感染后第5天细胞总数和中性粒细胞计数达到高峰,且峰值水平与假熏烟小鼠第3天水平相似。流感病毒(12PFU)感染后第7天,假熏烟小鼠气道细胞总数达到峰值,而熏烟小鼠气道数量则维持在相对较低水平, 说明熏烟导致气道免疫细胞募集的延迟, 因此香烟暴露可能导致宿主抗病毒防御功能的异常。与本研究相似,Hsu等[5]研究表明,香烟暴露降低了机体对流感病毒感染的应答,如γ干扰素、肿瘤坏死因子-α、干扰素诱导蛋白10(IP-10)、白细胞介素-10(IL-10)等细胞因子的分泌。Wu 等[9]研究表明,吸烟者的气道上皮细胞抗病毒应答受损。另一方面,有研究表明,香烟烟雾直接通过影响病毒的复制从而限制了病毒复制的程度[10],因此病毒在体内复制异常也可能是香烟暴露导致气道免疫细胞数量变化的原因。
ROS作为活性氧物质具有强氧化作用,因而是吞噬细胞(中性粒细胞、巨噬细胞)杀死入侵微生物的主要武器,因此免疫细胞应激能力的下降或反应延迟可能会增加继发细菌等微生物感染的可能性[11]。对慢性肉芽肿疾病患者研究发现其机体内活性氧生成活力低下,白细胞不能有效地引起呼吸爆发从而使这类患者易受真菌等微生物的感染而威胁生命[12]。可见由吞噬细胞所产生的ROS是宿主防御入侵病原体所必需的。本次研究表明, 气道免疫细胞ROS的产生速率的变化与气道灌洗液细胞数量的变化趋势一致。即流感病毒(24PFU)导致假熏烟小鼠气道免疫细胞ROS产生速率高峰在第3天, 而熏烟小鼠气道免疫细胞ROS产生速率高峰在第5天。说明香烟暴露延迟气道免疫细胞的功能达到高峰的时间。有研究表明,香烟暴露导致吞噬细胞的细菌清除能力下降[13],从而进一步说明香烟会使免疫反应和免疫细胞的功能减退或反应迟钝,可能是后面细菌介入并导致真正的COPD急性加重的原因[14]。尽管如此,大量研究仍然表明,香烟烟雾的暴露,促进流感病毒感染小鼠ROS的产生[11,15],这可能与特定时间点以及病毒特性的差异有关。
气道灌洗液蛋白主要包括气道免疫细胞及上皮细胞所分泌的炎症介质、酶、黏蛋白等。本次实验中小鼠气道灌洗液蛋白含量在病毒感染后3、5、7 d,各组小鼠气道灌洗液蛋白含量均明显升高,且熏烟联合攻毒组与假熏烟联合攻毒组小鼠灌洗液蛋白含量在各时点无明显差异。说明香烟烟雾暴露虽会引起流感感染小鼠气道免疫细胞募集以及杀伤力高峰的延迟,但并没有改变气道炎症介质等分泌蛋白的总体水平。研究表明,香烟烟雾可引起或加重与氧化应激和炎症相关的多种肺部疾病,并可影响流感病毒导致的细胞因子的表达[16-17],与本研究并不一致,原因可能在于灌洗液中蛋白总体水平与细胞因子分泌的水平不一致。

