第4版WHO分化型甲状腺癌病理分类及其进展
唐 娟, 刘志艳
(上海交通大学附属第六人民医院病理科,上海 200233)
甲状腺癌是最常见的内分泌恶性肿瘤,其中以甲状腺乳头状癌(papillary thyroid carcinoma,PTC)多见。在成人,PTC占所有甲状腺恶性肿瘤的80%~85%,儿童占90%。美国PTC诊断的中位年龄为50岁,90%的病人诊断年龄在20~74岁。近几十年来,全世界所有年龄组和所有病例中,PTC的发病率一直在上升;报告的发病率与筛查和诊断方法有关[1]。甲状腺滤泡癌(follicular thyroid carcinoma,FTC)、未分化癌和髓样癌发病率无明显变化[2]。甲状腺癌的发生与大剂量外源性离子放射暴露、肥胖和环境污染等因子有关[3-4]。PTC死亡率相对稳定[1,5],但我国PTC 10年生存率 (84.3%)与欧美国家(99.4%)相比,仍有较大差距[6]。
甲状腺癌的病理诊断方法以术前超声引导细针穿刺细胞学、粗针穿刺、术中快速冷冻病理诊断、术后常规病理诊断为主。治疗方法包括手术切除、术后甲状腺激素抑制治疗、复发和转移病例的放射性碘治疗以及精准靶向治疗等。其中精准靶向治疗正在从抗血管生成药物、多靶点靶向药物向单、双靶向药物过渡。2017年WHO在甲状腺癌分类中引入癌基因图谱工程数据,尝试在形态学分类的基础上,结合癌基因组特征进一步分类,有助于进一步了解甲状腺肿瘤的遗传学和基因组学特征[7-12]。本文对分化型甲状腺癌(differentiated thyroid carcinoma,DTC)病理分类及其最新进展进行阐述。
甲状腺滤泡上皮细胞起源肿瘤分类
甲状腺滤泡由滤泡上皮细胞混合滤泡旁细胞组成,两者具有不同的功能。滤泡上皮细胞分泌甲状腺激素调节新陈代谢。滤泡旁细胞分泌降钙素调节血钙水平。根据2017年WHO甲状腺肿瘤分类,甲状腺滤泡上皮细胞起源的恶性肿瘤包括PTC、FTC、嗜酸细胞癌(Hurthle cell carcinoma,HCC)、低分化癌 (poorly differentiated carcinoma,PDC)和间变性甲状腺癌 (anaplastic thyroid carcinoma,ATC)[6,13-14]。前三种为DTC,通常可治愈。但越来越多的研究表明,其中部分高侵袭性和致命性甲状腺癌或可进展为PDC和ATC。绝大多数PTC和FTC对放射性碘治疗敏感。但有报道表明,具有BRAFV600E/RAS基因与TERT启动子复合性突变的DTC预后差,对碘治疗不敏感[15]。HCC耐受放射性碘治疗者较多[16]。
PTC
PTC通常具有典型PTC细胞核特征。肿瘤细胞生长方式可为乳头状、滤泡状、实体性、梁状等。如缺乏典型乳头和浸润,PTC型细胞核为诊断的必要条件,包括核型和大小、核膜不规则度、毛玻璃核[16-18]。亚洲工作组对比世界各地区的内分泌病理医师对PTC细胞核判读的研究表明,亚洲地区病理医师判读明显比西方国家严格,但一致性中等,存在判读者间和判读者不同时间段的差异[19-21]。2021年国际癌症报告联盟(International Collaboration on Cancer Reporting,ICCR)推荐,甲状腺规范化报告应包括肿瘤部位、病灶和肿瘤大小、具有临床意义的组织学类型、核分裂像和肿瘤性坏死、肿瘤包膜/界限、包膜浸润、淋巴和血管浸润(blood vessel invasion,BVI)、甲状腺外浸润、淋巴结状态等核心要素[22]。
一、PTC组织学类型
2017版WHO中PTC可分为14个亚型(见表1)。高侵袭组织形态、被膜外浸润和淋巴结转移等提示肿瘤复发风险高[8]。绝大多数甲状腺癌核分裂像非常低。核分裂像升高的情况下(≥3个核分裂像/2 mm2)需进行计数。如未升高,可表示为<3个核分裂像/2 mm2。
2021年ICCR甲状腺规范化报告要求报告优势肿瘤的高侵袭性组织学亚型,包括高细胞型(tall cell variant)、鞋钉型(hobnail variant)、柱状细胞型(columnar cell variant)和实体/梁状型(solid trabecular variant,STV)(见表1)。其他亚型多无特殊预后意义,因而ICCR甲状腺规范化报告中不做分类要求。

表1 2017版WHO的PTC亚型及诊断标准
高细胞型PTC中超过30%的肿瘤细胞高度是宽度的2~3倍(见图1),无病生存率低,术后易复发和转移,生存期短,其中部分发生间变[23-24]。常见BRAFV600E基因突变和TERT启动子突变[8,18,25-27]。PTC多发生淋巴管侵犯,但也可发生血管侵犯。所侵犯脉管因其管径较大,且管壁存在平滑肌而常易识别为血管。但在某些情况下,无法明确所浸润薄壁脉管类型的,可使用“无法分类的小脉管”来描述。
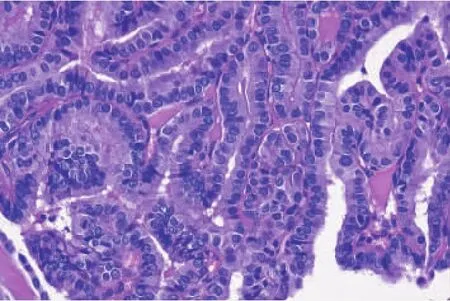
图1 高细胞型PTC
鞋钉型 PTC罕见,为2017版新增类型,特指≥30%肿瘤细胞具有鞋钉特点的PTC(见图2)。形态学上表现为多级乳头、微乳头、肿瘤细胞极性和黏附性消失[28],易见坏死、核分裂像、血管淋巴管浸润、甲状腺外侵犯。常见复发、淋巴结或远处器官转移。笔者前期研究表明,这些癌细胞不同程度丢失上皮标志物E钙黏着蛋白(cadherin)和β联蛋白(catenin)的表达,而间叶组织标志物波形蛋白(vimentin)表达增多且不规则。因而提出假说,肿瘤细胞极性和黏附性消失为甲状腺癌上皮间叶转化的组织学特征[29]。BRAFV600E突变为该型最常见的基因突变,其次是TP53基因突变。

图2 鞋钉型PTC
柱状细胞型PTC亦罕见,约占PTC的0.2%。主要由假复层柱状细胞构成。与高细胞型不同的是,柱状细胞型特点为细胞核拉长浓染,缺乏经典型PTC细胞核特征,细胞学上易误诊。通常细胞丰富,呈细乳头状或腺样结构,被覆假复层上皮。偶可见肿瘤细胞核下空泡或子宫内膜癌样、肠腺癌样透明细胞质。通常表达消化道肿瘤标志物CDX-2,易与转移性肠腺癌相混淆。但柱状细胞型PTC可不同程度表达甲状腺滤泡上皮细胞标志物TTF-1。该型预后与肿瘤亚分型有关。具有包膜者预后好,浸润性生长且伴腺外浸润者预后差。同经典型PTC相似,约1/3的柱状细胞型PTC具有BRAFV600E基因突变。
目前已报道的甲状腺滤泡上皮细胞起源的癌伴副肿瘤综合征者少见,而伴β人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)分泌者尤为罕见。笔者报道1例伴有β-hCG分泌的浸润型柱状细胞型PTC,未见滋养叶细胞分化。同侧颈部淋巴结可见癌转移,伴淋巴管内癌栓,但无血管内癌栓,浸润至甲状腺被膜外脂肪结缔组织,pT2N1bMx。术后仅行TSH抑制治疗,随访5年余无复发和转移。伴或不伴β-hCG分泌的柱状细胞型PTC均预后较好,是否与β-hCG拟TSH活性有关,均尚需更多病例和相关研究证实。
实体型占所有成人PTC的1%~3%,在儿童中常见[30-31]。STV-PTC的诊断需在100%或接近100%的肿瘤中出现实性、梁状或巢状结构(见图3)。肿瘤细胞以圆形细胞核为主,具有PTC核特征。STVPTC由于其生长模式,不应被误认为侵袭性甲状腺癌的岛状生长模式。与非辐射相关的RET/PTC1病例相比,辐射相关的STV-PTC通常存在RET/PTC3重排。BRAFV600E突变在STV-PTC中很少见。与经典型PTC相比,实体型PTC预后差。
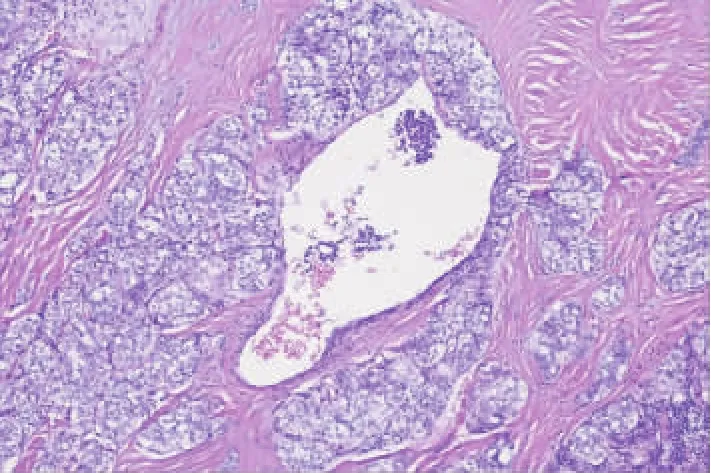
图3 实性梁状型PTC
二、PTC分子特征
PTC癌基因工程采用二代测序技术、基因拷贝数检测技术、表观遗传学和蛋白质组学分析技术等,整合PTC基因组学,尝试阐述PTC发生机制。与其他恶性肿瘤相比,PTC基因学改变相对简单,突变负荷低,拷贝数变化少,因而多数呈惰性生物学行为[7-8]。MAPK信号通路在甲状腺癌发病机制中发挥重要作用。PTC主要由相互排斥的基因改变所驱动。其中点突变约占75%,以BRAF、RAS家族基因突变以及RET和NTRK基因融合最常见。基因融合约占15%,仅7%由拷贝数改变作为肿瘤驱动因子。TERT启动子突变见于9%的PTC,与肿瘤高复发风险、低分化和高死亡风险相关。
三、基因型-形态学表型相关性
TCGA数据库将PTC分为BRAFV600E样(BRAFV600Elike,BVL)和RAS样两组。BVL型PTC多为经典型或高细胞型PTC,以乳头结构为主,BARFV600E突变,MAPK信号通路产物水平高,分子表达谱呈多样性。相反,RAS样PTC多为以滤泡结构为主的肿瘤,绝大多数具有纤维结缔组织包膜。RAS突变率高,MAPK信号通路产物水平低,分子表达谱相对单一。由此可见,PTC基因型与形态学表型相关。后续韩国学者在此基础上提出非BRAF样非RAF样肿瘤,用以概括PTC中未被上述两组病变包括的类型,如筛状桑葚型PTC[32]。
FTC
FTC定义为有包膜、浸润性、无PTC细胞核特征的甲状腺滤泡上皮细胞起源的恶性肿瘤[16,33]。多数为孤立性结节,约占甲状腺癌的10%,5年生存率近88%[34]。FTC鉴别诊断要点为包膜和(或)血管浸润(见图4)。充分的包膜取材是诊断FTC的先决条件[35]。
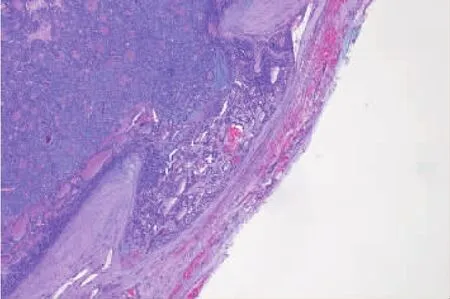
图4 FTC
具有滤泡结构的甲状腺肿瘤基因型相似,如微小浸润型FTC、甲状腺滤泡腺瘤和包裹型滤泡亚型PTC[11-12,36]。FTC基因型以RAS点突变最常见,高达35%,主要包括N、H、K三个位点,以NRAS最常见,HRAS最少见[11-12,36]。PAX8-PPARG基因融合见于高达35%的FTC,多为年轻病人和(或)具有血管浸润者[11,16]。TERT启动子突变约见于20%的FTC,PTEN突变失活见于近 10%的 FTC。DICER1、EIF1AX、IDH1、PTEN、PAX8-PPARG 等为 FTC 死亡和复发的独立预测因子[12]。
HCC
2017版WHO的HCC为从滤泡性肿瘤中独立的肿瘤类型,定义为具有75%以上嗜酸细胞的滤泡性肿瘤。肿瘤细胞质中的嗜酸性颗粒主要为线粒体成分[37-39]。与FTC脉管浸润以血管侵犯为主不同,HCC除可发生血管侵犯外,多见淋巴管内癌栓。2021年ICCR甲状腺规范化报告指出,包裹型FTC/HCC中血管侵犯病灶数量与预后相关[40]。对于有包膜的FTC/HCC,必须注明血管侵犯是局灶性(1~3个病灶)还是广泛性(≥4个病灶)。BVI在包裹性肿瘤中侵及的血管应包含包膜中或包膜外的血管。在仅有部分包膜或无包膜的浸润性肿瘤中,BVI可存在于肿瘤结节内。
HCC中BRAF和RAS样突变发生率低 (约10%)[41]。HCC具有独特的细胞核和线粒体基因组突变,多数近单倍体,线粒体DNA(mtDNA)突变率高于其他肿瘤[42],提示其侵袭性临床特征。
进 展
不同DTC类型具有不同的临床病理特征。绝大多数DTC的组织病理学分类可根据形态作出诊断,但个别形态学不典型的病例,需分子检测辅助诊断。与此同时,DTC的临床决策越来越需要分子遗传学作为辅助手段。根据2021年NCCN指南,分子检测已贯穿甲状腺癌诊断整个过程。建议对术前细针穿刺细胞学诊断为BethesdaⅢ级(AUS/FLUS,意义不明确的细胞非典型病变或滤泡性病变)以及BethesdaⅣ级(FN/SFN,滤泡性肿瘤或可疑滤泡性肿瘤;HCN/SHCN,嗜酸细胞肿瘤或可疑嗜酸细胞肿瘤)进行分子检测以指导手术决策[43]。在手术标本中联合检测BRAF、RAS、TERT启动子等有助于评估和预测甲状腺癌的生物学行为,为系统性靶向治疗决策等提供依据。对于晚期、侵袭性、危及生命的肿瘤,推荐行基因组检测有指导意义的基因突变(ALK、NTRK、RET 基因融合)、DNA 错配修复、微卫星不稳定以及肿瘤突变负荷[43]。

