祛风地黄汤对银屑病模型小鼠皮损的改善作用*
夏立君,张彦波
(河北省衡水市中医医院,河北 衡水 053000)
银屑病是以红斑、鳞屑、浸润为主要特征的常见慢性炎性皮肤病,发病率高,病程长,且呈周期性反复发作,严重影响患者的生活质量[1]。现代医学对于该病尚无特效治疗方法,西医内服、外用药及物理疗法均有一定不良反应,且停药后易复发,远期疗效较差[2]。中药复方治疗本病副作用小,且能有效降低复发率,缩短病程[3]。祛风地黄汤对治疗寻常型银屑病疗效良好,但其作用机制的研究尚未见报道[4]。银屑病发病机制涉及遗传、环境、内分泌、免疫异常等多种因素,其中辅助性T 细胞17(Th17)/调节性T 细胞(Treg)平衡失调引起的免疫功能异常为重要原因[5]。本研究中以咪喹莫特复制银屑病小鼠模型,以祛风地黄汤灌胃,观察对小鼠皮损的改善作用,并探讨其通过调节Th17/Treg 细胞免疫平衡而发挥作用的可能机制。现报道如下。
1 材料与方法
1.1 材料
仪器:EG1160 型石蜡包埋机、2135 型组织切片机(德国Leica 公司);CX23 型光学显微镜(日本Olympus公司);GENion Plus 型功能酶标仪(瑞士Tecan 公司);Mirofuge 20 R 型低温高速离心机(美国Thermo Fisher公司);165-8001 型凝胶电泳仪、1652100 型电转仪(美国Bio-Rad 公司)。
药品、试剂、饮片:甲氨蝶呤片(上海上药信谊药厂,批号为026160674,规格为每片2.5 mg);咪喹莫特乳膏(四川明欣药业有限责任公司,批号为190706,规格为每支3 g;凡士林(济宁百川化工有限公司,批号为200124);肿瘤坏死因子-β(TNF-β)、白细胞介素10(IL-10)、白细胞介素17(IL-17)、白细胞介素6(IL-6)酶联免疫吸附(ELISA)试剂盒(深圳达科为生物技术有限公司,批 号 分 别 为 20191023,20190921,20190915,20191018);增殖细胞核抗原(PCNA)及CD3+抗体试剂盒(武汉博士德生物工程有限公司,批号分别为AE90282Ra,AE99106Ra);一 抗 孤 独 核 受 体 γt(RORγt),Foxp3(美国CST 公司,批号分别为185632,185921)。生地(批号为200302)、熟地(批号为200219)、白蒺藜(批号为200206)、知母(批号为200118)、黄柏(批号为200311)、独活(批号为200210)、枸杞子(批号为2003008)、菟丝子(批号为2001250)、川牛膝(批号为200207)饮片均购自衡水市医药药材有限公司。
动物:SPF 级BALB/c 小鼠60 只,雌性,6 周龄,体质量18~22 g,购于河北中旭检验检测技术有限公司,动物实验合格证号SYXK(冀)2020-009。饲养于SPF级实验动物房中。经医院实验动物伦理委员会批准,并遵守实验动物饲养和使用原则。
1.2 方法
复制模型与分组给药:将60 只小鼠随机分为空白对照组(等体积0.9%氯化钠溶液)、模型组(等体积0.9%氯化钠溶液)、甲氨蝶呤组(1 mg/kg),以及祛风地黄汤低、中、高剂量组(8.76,17.55,35.10 g/kg),各10 只。小鼠背部剃毛,形成约2 cm×2 cm 大小的裸露区域,空白对照组小鼠每日定时涂抹等量凡士林42 mg;其余各组小鼠涂抹5%咪喹莫特乳膏42 mg,每日1 次,连续8 d,以复制银屑病小鼠模型。涂抹1 h 后,各组小鼠灌胃相应药物或等体积0.9%氯化钠溶液(0.1 mL/10 g),连续8 d。
银屑病皮损面积及严重程度指数(PASI):每日观察并拍照记录各组小鼠的皮损变化,参照PASI 评分标准[6]对模型小鼠皮损处红斑、鳞屑及浸润增厚程度进行评分,无为0 分,轻度为1 分,中度为2 分,重度为3 分,极重度为4 分,统计3 项积分总和。
组织病理学观察:于小鼠眼球取血,并处死,取部分背部皮肤组织,以多聚甲醛溶液固定,脱水,石蜡包埋,作5 μm 切片,苏木素-伊红(HE)染色,中性树胶封片,光学显微镜下观察皮损组织病理形态并拍照。
血清TNF-β,IL-10,IL-17,IL-6 水平测定:于小鼠眼球取血,离心,分离血清,按试剂盒说明书操作。样品孔加入待检血清10 μL,稀释液40 μL,抗体100 μL,于37 ℃恒温箱中孵育1 h,洗涤剂洗板5 次,加入底物液100 μL,37 ℃孵育15 min,显色,各孔加入终止液50 μL,酶标仪检测吸光度(OD)值。以标准物的浓度为横坐标、OD 值为纵坐标,绘制标准曲线,根据样品OD值,由标准曲线查出相应浓度,求相应含量。
PCNA 和CD3阳性表达测定:采用免疫组织化学法。取小鼠背部皮损组织于4%甲醛溶液中固定24 h,经乙醇脱水,二甲苯透明,作5 μm 石蜡切片。切片经脱蜡,透明,脱水后,以过氧化氢孵育20 min,抗原热修复,BSA 封闭20 min,一抗4 ℃条件下过夜,二抗37 ℃条件下孵育20 min,SABC 37 ℃条件下孵育20 min,DAB 显色后封片,光学显微镜下观察拍照,每例标本随机选取5 个视野计数PCNA 和CD3的阳性细胞表达数。
RORγt 和Foxp3 蛋白表达测定:采用Western blot法。取小鼠背部皮损组织,匀浆后加入RIPA 裂解液提取总蛋白,以BCA 法测定蛋白含量。取10 μL 蛋白样品上样,转膜,室温封闭2 h,加入一抗(1 ∶1 000),4 ℃孵育过夜,回收一抗,TBST 清洗3 次,加入二抗(1 ∶5 000),室温孵育2 h,回收二抗,TBST 清洗3 次,以显色剂显影。Image J 软件将条带灰度值数字化,目的条带与内参条带灰度比值为各目的蛋白相对表达量。
1.3 统计学处理
采用SPSS20.0 统计学软件分析。计量资料以X±s 表示,行单因素方差分析。P <0.05 为差异有统计学意义。
2 结果
2.1 小鼠皮损情况
空白对照组小鼠皮肤平坦光滑,无红斑、鳞屑及增厚改变。模型组小鼠皮肤褶皱,皮损处可见明显鳞屑、红斑、皮肤增厚隆起的银屑病样改变。甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠的皮损症状明显减轻,红斑逐渐消退,鳞屑脱落,皮肤增厚减退,皮损症状改善情况随着祛风地黄汤给药剂量的增大而更加明显。与空白对照组比较,模型组小鼠PASI 评分显著升高(P <0.01);与模型组比较,甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠PASI 评分均显著降低(P <0.01)。详见图1。
2.2 小鼠皮损组织病理学

a.空白对照组 b.模型组 c.甲氨蝶呤组 d.祛风地黄汤低剂量组 e.祛风地黄汤中剂量组 f.祛风地黄汤高剂量组A.皮损图片 B.统计数据注:与空白对照组比较,**P <0.01;与模型组比较,#P <0.05,##P <0.01。下图、下表同。图1 各组小鼠背部皮损变化及PASI 评分a.blank control group b.model group c.methotrexate group d.Qufeng Dihuang Decoction low-dose group e.Qufeng Dihuang Decoction medium-dose group f.Qufeng Dihuang Decoction high-dose groupA.Skin lesion pictures B.Statistical dataNote:Compared with those in the blank control group,**P <0.01;compared with those in the model group,#P <0.05,##P <0.01,as well as the following figures and tables.Fig.1 Changes of back skin lesions and PASI score of mice in each group
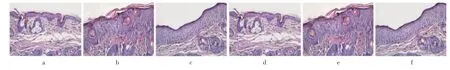
a.空白对照组 b.模型组 c.甲氨蝶呤组 d.祛风地黄汤低剂量组 e.祛风地黄汤中剂量组 f.祛风地黄汤高剂量组图2 各组小鼠皮损组织病理学观察(HE,×200)a.blank control group b.model group c.methotrexate group d.Qufeng Dihuang Decoction low-dose group e.Qufeng Dihuang Decoction mediumdose group f.Qufeng Dihuang Decoction high-dose groupFig.2 Histopathological observation of skin lesions of mice in each group(HE,×200)
空白对照组小鼠皮肤组织的表皮层薄,细胞浸润少。模型组小鼠表皮细胞层明显增厚,真皮层可见大量炎性细胞浸润,皮损组织呈银屑病样改变。甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠皮损表皮层较模型组平整,增厚减小,真皮层炎性细胞浸润明显减少。详见图2。
2.3 小鼠血清炎性因子水平
与空白对照组比较,模型组小鼠血清中TNF-β 和IL-10 水平均显著降低,IL-17 和IL-6 水平均显著升高(P <0.01);与模型组比较,甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠血清中TNF-β 和IL-10 水平均显著升高,IL-17 和IL-6 水平均显著降低(P <0.05,P <0.01)。详见表1。
表1 各组小鼠血清中TNF-β,IL-10,IL-17,IL-6 水平比较(± s,ng/mL,n =10)Tab.1 Comparison of serum TNF-β,IL-10,IL-17 and IL-6 levels in each group(± s,ng/mL,n =10)
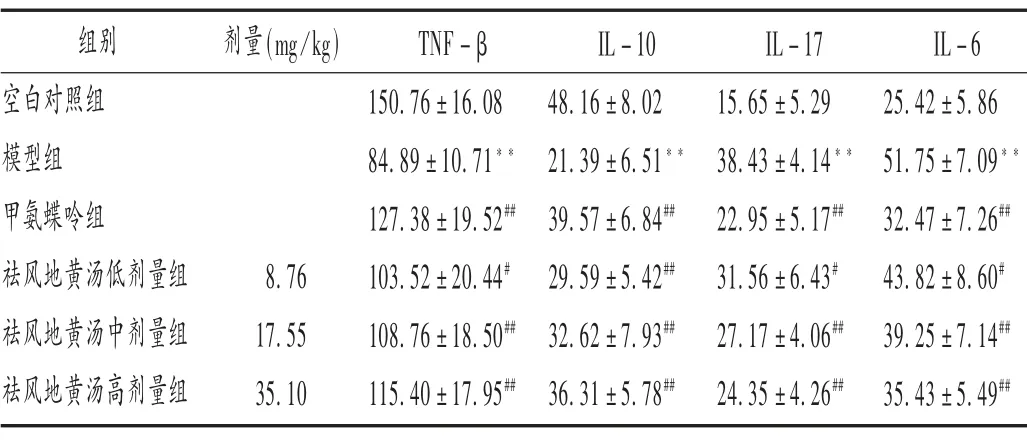
表1 各组小鼠血清中TNF-β,IL-10,IL-17,IL-6 水平比较(± s,ng/mL,n =10)Tab.1 Comparison of serum TNF-β,IL-10,IL-17 and IL-6 levels in each group(± s,ng/mL,n =10)
2.4 小鼠皮损组织PCNA 表达水平
空白对照组小鼠表皮层较薄,基底层可见PCNA 阳性表达细胞,呈线性分布。与空白对照组比较,模型组小鼠皮损组织的表皮着色细胞层数显著增加,阳性细胞广泛分布于表皮层,阳性细胞数显著增多(P <0.01);与模型组比较,甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠皮损组织的表皮着色细胞层数较模型组显著减少,阳性细胞多分布于基底层,阳性细胞数显著减少(P <0.01)。详见图3。
2.5 小鼠皮损组织CD3+表达水平
空白对照组小鼠皮肤的真皮层可见少量CD3+细胞零星分布。与空白对照组比较,模型组小鼠皮肤的真皮层CD3+表达水平显著升高(P <0.01);与模型组比较,甲氨蝶呤组及祛风地黄汤中、高剂量组小鼠皮肤的真皮层CD3+表达水平显著降低(P <0.01,P <0.05)。详见图4。
2.6 小鼠皮损组织RORγt 和Foxp3 蛋白表达水平
与空白对照组比较,模型组小鼠皮损组织中RORγt蛋白表达水平显著升高,Foxp3 蛋白表达水平显著降低(P <0.01);与模型组比较,甲氨蝶呤组及祛风地黄汤低、中、高剂量组小鼠皮损组织中RORγt 蛋白表达水平均显著降低(P <0.01),Foxp3 蛋白表达水平均显著升高(P <0.01)。详见图5。
3 讨论
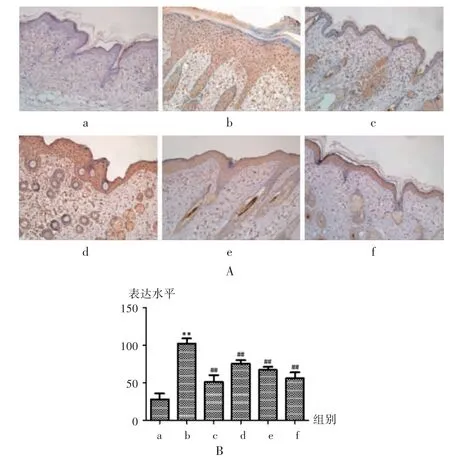
a.空白对照组 b.模型组 c.甲氨蝶呤组 d.祛风地黄汤低剂量组 e.祛风地黄汤中剂量组 f.祛风地黄汤高剂量组A.PCNA 表达 B.统计数据图3 各组小鼠皮损组织中PCNA 的表达(HE,×200)a.blank control group b.model group c.methotrexate group d.Qufeng Dihuang Decoction low-dose group e.Qufeng Dihuang Decoction mediumdose group f.Qufeng Dihuang Decoction high-dose groupA.Expression of PCNA B.Statistical dataFig.3 Expression of PCNA in skin lesions of mice in each group(HE,×200)

a.空白对照组 b.模型组 c.甲氨蝶呤组 d.祛风地黄汤低剂量组 e.祛风地黄汤中剂量组 f.祛风地黄汤高剂量组A.CD3+表达 B.统计数据图4 各组小鼠皮损组织中CD3+的表达(HE,×200)a.blank control group b.model group c.methotrexate group d.Qufeng Dihuang Decoction low-dose group e.Qufeng Dihuang Decoction medium-dose group f.Qufeng Dihuang Decoction high-dose groupA.Expression of CD3+ B.Statstical dataFig.4 Expression of CD3+ in skin lesions of mice in each group(HE,×200)
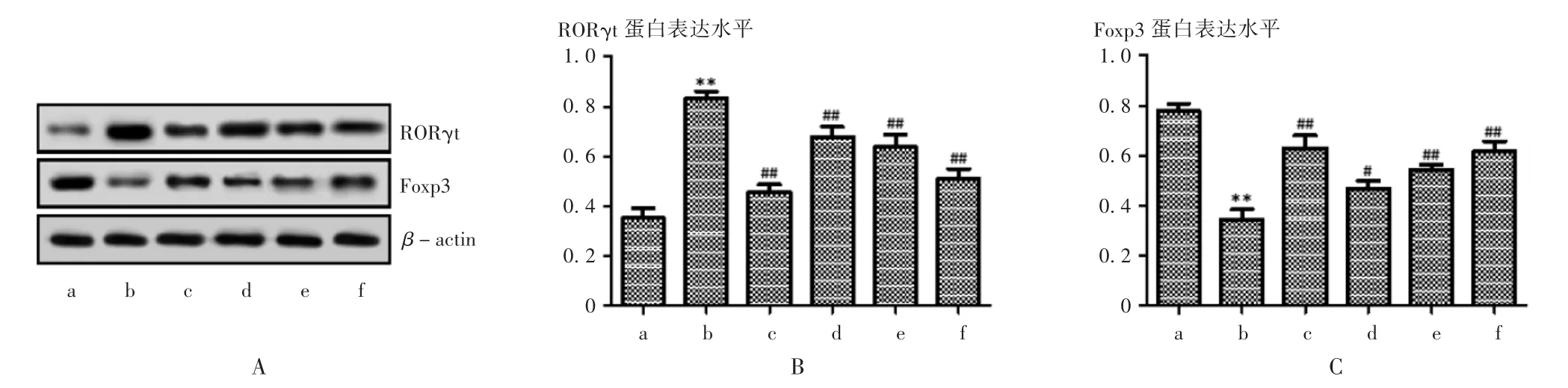
a.空白对照组 b.模型组 c.甲氨蝶呤组 d.祛风地黄汤低剂量组 e.祛风地黄汤中剂量组 f.祛风地黄汤高剂量组A.电泳图 B,C.统计数据图5 小鼠皮损组织中RORγt 和Foxp3 的蛋白表达a.blank control group b.model group c.methotrexate group d.Qufeng Dihuang Decoction low-dose group e.Qufeng Dihuang Decoction mediumdose group f.Qufeng Dihuang Decoction high-dose groupA.Electrophoretic chart B,C.Statistical dataFig.5 Expression of RORγt and Foxp3 protein in skin lesions of mice
银屑病在全球的发病率为2%~3%,且有逐年上升趋势[7]。该病多以对症治疗控制复发为主,如用卡泊三醇、维A 酸、糖皮质激素类等外用软膏,内服抗生素、免疫抑制剂等内用药,以及光化学疗法、水疗法等物理疗法进行治疗[8]。银屑病需长期治疗,而各种疗法都有一定程度的不良反应,且停药后易复发,远期疗效较差[2]。中药复方治疗本病能有效降低复发率,缩短病程,其具体机制亟待进一步探究[3]。银屑病发病机制复杂,其中免疫细胞的分化异常是关键[9],而Th17 及Treg 免疫功能失调是近年来的研究热点。Th17 和Treg 细胞均属CD4+T 淋巴细胞亚群,二者关系密切,功能上相互制约,在正常机体中保持动态平衡状态[10]。银屑病患者外周血及皮损区存在Th17 型细胞因子的过度活化,同时Treg 细胞的活性及功能受到抑制[11]。Th17 所分泌的IL-17 和IL-6 等促炎因子能放大炎性反应,促进银屑病局部皮损的炎性浸润[12]。Treg 能通过表达IL-10、TNF-β 等抑炎细胞因子发挥免疫调节功能,抑制T 细胞的增殖分化,减轻过度免疫及炎性反应[13]。RORγt 和Foxp3 为Th17 和Treg 细胞分化的特异性转录因子,其表达能直接反映Th17 与Treg 细胞的功能与活性[14]。RORγt 的过度表达可诱导炎症产生,Foxp3 是Treg 细胞发挥免疫调节功能的重要蛋白,二者比例的失调与Th17/Treg 细胞失衡密切相关。当RORγt 表达水平持续上升、Foxp3 表达水平不断下降时,最终导致Treg /Th17 细胞免疫失衡,使皮肤炎症进一步加重,成为皮损反复迁延的关键环节[15]。
咪喹莫特诱导的银屑病小鼠模型所产生的皮损形态、组织病理学变化及免疫细胞因子表达等均与人类银屑病极相似,是国内外公认的银屑病研究动物模型[18]。本研究结果显示,祛风地黄汤能明显改善小鼠的皮损症状及PASI 评分,减轻皮损组织表皮层增厚及真皮层炎性细胞浸润程度,角质细胞异常增殖与活化是引起银屑病表皮增厚的主要原因,PCNA 是反映皮损组织细胞增殖活跃程度的指标[19]。免疫组化结果可见,经祛风地黄汤治疗后,小鼠皮损组织中PCNA 的阳性细胞数较模型组显著减少,多分布于基底层,提示祛风地黄汤能抑制银屑病模型小鼠表皮细胞的增殖分化。真皮层T 淋巴细胞浸润及其免疫功能异常是银屑病的重要特征[20],祛风地黄汤各剂量组小鼠真皮层CD3+T 阳性细胞数较模型组显著减少,表明祛风地黄汤能抑制T 细胞过度增殖,减轻真皮层T 细胞浸润,从而改善皮肤免疫反应,缓解小鼠皮损症状。ELISA 及Western blot 试验结果显示,祛风地黄汤能有效降低模型小鼠血清中IL-17 和IL-6水平,升高TNF-β 和IL-10 水平,同时下调小鼠皮损组织中RORγt 蛋白的表达,上调Foxp3 蛋白的表达,提示祛风地黄汤可能通过降低Th17 细胞因子和RORγt的表达,同时恢复Treg 细胞活性及其功能蛋白Foxp3的表达,从而抑制T 细胞向Th17 型细胞分化,纠正Th17/Treg 细胞免疫失衡,发挥对模型小鼠皮损的改善作用。
综上所述,祛风地黄汤对模型小鼠银屑病样皮损具有明显的改善作用,其机制可能与调节Th17/Treg 免疫失衡有关。

