Alamandine通过结合MrgD受体促进大鼠皮下脂肪间充质干细胞成脂分化
吴晓光,杨传熙,张 晶,赵 锟,孙 伟,孔祥清*
1南京医科大学第一附属医院心内科,江苏 南京210029;2同济大学医学院,同济大学附属杨浦医院心血管内科,上海200090
肥胖是全球范围内的一种健康问题,能引起多种疾病,如代谢综合征(高血脂、高三酰甘油血症和2型糖尿病等)、心血管疾病、慢性炎性反应和肿瘤等,严重威胁人类健康[1]。大鼠脂肪来源的间充质干细胞(adipose-derived mesenchymal stem cell,ADSC)具有很强的增殖潜能,同时能够定向分化为成骨细胞、肌源性细胞和脂肪细胞[2]。成熟脂肪细胞的形成有两个关键步骤,即成熟期和终末分化期。ADSC在成熟期中被诱导成前脂肪细胞,在终末分化期定向分化为脂肪细胞[3]。脂肪分化过程受到多个转录因子的调控,如过氧化物增殖激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、CCAAT增强子结合蛋白α(CCAAT/enhancer-binding protein α,C/EBPα)和脂蛋白脂肪酶等[3]。除此之外,由于成脂分化伴随脂肪生成,所以负责脂肪生成的酶,例如脂肪酸合酶(fatty acid synthase,FAS)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)也被认为是脂肪生成的重要标志。
肾素-血管紧张素系统(renin-angiotensin system,RAS)是体内非常重要的内环境稳定系统。RAS在体内分布非常广泛,不仅存在于循环系统中,在中枢神经系统、血管壁、肾脏、肾上腺等也有广泛分布[4]。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是RAS中的主要活性物质,是前体物质血管紧张素原在肾素作用下转化为血管紧张素Ⅰ(angiotensinⅠ,AngⅠ),再由血管紧张素转化酶(angiotensin onverting enzyme,ACE)催化生成。AngⅡ可以在胞外血管紧张素Ⅱ转化酶2(angiotensin converting enzyme 2,ACE2)作用下转化成血管紧张素1-7[angiotensin(1-7),Ang(1-7)],通过与Mas受体(一种G蛋白偶联受体)的相互作用,Ang(1-7)通常拮抗AngⅡ的作用[5]。Ang(1-7)可以脱羧成一种叫Alamandine的肽。有趣的是,Alamandine被发现是Mas相关G蛋白偶联受体D(mas associated G protein coupled receptor D,MrgD)的内源性配体[6]。RAS同样也是能量代谢的一个重要调节因子,在代谢紊乱如肥胖和胰岛素抵抗中起作用[7]。脂肪组织是一种高度活跃的代谢和内分泌器官,是RAS成分的来源之一。另一方面,AngⅡ受体和Mas受体在脂肪细胞共表达,意味着局部RAS系统参与调节脂肪细胞功能[8]。
已有研究表明,在人和小鼠3T3-L1前体脂肪细胞中,Ang(1-7)-Mas信号通过激活PI3K/Akt和抑制MAPK激酶/ERK途径促进脂肪生成,Ang(1-7)-Mas是通过抑制AngⅠ-AT1触发的MAPK激酶/ERK途径拮抗AngⅠ-AT1的抗脂肪生成作用[9]。AngⅠ/AT1-ACE2-Ang(1-7)/Mas轴对脂肪形成的自分泌调节也已被揭示,表明了局部调节微妙平衡的RAS对脂肪形成的重要性及其作为肥胖症和相关代谢紊乱的新治疗靶点的潜力[8]。然而Alamandine对于脂肪生成的效应尚且未知。因此,阐明Alamandine在ADSC成脂分化过程中的分子机制可能为肥胖症等代谢性疾病的治疗提供新的思路。
1 材料和方法
1.1 材料
DMEM高糖培养基、间充质干细胞培养基(MSCM)(Gibco公司,美国),间充质干细胞-脂肪细胞分化培养基(MADM,Scien Cell公司,美国),胎牛血清(fetal bovine serum FBS)、青霉素、链霉素(Biological Industries公司,以色列),胶原酶1型(上海Biosharp公司),油红O、甘油三酯检测试剂盒、总胆固醇检测试剂盒(南京建成生物工程研究所),BCA蛋白定量试剂盒、蛋白上样缓冲液(上海碧云天),PAGE凝胶快速制备试剂盒(上海雅酶生物科技有限公司),BSA(ICN生物医学化学药品公司,美国),辣根酶标记山羊抗小鼠IgG、辣根酶标记山羊抗兔IgG(北京中杉金桥公司),β-actin抗体、ACC抗体、C/EBP-α抗体、PPAR-γ抗体、FAS抗体(Cell Signaling Technology公司,美国),Alamandine(上海Phoenix Pharmaceuticals公司),AngⅡ(Sigma公司,美国),Dpro7(Bachem公司,瑞士)。
1.2 方法
1.2.1 大鼠皮下间充质脂肪干细胞提取和培养
取6~8周Sprague-Dawley(SD)大鼠腹股沟皮下脂肪,用含双抗的PBS缓冲液冲洗3次,去除脂肪组织中可见的血管和结缔组织,将脂肪组织剪成1 mm3碎块。加入适量胶原酶消化液(1 mg/mLⅠ型胶原酶,1%BSA)。37℃恒温摇床充分消化30 min,完全培养基(DMEM,10%FBS)终止消化。100目分子筛过滤,1 000 r/min离心10 min,去除悬浮的脂肪细胞和脂滴。PBS洗涤离心2次,用MSCM(含5%FBS)重悬。血细胞计数板计数,按5×107个/L的浓度将细胞接种到60 mm培养皿中,标记为F0代。在37℃、5%CO2、饱和湿度条件下培养,24 h后用预温的PBS洗2次,加入3 mL完全MSCM培养基继续培养,每3 d换液1次,以去除悬浮细胞。当细胞生长汇合度达80%时进行传代培养。取F2代细胞,开始用MADM(5%FBS,5%间充质干细胞脂肪分化生长因子,1%青霉素/链霉素)培养(定义为day1)。以后每2 d换1次培养基。
1.2.2 ADSC干预
取F2代ADSC,PBS冲洗,加无血清的DMEM培养液饥饿12 h。进行随机分组:Alamandine不同浓度组(0、0.1、1.0、10.0 μmol/L),Western blot检测ADSC中ACC、FAS、PPAR-γ、CEBP-α蛋白表达水平,油红O染色、光镜观察脂肪细胞分化情况和细胞内甘油三酯、总胆固醇测定,根据得出的Alamandine最适浓度进行以下实验:Alamandine不同处理时间组:向无血清培养基中添加/不添加10 μmol/L Alamandine分别处理ADSCs 1、3、6、10 d;Sham组:无血清培养基;Alamandine组:含10 μmol/L Alamandine的无血清培养基;AngⅡ组:含1 μmol/L AngⅡ的无血清培养基;AngⅡ+Alamandine组:含1 μmol/L AngⅡ和10 μmol/L Alamandine的无血清培养基;Alamandine+D-pro7组:含10 μmol/L Alamandine和10 μmol/L D-pro7的无血清培养基;AngⅡ+Alamandine+Dpro7组:含1 μmol/L AngⅡ和10 μmol/L Alamandine,10 μmol/L D-pro7的无血清培养基。以上实验各重复3次。
1.2.3 Western blot
细胞用预冷的PBS清洗2遍,加入适量新制的磷酸酶/蛋白酶抑制剂与RIPA蛋白裂解液的混合物,刮除细胞置于冰上充分裂解30 min,4℃离心20 min,收集上清,检测蛋白含量。蛋白定量后加入上样缓冲液100℃水浴变性。蛋白等量上样,经过SDS-聚丙烯酰胺凝胶电泳后,将蛋白转移到PVDF膜上,在含5%BSA的TBST封闭2 h后,一抗(1∶1 000稀释)4℃孵育过夜。TBST洗涤条带3次后,用辣根过氧化物酶标记的二抗常温孵育2 h。再次洗涤3~4次,增强化学发光法进行蛋白显影。
1.2.4 油红O染色
4%多聚甲醛固定细胞20 min,PBS洗涤3次,加入过滤后的油红O染料(1.8 mg/mL油红O和60%(V/V)溶于双蒸水的异丙醇)染色60 min。双蒸水洗涤3次后,光学显微镜下观察拍照。
1.2.5 细胞内甘油三酯、总胆固醇测定
细胞甘油三酯含量测定采用脂肪细胞分化检测试剂盒,在大鼠ADSC分化10~12 d后,细胞用PBS重复洗2次,刮除,超声处理以使悬浮液均匀化,测定细胞内甘油三酯和总胆固醇含量。用蛋白试剂盒测定这些细胞的总蛋白浓度,作为内部对照。
1.3 统计学方法
采用SPSS 22.0进行统计学分析,所有实验均重复3次,结果以均值依标准差(±s)表示,采用软件Graphpad prism 7绘制图表。数据处理时,计量资料经检验,数据符合正态分布,方差齐。组间数据比较采用单因素方差分析,LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 Alamandine对大鼠ADSC有促成脂分化效应且成剂量依赖性
ADSC向成熟脂肪细胞的转化需要多种转录因子的协同调节。其中,PPAR-γ被认为是最基本的转录因子。在诱导分化10~12 d后,许多成纤维细胞样纺锤形大鼠ADSC分化成为成熟的脂肪细胞,光镜下可以看到成熟脂肪细胞成球形且胞质内有脂滴积聚(图1A),且随着Alamandine剂量的增加,脂肪细胞的数量也在增加。脂质积聚是脂肪形成程度的一个指标,可通过脂滴的油红O染色进行评估,还可通过直接测量细胞内甘油三酯和总胆固醇含量进行定量评估。在分化过程中外源性施用Alamandine显著增加了脂肪细胞的比例(图1B),以及胞内甘油三酯和总胆固醇含量,与Sham组相比,随着Alamandine浓度的升高,总胆固醇以及甘油三酯水平也在升高,其中10 μmol/L Alamandine处理组的总胆固醇以及甘油三酯水平最高,且差异有统计学意义(n=3,P<0.05,图1C)。同样,Alamandine增加了脂肪细胞生成标志物PPAR-γ、CEBP-ɑ、FAS、ACC的表达(图1D、E),与Sham组相比,10 μmol/L Alamandine处理组在4种成脂分化相关蛋白检测上的差异均有统计学意义(P<0.05,n=3),故选用10 μmol/L Alamandine作为最适浓度。
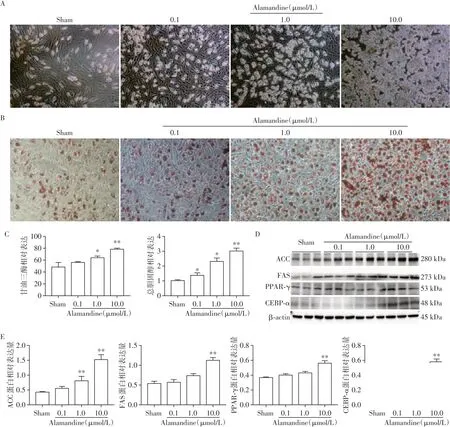
图1 Alamandine对大鼠ADSC有促成脂分化效应且成剂量依赖性Figure 1 Alamandine can promote lipid differentiation in a dose-dependent manner in ADSC
2.2 Alamandine促进大鼠ADSC成脂分化且成时间依赖性
选取10 μmol/L浓度的Alamandine作用于大鼠ADSC,与空白对照一起,在第1、3、6、10天测定成脂分化程度。经过检测发现,与空白对照相比,诱导第1、3天的ADSC脂肪细胞生成标志物PPAR-γ、C/EBP-ɑ、FAS、ACC表达略有升高,但差异没有统计学意义(P>0.05,n=3),诱导第6、10天的脂肪细胞生成标志物表达水平相比空白对照组差异有统计学意义(P<0.05,n=3),且诱导第10天脂肪细胞生成标志物水平最高(图2A、B)。倒置显微镜下观察,细胞内脂滴含量同样随着诱导时间的延长而增加(图2C)。
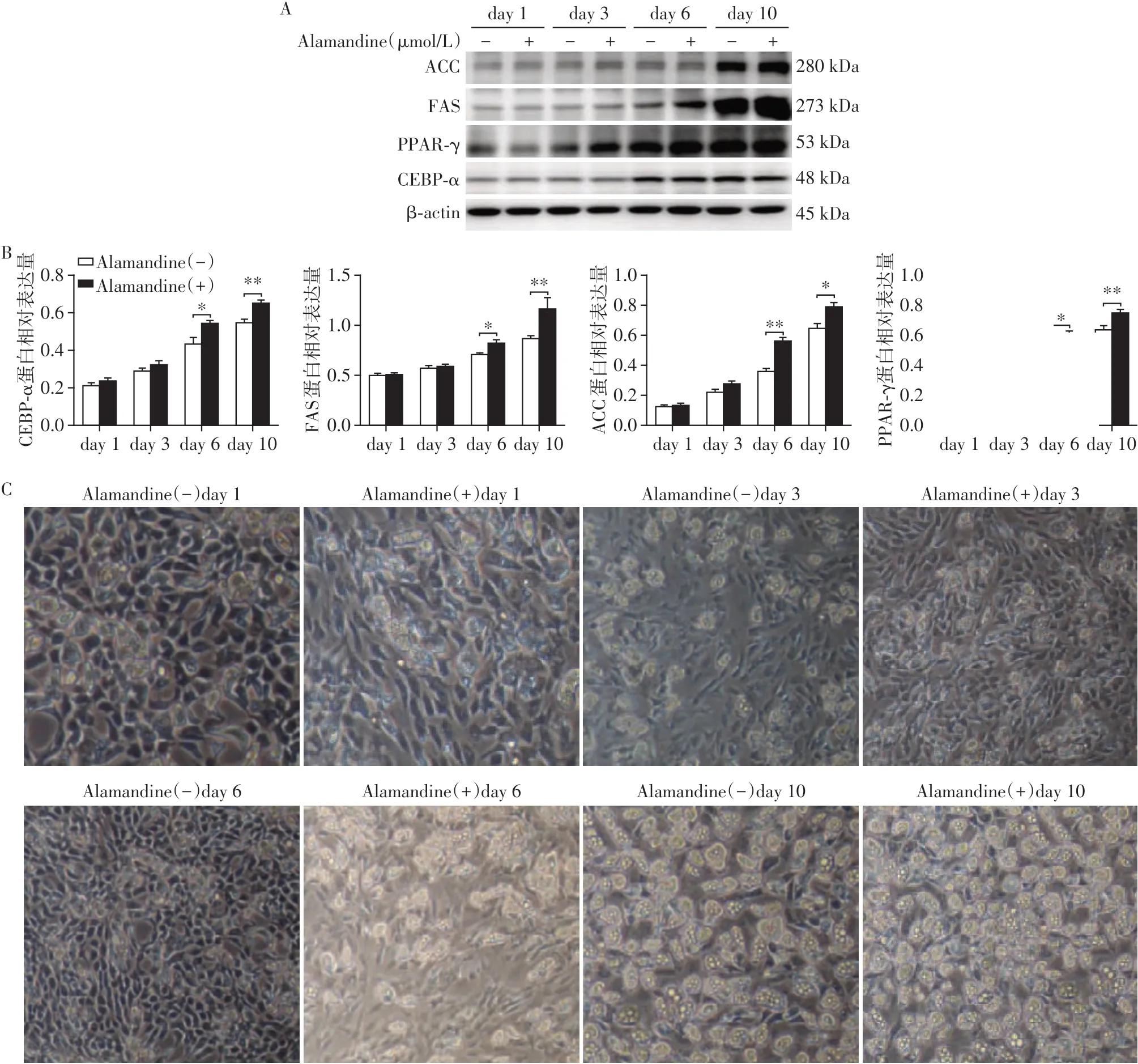
图2 Alamandine促进大鼠ADSC成脂分化且成时间依赖性Figure 2 Alamandine promoted adipogenic differentiation of ADSCs in a time-dependent manner
2.3 AngⅡ拮抗了Alamandine对大鼠ADSC的成脂分化效应
之前有研究表明,AngⅡ对人的脂肪间充质干细胞有抑制成脂分化的效应,而在大鼠脂肪间充质干细胞上则没得到验证。正如预期的那样,在加入AngⅡ后,大鼠ADSC成脂分化效应减弱,AngⅡ组相较于Sham组,成脂分化相关蛋白表达水平明显降低,细胞内甘油三酯和总胆固醇水平同样降低且差异有统计学意义(P<0.05,n=3,图3A~C)。光镜及油红O染色观察脂肪细胞分化情况,(图3D、E),同样发现AngⅡ抑制成脂分化。可以得出AngⅡ是通过作用于ADSC的AT1受体达到抑制成脂分化的效应[5]。有趣的是,在AngⅡ和Alamandine共处理大鼠ADSC后,AngⅡ减弱了Alamandine对大鼠ADSC的促成脂分化效应。
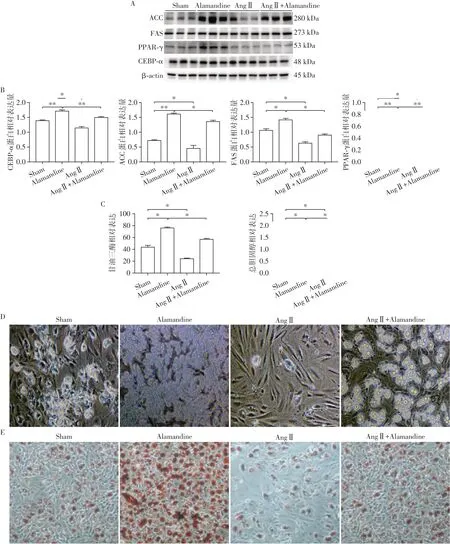
图3 AngⅡ拮抗Alamandine对大鼠ADSC的成脂分化Figure 3 AngⅡantagonism Alamandine for differentiation of ADSC into fat effect in rats
2.4 Alamandine通过作用于大鼠ADSC MrgD受体达到促成脂分化效应
为了验证Alamandine是否通过作用于大鼠ADSC的MrgD受体达到促成脂分化的效应,应用了MrgD受体拮抗剂D-pro7。经检测发现,Alamandine+D-pro7组相较于Alamandine组,脂肪细胞生成标志物CEBP-α、PPAR-γ、ACC、FAS表达水平明显降低(图4A、B),总胆固醇和甘油三酯含量也明显降低(图4C),且差异有统计学意义(P<0.05,n=3),油红O染色和光镜观察提示脂肪细胞数量也显著减少(图4D、E)。综上,Alamandine是通过作用于MrgD来起到促进成脂分化的作用。AngⅡ+Alamandine+Dpro7组与AngⅡ+Alamandine相比脂肪细胞生成标志物水平以及甘油三酯,总胆固醇水平均明显降低,且差异有统计学意义(P<0,05,n=3),提示D-pro7与AngⅡ具有协同效应,均能抑制成脂分化。
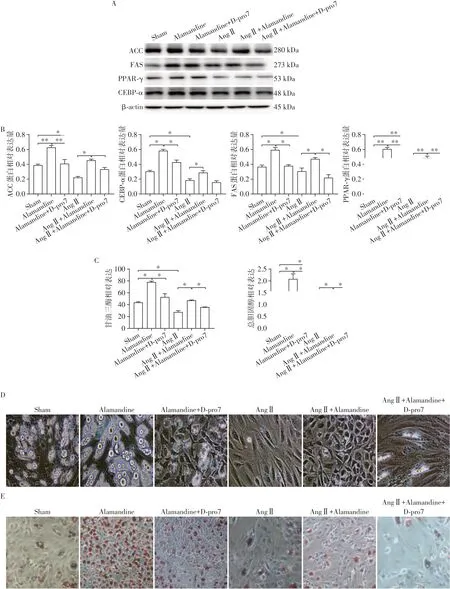
图4 Alamandine通过作用于大鼠ADSC MrgD受体促进成脂分化Figure 4 Alamandine promotes lipid differentiation by acting on the MrgD receptor of ADSC in rat
3 讨论
脂肪组织来源的间充质干细胞是一类易于获得、增殖和分化能力强大的成体间充质干细胞[10]。肥胖是全球发病率非常高的疾病,会诱发心血管疾病、高血压、糖尿病和肿瘤等多种疾病[11]。目前认为,肥胖是白色脂肪细胞肥大,增生和脂肪形成共同作用的结果。脂肪组织内的ADSC是体内新生脂肪细胞的重要来源。因此,ADSC过度的成脂分化被认为是导致肥胖的重要原因[12]。
RAS是控制身体电解质和血压平衡稳态的激素回路[13]。AngⅡ是这个激素回路中的核心物质,在成人组织中,AngⅡ的主要靶点是1型受体(AT1),由多种细胞表达,包括内皮细胞和平滑肌细胞,AngⅡ以AT1依赖的方式引起炎症和纤维化[14]。而Ang(1-7)和Alamandine作为一种有益的系统,它们分别与Mas和MrgD受体相互作用,对抗AngⅡ/AT1轴的有害影响[15]。局部组织产生的血管紧张素原和它的加工酶存在于肾脏、大脑、心脏、胰腺和脂肪组织等多个器官中[16]。实验研究表明,在脂肪组织中表达的RAS与脂肪细胞形成的调节有关,且AngⅡ对脂肪形成起到负性调节的作用[17]。
MrgD受体主要表达于背根神经节和感觉神经节,在小脑、棕色脂肪、白色脂肪和胃肠道中有少量表达[5],MrgD受体最初被发现与神经疼痛有关,除了与钙释放和磷酸激酶A激活有关外,MrgD信号转导尚不清楚[18]。既往研究发现,Ang(1-7)对ADSC有促进成脂分化的作用[8]。而Alamandine是Ang(1-7)脱羧形成的多肽,尽管二者结构相似,但是却作用于不同的受体,Ang(1-7)作用于Mas受体,而Alamandine作用于MrgD受体。Alamandine一般与AngⅡ相拮抗,发挥保护性作用。例如Alamandine通过MrgD,抑制AngⅡ诱导的心肌细胞肥大[19],以及Alamandine通过MrgD受体保护心脏免受再灌注损伤[20]。研究表明,Mas敲除小鼠在阻断AT1受体后引起的抗肥胖效应更显著[21],但是Alamandine对于ADSC的成脂分化的影响却尚未给予太多关注,本文首次阐明Alamandine对大鼠脂肪来源间充质干细胞成脂分化的影响。
本研究发现,Alamandine这种Ang(1-7)脱羧形成的新型肽,能够显著促进大鼠皮下ADSC成脂分化,成脂分化相关蛋白标志物水平增加呈现剂量和时间依赖性,细胞内脂滴含量、甘油三酯以及胆固醇水平同样在Alamandine诱导后增加,而AngⅡ抑制了大鼠ADSC的成脂分化。为了继续探究Alamandine促进大鼠ADSC成脂分化的机制,在运用Alamandine的作用受体——MrgD受体的拮抗剂D-Pro7后,Alamandine促进ADSC成脂分化效应被显著减弱,证实了Alamandine是通过作用于MrgD受体来发挥成脂分化效应的。但尚未在动物水平上继续验证Alamandine对成脂分化或是肥胖的影响,需要进一步的验证。
综上所述,本研究发现Alamandine能够促进大鼠ADSC的成脂分化,其机制与其受体MrgD的相互作用有关。这项研究结果的启示性在于,抑制脂肪间充质干细胞MrgD受体的表达可能为肥胖症的治疗提供一些新的思路。

