冬氨酸二丁二酸醚和酒石酸配施对籽粒苋生长和镉富集特征的影响
何明倩,卢 欣,唐 妍,陈芝吟,夏涓文,徐小逊,2*,李启蓝
(1.四川农业大学环境学院,成都 611130;2.四川省土壤环境保护重点实验室,成都 611130;3.重庆市荣昌区生态环境监测站,重庆 402460)
随着工农业生产的不断发展,采矿冶炼、肥料及杀虫剂的施用、污水排放灌溉等人类活动的加剧,导致土壤重金属镉(Cd)污染日趋严重[1-2]。Cd易被植物吸收,影响植物对必需矿物质元素的吸收和运输,抑制光合作用,产生氧化应激,从而影响植物的生长发育[3]。并且,植物中积累的Cd通过食物链进入人体,直接危害人体健康[4-5]。因此,人们越来越重视Cd污染土壤的修复。
植物修复技术是指在污染土壤中种植超富集植物,利用植物对污染物进行固定、吸收,以降低污染物的有害性,或去除环境中的污染物[6]。因其具有安全、经济以及环境友好等特点,而被广泛应用于修复重金属污染土壤[7]。然而,一般情况下土壤中的重金属大多吸附在土壤颗粒上,导致重金属的生物利用度较低,难以被植物吸收[8]。添加螯合剂可以提高重金属的生物有效性,促进植物对重金属的吸收[9]。
与无机螯合剂相比,有机螯合剂更易生物降解,并且有机螯合剂能提高超富集植物的提取能力,更有利于重金属的提取[10-11]。乙二胺四乙酸(EDTA)能有效提高植物对金属的吸收,但由于EDTA的生物降解性能较差,长期吸附于土壤颗粒上,会带来二次污染等环境风险[12]。相比之下,可生物降解的多羧基氨基酸类螯合剂(APCAs)如S,S-乙二胺二琥珀酸(S,S-EDDS)和二乙基三乙酸(NTA)等,既能提高植物修复效率,又能降低螯合剂对土壤的环境风险[4,13]。螯合剂冬氨酸二丁二酸醚(AES)与 EDDS 同为天冬氨酸的衍生物,具有较高的生物降解能力和重金属亲和力,可以作为生物可降解螯合剂使用[14]。
然而高剂量的螯合剂会对植物产生毒害作用,导致植物生物量降低,从而减少植物对重金属的吸收[6]。造成这种情况的原因可能是螯合剂改变了土壤中重金属的溶解度,使土壤溶液中的重金属离子浓度增加,进而对植物造成更严重的胁迫[15]。已有研究表明外源添加酒石酸能够解除Cd对根长和根表面积的抑制,缓解Cd的毒害作用[16]。同时酒石酸能通过酸化、溶解等作用活化土壤中的矿物成分,间接促使植物营养元素含量增加,促进植物生长,提高植物对Cd胁迫的耐性。陈亚慧等[17]研究酒石酸(TA)与螯合剂EGTA单施和配施对强化蓖麻修复Cd污染土壤的效果时,发现TA可作为解毒剂减轻螯合剂活化重金属后对植物的毒害,有利于提高植物修复效率。
籽粒苋(Amaranthus hybridus L.)为苋科、苋属一年生植物,具有生物量大、易栽培和Cd耐受能力较强等特点,是一种良好的Cd污染土壤修复材料[18-20]。AES添加能否提高其对Cd的提取效率,而TA又能否缓解植物吸收大量Cd后所产生的毒性效应,目前几乎没有证据支持这一假设。因此本试验以籽粒苋为供试材料,通过研究不同用量的AES与TA单施与配施对籽粒苋生长、生理和Cd积累能力的影响,分析使用AES修复Cd污染土壤时TA作为解毒剂的可行性,以期为添加AES与TA辅助籽粒苋修复Cd污染土壤提供理论依据。
1 材料和方法
1.1 供试材料
供试植物为籽粒苋,试验用籽粒苋种子采自四川省汉源县的富泉铅锌矿区。
1.2 试验设计
1.2.1 幼苗培养
挑选成熟饱满籽粒苋种子,用0.05% NaClO浸泡消毒30 min,再用蒸馏水冲洗干净,于28℃恒温培养箱内催芽,7 d后移栽于未受重金属污染的沙土中培养,培养过程中定期浇灌1/2Hoagland营养液,经30 d培养后选择长势一致的幼苗(株高10 cm左右,5~6叶)备用。
1.2.2 盆栽试验
供试土壤为受工业污染严重的水稻土,其基本理化性质为pH值6.15,全氮和有机质的含量分别为1.13、18.75 g/kg,碱解氮、有效磷和速效钾的含量分别为78.34、14.68和122.5 mg/kg,机械组成为黏粒25.3%、砂粒35.3%以及粉粒39.4%,Cd全量为35.14 mg/kg。采集表层土(0~20 cm),将土样自然风干、压碎,过5 mm尼龙网塞。将土壤分别装进塑料花盆(直径30 cm,高度20 cm),每盆装土5.0 kg,同时每桶施4.0 g复合肥(N∶P2O∶K2O=17∶17∶17,以 NH4NO3和 K2HPO4的形式供给)。
选取长势一致的籽粒苋幼苗移栽到塑料花盆中,每盆3株。盆栽试验设计共8个处理,每个处理3次重复,具体试验设计为:①空白对照(CK);②0.033 mmol/kg TA(T1);③0.067 mmol/kg TA(T2);④2.5 mmol/kg AES(A1);⑤5 mmol/kg AES(A2);⑥0.033 mmol/kg TA 与 2.5 mmol/kg AES(A1T1);⑦0.067 mmol/kg TA 与 2.5 mmol/kg AES(A1T2);⑧ 0.033 mmol/kg TA 与 5 mmol/kg AES(A2T1);⑨0.067 mmol/kg TA 与 5 mmol/kg AES(A2T2)。盆栽第60天时,将各配比AES与TA溶于800 mL水,以溶液滴灌形式向籽粒苋根系土壤一次性加入螯合剂,处理20 d后即盆栽试验的第80天,收获植株。
1.3 测定方法
1.3.1 籽粒苋生物量的测定
籽粒苋植株分为根、茎和叶3部分样品采收,先用自来水反复将根冲洗干净,然后用去离子水冲洗3~5次,用吸水纸吸干。将植物各部分鲜样置于105°C下杀青30 min,然后在80°C烘箱内烘干至恒重,测定各器官生物量。
1.3.2 叶片抗氧化酶活性的测定
取籽粒苋新鲜叶片0.2 g,加入2 mL提前预冷的0.05 mol/L,pH 7.8的磷酸缓冲液,在冰浴条件下研磨为匀浆,于离心管中在4℃、12 000 r/min下离心20min,取上清液进行测定。
采用氮蓝四唑(NBT)法[21]测定超氧化物歧化酶(SOD)的活性。SOD活性单位以抑制NBT光还原的50%所需酶量为一个酶活性单位表示。采用高锰酸钾滴定法[21]测定过氧化氢酶(CAT)活性。酶活性用每克鲜重样品1 min内分解H2O2的毫克数表示。
1.3.3 土壤中Cd形态的测定
采用改进的BCR连续提取法,测量土壤中Cd弱酸提取态、可还原态、可氧化态和残渣态的含量[22]。第一步用HAc作为提取液,测量弱酸提取态Cd含量。第二步向第一步提取后的残余物中加入提取液NH2OH·HCl,测量可还原态Cd含量。第三步向第二步提取后的残余物中加入H2O2消解,冷却后加入提取液NH4OAc,测量可氧化态Cd含量。最后将经过第三步提取后的残渣转移到聚四氟乙烯烧杯中,然后加入HNO3,HF和HClO4消解,消解液冷却后定容测量残渣态Cd含量。
1.3.4 Cd含量的测定
土壤Cd含量:分层采集土壤样品后混匀,自然风干后磨细过2 mm网筛装袋备用。称取1.000 g土壤样品置于聚四氟乙烯坩埚中,加入15 mL HF和10 mL HNO3-HClO4(1∶1,V/V)加热至近干,再加入5 mL HNO3消煮至液体呈无色、无白烟冒出,定容过滤后,采用原子火焰吸收分光光度法测定Cd含量。植物Cd含量:将根和同株茎叶样品(根为植株地下部分,同株茎叶样品为植株地上部分)分别粉碎,过1 mm尼龙网筛后混匀备用。准确称取植物样品0.300 g于三角瓶中,加入20 mL HNO3-HClO4(4∶1,V/V),消煮至液体少量无色,定容过滤后用原子火焰吸收分光光度计测定Cd含量[23]。
并计算以下参数:
各器官Cd积累量=各器官Cd含量×各器官生物量(1)
富集系数(BCF)=地上(下)部Cd含量/土壤Cd含量(2)
转移系数(TF)=地上部Cd含量/地下部Cd含量(3)
土壤净化率=(地上部Cd积累量/土壤总Cd量)×100%(4)
1.4 数据处理
使用Microsoft Excel 2010处理数据,用SPSS 20.0对数据进行单因素方差(ANOVA)检验,采用Duncan多重比较进行处理间差异显著性检验(P<0.05),用Origin 9.0作图。
2 结果与分析
2.1 不同处理对籽粒苋生物量的影响
单施TA处理(T1和T2)显著提高了籽粒苋营养器官生物量(P<0.05),其中T2处理根、茎和叶生物量分别比CK增加了111.26%、123.12%和148.59%(图1)。单施AES对植株生物量的影响较小,仅A1处理根和叶生物量比CK有一定程度增加,而A2处理与CK相比无显著影响(P>0.05)。从图1可以看出,TA与AES配施时,随着TA浓度的增加植株地上部(茎和叶)生物量有一定程度增加,而随着AES浓度的增加,添加TA植株生物量未出现明显下降(P>0.05)。其中,A1T1和A1T2处理根、茎和叶生物量分别比CK增加77.00%~114.85%、34.27%~47.32%和35.24%~140.92%(P<0.05)。
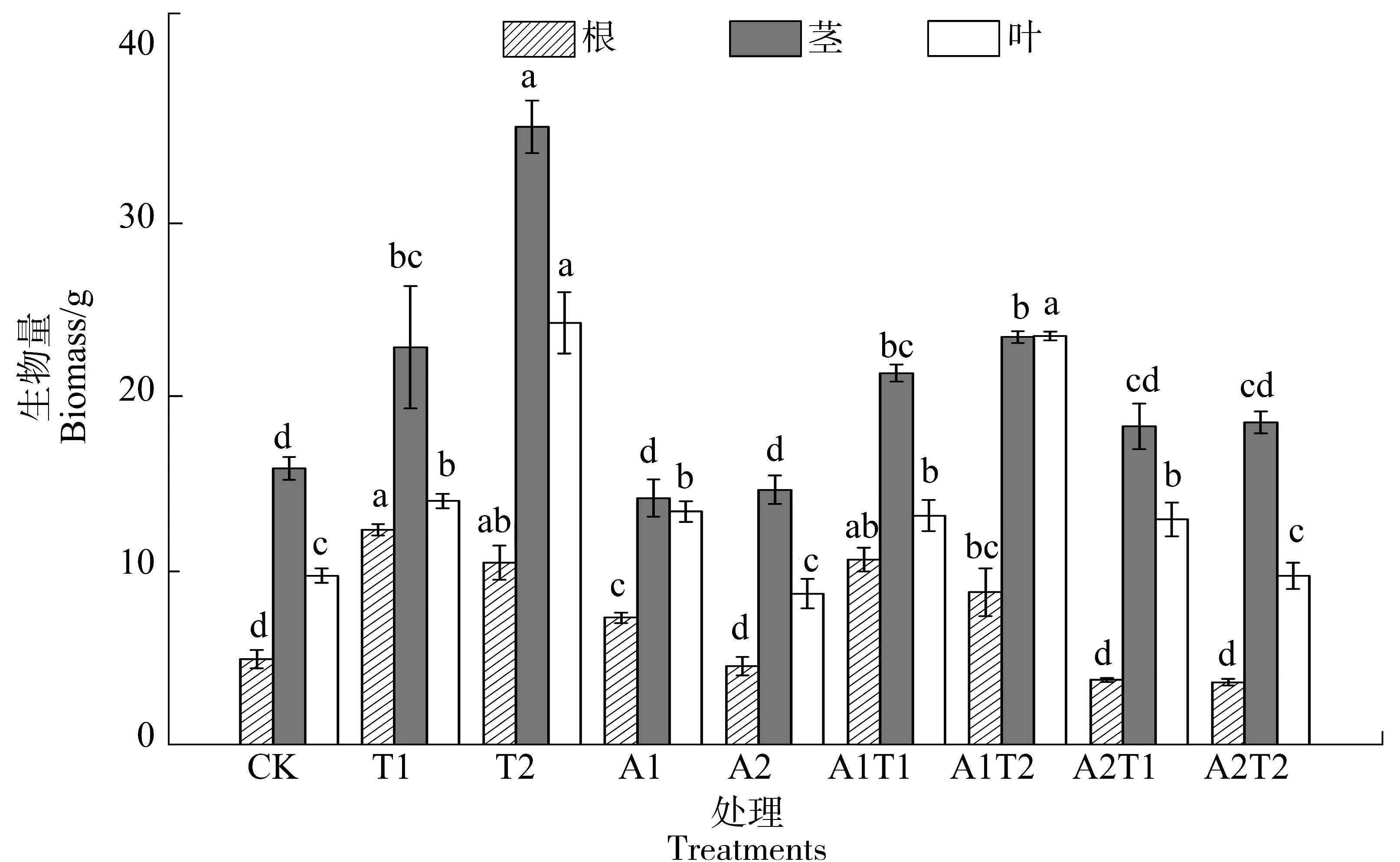
图1 不同处理对籽粒苋生物量的影响Figure 1 Effects of different treatments on the biomass of A.Hybridus
2.2 不同处理对叶片SOD和CAT活性的影响
单施TA能显著提升籽粒苋叶片SOD活性,与CK 相比增加 111.89%~123.02%(P<0.05,图 2a),而单施AES对SOD活性无显著影响(P>0.05)。两者复配时也能显著提升叶片SOD活性,与CK相比增加99.68%~120.20%(P<0.05,图2a)。随着 TA 浓度的增加,籽粒苋叶片CAT活性显著增加,T2处理比对照提高39.79%(P<0.05,图2b)。然而,单独添加AES、TA与AES配施均未显著增加叶片CAT活性(P>0.05,图 2b)。
2.3 不同处理对土壤Cd形态的影响
未添加有机酸和螯合剂处理(CK)中弱酸提取态Cd占总Cd的比例为39.33%,TA与AES添加后各处理土壤弱酸提取态Cd所占比例有所提升,而可氧化态Cd所占比例下降(图3)。各处理弱酸提取态Cd占比为CK的1.11~1.53倍,其中A2T2的弱酸提取态Cd占比最高,为总Cd的61.72%。
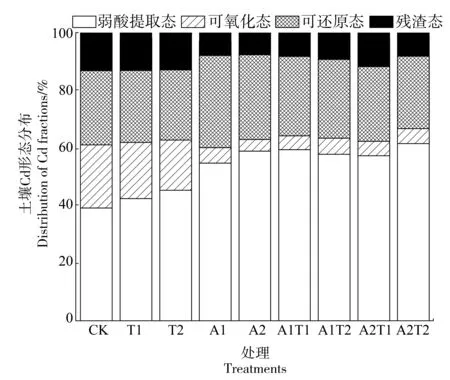
图3 不同处理土壤Cd形态分布特征Figure 3 Speciation distribution characteristics of Cd in soil after different treatments
2.4 不同处理下籽粒苋对Cd的富集特征
2.4.1 Cd含量和Cd积累量
由图4所示,各处理籽粒苋的Cd含量和Cd积累量均表现为地上部>地下部。TA与AES单施对籽粒苋Cd含量影响较小。T1处理植物地上部Cd含量比CK减少了9.43%,T2处理及AES单施对籽粒苋地上部Cd含量无显著影响(P>0.05,图4 a)。TA与AES配施时,A1T2和A2T2处理可增加地上部Cd含量,其中A2T2处理比对照提高35.71%(P<0.05,图4 a),而地下部Cd含量在高浓度AES与TA配施时显著低于CK(P<0.05)。
单施TA能显著提升籽粒苋地上部和地下部Cd积累量(P<0.05,图4 b),其中T2处理地上部Cd积累量比CK增加了147.37%。单施AES对籽粒苋地上部Cd积累量无显著影响(P>0.05,图4 b)。TA与AES配施显著提升籽粒苋地上部Cd积累量,与CK相比增加24.46%~108.05%(P<0.05,图4 b)。低浓度AES与TA配施显著提高籽粒苋地下部Cd积累量,而高浓度AES与TA配施显著降低地下部Cd积累量。
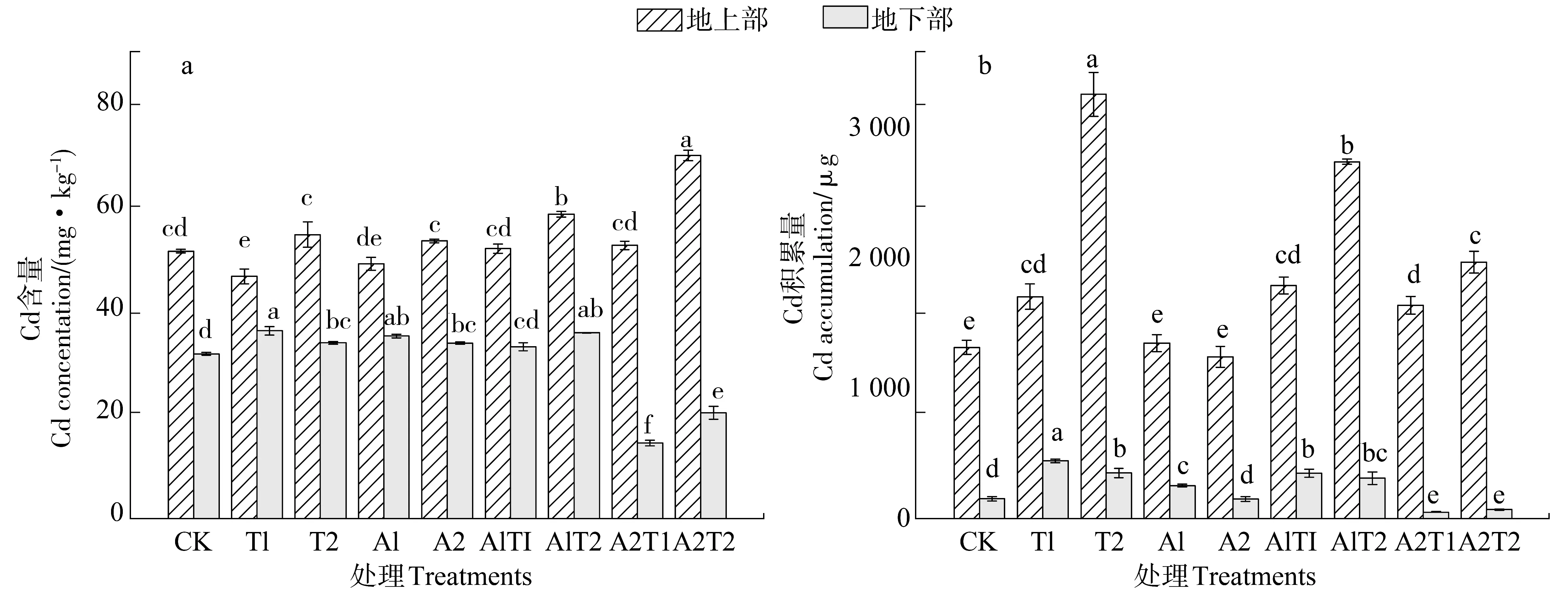
图4 不同处理对籽粒苋Cd含量(a)与Cd积累量(b)的影响Figure 4 Effects of different treatments on Cd concentration(a) and Cd accumulation(b) of A.Hybridus
2.4.2 富集系数、迁移系数和净化率
各处理下的籽粒苋富集系数均表现为地上部>地下部,且地上部富集系数均大于1(表1)。单施TA和单施AES对地上部和地下部富集系数均无显著影响(P>0.05)。TA与AES配施时,随着TA浓度的增加地上部富集系数有一定程度增加,其中A1T2、A2T2处理较CK显著增加(P<0.05)。
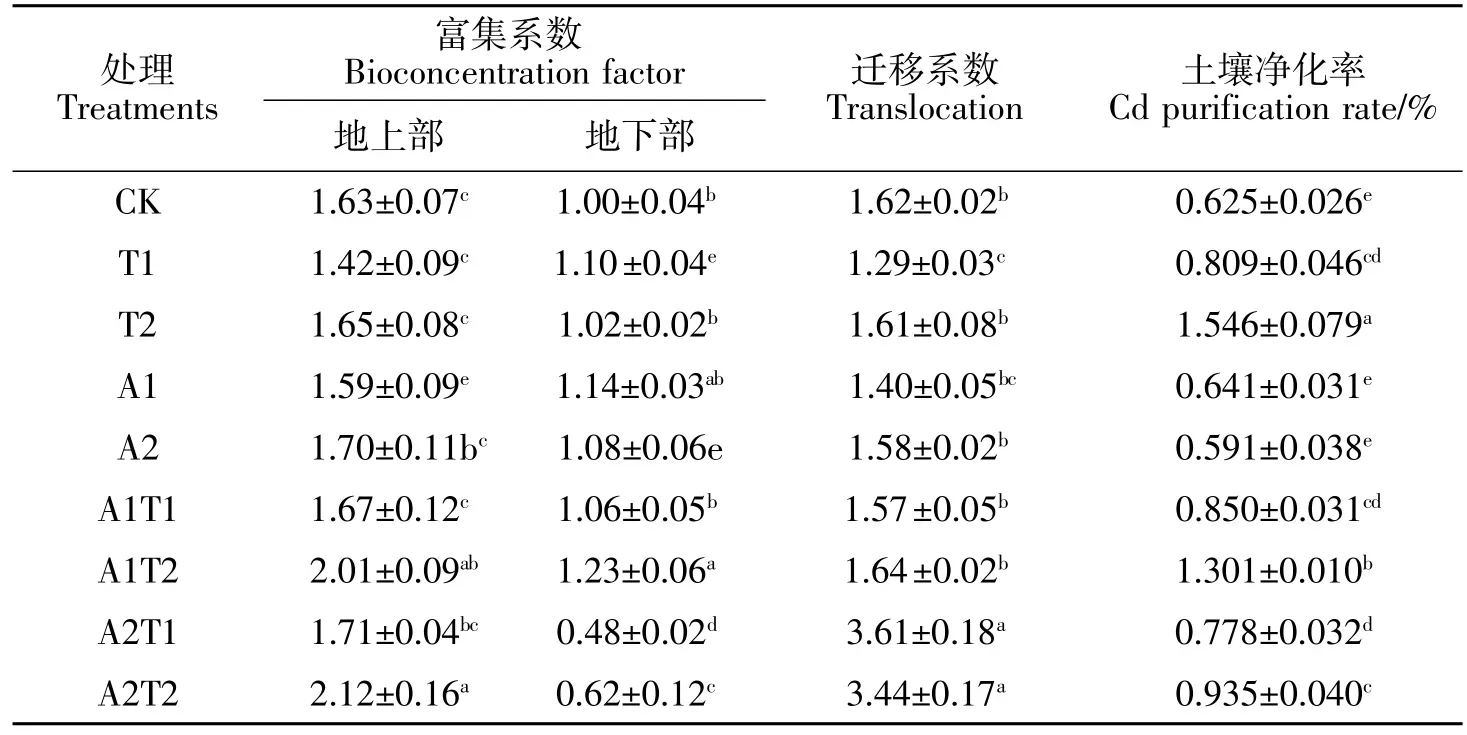
表1 不同处理对富集系数、迁移系数和Cd净化率的影响Table 1 Effects of different treatments on bioconcentration factor (BCF),translocation factor(TF) and Cd purification rate
各处理籽粒苋的迁移系数均大于1。单施TA迁移系数较CK有一定程度减小。单施AES对迁移系数无显著影响(P>0.05)。低浓度AES与TA配施对迁移系数无显著影响(P>0.05)。高浓度AES与TA配施迁移系数显著增加(P<0.05),A2T1、A2T2 分别为CK的2.22倍、2.12倍。
单施TA显著提高了土壤Cd的净化率(P<0.05),其中T2处理土壤净化率比CK增加了147.35%。单施AES对土壤净化率无显著影响(P>0.05)。两者配施的土壤净化率显著高于对照,为CK的1.24~2.08倍,且随着TA浓度的增加土壤净化率增加。
3 讨论
3.1 强化修复条件下籽粒苋对Cd的耐受能力
在植物修复过程中添加螯合剂能活化土壤中的重金属,使土壤溶液中的重金属离子浓度增加,提高重金属的生物有效性[15]。而当重金属离子浓度过高,超过了植物激活防御系统的能力时,会导致植物生物量减少[6]。本试验中2.5 mmol/kg AES处理根和叶生物量比CK有一定程度增加,可能是因为较低浓度的AES缓和了土壤中Cd对植物的毒害作用[24]。5 mmol/kg AES处理根茎叶生物量与CK相比基本没有明显下降,这可能与AES添加浓度并不太高有关。Chen L.等[25]在含Cd土壤中添加较低浓度EDDS时向日葵根、茎和叶生物量与CK无显著差异,但随着EDDS浓度的增高,该植物营养器官生物量呈逐渐下降趋势。这些结果表明,AES添加后籽粒苋仍能维持较高的生物量,这对于提升该植物的修复效率奠定了重要基础。
植物处于逆境胁迫下,细胞内自由基产生和清除的动态平衡被打破,植物体内自由基和活性氧积累,细胞膜脂过氧化加剧,过氧化产物含量升高,植物可通过抗氧化代谢如提高抗氧化酶的活性以清除体内的活性氧[26-27]。本试验中,单施TA使SOD和CAT活性升高,且TA浓度增加,升高幅度越明显。表明添加TA后,土壤溶液中增加的Cd含量启动了籽粒苋的抗氧化酶保护系统,减轻活性氧对细胞的伤害,提高植物的Cd耐受能力,有利于植物生长[28]。这与单施TA时籽粒苋营养器官生物量显著升高的结果一致(图1)。土壤溶液中Cd含量过高时,植物体内的活性氧不断积累,超过了抗氧化能力限度,抗氧化系统的平衡遭到破坏,引起细胞代谢失调,抑制抗氧化酶的合成,酶活性降低[29]。张玉芬等[30]研究发现10 mmol/kg EDTA使蓖麻叶片SOD、POD活性被抑制。而本试验单施AES对SOD和CAT活性无显著影响,可能是因为添加的AES浓度不够高,AES活化的Cd还没有造成严重的氧化胁迫,因此对植株的生长也未产生明显抑制(图1)。AES和TA配施处理下SOD和CAT活性均大于对应浓度的AES单施处理,这与茎和叶的生物量变化一致(图1),表明添加TA缓解了土壤溶液中Cd含量过高引起细胞代谢失调而产生的影响[16],从而使SOD和CAT活性升高,减轻活性氧对细胞的伤害,利于植物生长。同时,TA增强了籽粒苋对Cd的耐受能力,也可能是由于其添加后能通过酸化、溶解等作用活化土壤中的矿物成分,间接地促进了植物对营养元素的吸收,利于植物生长[17]。
3.2 强化修复条件下籽粒苋对Cd的积累能力
土壤中弱酸提取态重金属的生物活性和迁移性最强,更容易被植物吸收[31]。研究表明,相同浓度下,低分子量有机酸对重金属的活化能力普遍低于APCAs[11]。从本研究结果来看,AES对土壤中Cd的活化能力明显强于TA(图3),表明螯合剂对Cd的增溶效果明显,AES的络合作用使Cd从活性较低的组分中分离出来,并容易从土壤颗粒表面解吸[32]。低分子量有机酸也是重要的金属配位体,可改变土壤溶液中重金属的形态,减少土壤有机质与重金属离子的固定作用,增加重金属在土壤中的移动性[33]。然而TA对Cd的活化能力受自身矿化速度、土壤缓冲力及浓度的影响,也可能是由于TA与Cd形成的络合物不稳定[34],因此TA活化能力低于AES。但是,本研究发现当AES与TA复配时,土壤中Cd的活化效果明显高于单施TA的处理,表明螯合剂与有机酸联合可提高Cd的生物有效性,促进籽粒苋对Cd的吸收。
植物对Cd的修复效率主要取决于植株地上部能否大量积累Cd[35],而Cd的积累量则受植物的生物量与植物中Cd含量的共同影响。本试验中除A1T1处理,AES和TA复配下籽粒苋地上部富集系数和迁移系数分别是CK的1.04~1.30倍和1.01~2.23倍,表明两者配施对Cd从地下部向地上部迁移和Cd在植株地上部的富集有明显的促进作用。这与Wang K.等[10]的研究结果一致,该研究表明施用螯合剂后苋科植物千穗谷(Amaranthus hypochondriacus L.)对Cd的富集系数和迁移系数均能明显提升。本研究中单施AES对地上部Cd积累量无显著影响,然而TA与AES配施时,植株地上部Cd积累量和土壤净化率均大于对应浓度的AES单施处理,表明TA的添加有效缓解了AES对籽粒苋的毒害,促进了生物量的提升,进而提高了植物修复效率。由此可见,AES和TA配施既能保证籽粒苋的正常生长,又能提高植株积累Cd的能力。本研究中单施TA、AES与TA配施使土壤净化率相对于CK显著提高了24.48%~147.36%。陈亚慧等[17]发现蓖麻在EGTA与酒石酸的单施与配施处理下土壤净化率最高为0.25%,黄麻[21]、苎麻[36]在螯合剂作用下土壤净化率最高值分别为0.35%和1.22%(表2)。本研究中T2处理和A1T2处理的净化率较高,分别达1.55%和1.30%,表明T2和A1T2处理强化籽粒苋修复Cd污染土壤效果较好。

表2 不同植物在螯合剂作用下的植物修复效果Table 2 Effects of phytoremediation of different plants under chelating agents
4 结论
①高浓度的AES(5 mmol/kg)对籽粒苋生长有一定的毒害作用,而TA能缓解Cd对籽粒苋的胁迫。适当比例的AES和TA配施与AES单施相比,抗氧化酶SOD、CAT活性更高,能更有效地清除累积的活性氧。表明AES与TA配施能够提高籽粒苋对Cd的耐受能力。
②AES与TA配施时土壤弱酸提取态Cd所占比例最高,AES单施次之,TA单施时所占比例最低。
③0.067 mmol/kg TA单施时地上部Cd积累量和土壤净化率最高,分别比CK增加了147.37%和147.35%。0.067 mmol/kg TA与2.5 mmol/kg AES配施时地上部Cd积累量和土壤净化率均为CK的2.08倍。0.067 mmol/kg TA单施及0.067 mmol/kg TA与2.5 mmol/kg AES配施对加强籽粒苋对Cd的提取效率的效果较好。

