食淀粉乳杆菌干预PRV GDNF和GSNO的ZO-1调控
魏 萍,纪元元,张 萍,王 琦,耿天颖,于跃泓,李一经
(东北农业大学动物医学学院,哈尔滨 150030)
肠上皮屏障(Intestinal epithelial barrier,IEB)作为机体肠道抵御病原体重要屏障[1],包括肠上皮细胞表面理化屏障、上皮细胞层、上皮细胞间的紧密连接蛋白[2],其中紧密连接蛋白ZO-1 对细胞间连接起重要作用。猪轮状病毒可刺激肠嗜铬细胞产生5-羟色胺(5-hydroxytryptamine,5-HT)激活肠神经胶质细胞(Enteric glial cells,EGC)产生神经营 养 因 子(Glial cell derived neurotrophic factor,GDNF),ZO-1 表达增加[3],但改变肠道ZO-1 分布,降低肠上皮细胞完整性,破坏肠上皮屏障[4]。EGCs 分泌s-亚硝基谷胱甘肽(Nitrosoglutathione,GSNO)促进紧密连接相关蛋白表达,改善紧密连接蛋白的定位参与维持IEB 完整性[5]。食淀粉乳杆菌(Lactobacillus amylovorus)作为乳酸杆菌,是常见益生菌,对肠道屏障稳定有重要作用[6],但仍有待深入探索。Jariwala 等研究表明,众多乳酸杆菌可改善紧密连接蛋白分布,逆转肠道上皮细胞损伤[7]。因此,本研究通过灌胃乳鼠食淀粉乳杆菌,探索食淀粉乳杆菌是否可恢复乳鼠空肠ZO-1正常分布,提高乳鼠空肠肠上皮细胞屏障完整性,干预轮状病毒感染导致的肠屏障受损,为益生菌临床应用探索新思路。
1 材料与方法
1.1 菌株、毒株与实验动物
食淀粉乳杆菌由东北农业大学动物医学学院动物传染病实验室从健康仔猪粪便中分离鉴定保存[8]。猪轮状病毒OSU 株从ATCC 引进。清洁级2日龄中国昆明系乳鼠,购自哈尔滨医科大学,经A 组轮状病毒ELISA 试剂盒检测粪便样品RV-Ag均为阴性。
1.2 主要试剂与仪器
RNAeasy动物RNA抽提试剂盒(货号:R0026)购自碧云天生物技术有限公司。5×All-In-One RT MasterMix(货号:G492)购自美国ABM 公司。2×SYBRGreen qPCR Master Mix 荧光试剂(货号:B21203)购自Bimake 公司。实时荧光定量PCR 仪(型号为Roche LightCycler480Ⅱ)购自罗氏诊断产品(上海)有限公司。全蛋白提取试剂盒(货号:W034-1-1)和BCA测蛋白浓度试剂盒(货号:A045-4-2)均购自南京建成生物工程研究所。小鼠S-亚硝基谷胱甘肽(GSNO)酶联免疫分析试剂盒(货号:E-22215)和小鼠5-羟色胺(5-HT)酶联免疫分析试剂盒(货号:E-50056)购自北京诚林生物科技有限公司。一氧化氮(NO)测定试剂盒(货号:A-013-2-1)、微量还原型谷胱甘肽(GSH)测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒(货号:A001-3)、过氧化氢酶(CAT)测定试剂盒(货号:A007-1-1)、丙二醛(MDA)测定试剂盒(货号:A003-1)和谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(货号:A005-1)购自南京建成生物工程研究所。
1.3 试验分组
实验动物分为5组:正常对照组、轮状病毒组(RV组)、食淀粉乳杆菌组(L.a组)、预防性干预组(BI 组)、治疗性干预组(AI 组),每组25只,共饲喂11 d,饲喂前禁食2 h,饲喂后禁食2 h。从第1天开始,L.a组和BI组每日饲喂50 μL·d-1的食淀粉乳杆菌(107CFU·mL-1),其余各组饲喂等量生理盐水;第4 天RV 组、BI 组和AI 组饲喂50 μL 的RV(TCID50为10-6.6·0.1 mL-1),其他组不变;第5 天开始RV 组和正常组每日灌胃50 μL 生理盐水,L.a组、BI组和AI组饲喂50 μL·d-1食淀粉乳杆菌,连续饲喂3 d。从第8天开始,各组均饲喂50 μL生理盐水,直至试验结束。
1.4 引物设计与合成
根据GenBank 中已有Mus-GAPDH 参考序列XM017321385.2、Mus-ZO-1 参考序列BC138028.1和Mus-GDNF参考序列U36449.1,利用Primer Pre⁃mier 5.0 设计荧光定量PCR 所需引物。Mus-GAP⁃DH 靶基因片段大小为102 bp,上游引物序列:5'ATTGTCAGCAATGCATCCTG 3',下游引物序列:5' ATGGACTGTGGTCATGAGCC 3';Mus-ZO-1 靶基因片段长度为198 bp,上游引物序列:5'TCATC CCAAATAAGAACAGAGC 3',下游引物序列:5'TC ATCCCAAATAAGAACAGAGC 3';Mus-GDNF 靶 基因片段长度为61 bp,上游引物序列:5 CTTGGGT TTGGGCTATGAAA 3',下游引物序列:5' ACAGG AACCGCTGCAATATC 3'。引物由擎科生物科技有限公司合成。
1.5 小鼠空肠总RNA提取及反转录
取各组乳鼠空肠组织20 mg,置于研磨管中,迅速加入600 μL 预冷裂解液,用微型电动匀浆器匀浆。充分匀浆后,将匀浆液用移液枪移至1.5 mL EP 管中,室温放置3~5 min,约14 000 g 离心2 min,将上清液移至新无RNA 酶的EP 管。按照动物组织RNA 抽提试剂盒说明书操作,测定RNA 浓度。取各组空肠组织总RNA,按照HiS⁃cript®II 1st Strand cDNA Synthesis Kit(+gDNA wip⁃er)说明书作反转录,cDNA 分装冻存于-80 ℃,以备后续qPCR试验。
1.6 实时荧光定量PCR
取1.5 提取的cDNA 模板和1.4 的引物扩增ZO-1、GDNF基因。按照2×SYBR Green qPCR Master Mix 说明书操作,组内组间各重复3 次,每次扩增含内参引物和阴性对照。反应程序为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30s,72 ℃延伸30 s,共40个循环。取Ct值,利用2-ΔΔCt计算mRNA相对表达量。
1.7 GSNO及5-HT定量ELISA检测
取各组等量空肠组织各20 mg放入研磨管,加入等量1×PBS,用微型电动匀浆器匀浆。匀浆后,将匀浆液转入1.5 mL EP管中14 000 g离心10 min。取各组上清液,按照小鼠S-亚硝基谷胱甘肽(GSNO)酶联免疫分析试剂盒说明书和鼠5-羟色胺(5-HT)酶联免疫分析试剂盒说明书操作,测定OD450值,计算各组样本GSNO及NO含量。
1.8 乳鼠空肠组织总蛋白提取
取各组空肠组织1 mg 放入研磨管中,各加入预冷裂解工作液(150 μL RIPA 裂解液+1.5 μL PMSF,现配现用),用微型电动匀浆器匀浆。匀浆后,将匀浆液转移至1.5 mL EP 管中,4 ℃静置15 min。14 000 g 离心10 min,上清液即为空肠组织总蛋白。用BCA 试剂盒测定蛋白浓度,分装-80 ℃保存,用BCA试剂盒测定蛋白浓度。
1.9 Western blot检测
将1.8 提取的蛋白与2×上样缓冲液1∶1 煮样变性,然后经SDS-PAGE电泳切下目的片段转印,再用5%脱脂乳封闭,孵育一抗,4 ℃过夜,然后孵育二抗1 h,最后将NC 膜放入化学发光呈像设备中,在膜表面滴加ECL发光液,立即曝光。
1.10 空肠组织免疫组化
取乳鼠各组空肠组织2 cm 放入10%中性甲醛中固定24 h 后常规脱水、透明、浸蜡、包埋。然后按照彭科[9]方法进行免疫组化。
1.11 空肠组织抗氧化指标测定
取攻毒后1~4 d 各组乳鼠空肠组织各20 mg放入研磨管中,按说明书加入1×PBS 研磨,离心取上清液,使用商业试剂盒检测中国昆明鼠乳鼠空肠中NO、GSH、SOD、MDA、GSH-Px、CAT含量。
1.12 数据分析
应用Excel 2010 统计数据,应用Image J 软件分析平均光密度值,应用GraphPad Prisms 分析结果,独立样本t检验处理分析组间差异,*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。
2 结果与分析
2.1 食淀粉乳杆菌对乳鼠空肠内ZO-1 mRNA 水平的影响
如图1 所示,L.a 组ZO-1mRNA 相对表达量变化呈上升趋势,各时间段均高于其他组。RV 组ZO-1 mRNA 相对表达量变化均为先升后降,饲喂第6 天ZO-1 mRNA 相对表达量达到最大值。BI 组的ZO-1 mRNA 相对表达量变化不明显,整体高于RV 组和AI 组。AI 组ZO-1 mRNA 相对表达量呈下降趋势,攻毒后第1天明显高于RV组(P<0.01)。

图1 感染轮状病毒后各组ZO-1 mRNA相对表达量Fig.1 Relative expression of ZO-1 mRNA post infection with rotavirus
2.2 食淀粉乳杆菌对乳鼠空肠内GDNF mRNA 水平的影响
如图2所示,L.a组GDNF mRNA相对表达量变化呈上升趋势,且明显高于其他4 组。RV 组和BI组GDNF mRNA 相对表达量变化均先升后降。AI组GDNF mRNA 相对表达量呈上升趋势。

图2 感染轮状病毒后各组GDNF mRNA相对表达量Fig.2 Relative expression of GDNF mRNA post infection with rotavirus
2.3 乳鼠空肠5-HT含量变化
如图3所示,与对照组相比,L.a组5-HT含量呈下降趋势,但普遍高于其他组(P<0.01)。RV 组5-HT含量在各时间段高于对照组,低于BI组和AI组。BI 组5-HT 含量呈下降趋势,AI 组5-HT 含量呈先升后降趋势;BI 组在感染轮状病毒后各时间段均高于AI组。

图3 感染轮状病毒后各组5-HT含量Fig.3 Concentration of 5-HT in each group after rotavirus infection
2.4 乳鼠空肠内GSNO含量变化
如图4所示,感染病毒后,L.a组GSNO含量呈现上升趋势,与对照组对比差异极显著(P<0.01),RV 组、BI 组 和AI 组GSNO 含量呈先升后降趋势,RV 组和BI 组GSNO 含量在饲喂第7 天达到最大值,AI组GSNO含量在饲喂第6天达到最大值。感染病毒后,RV 组GSNO 含量变化不明显,与正常对照组对比差异不显著(P>0.05)。

图4 感染轮状病毒后各组GSNO表达量Fig.4 Expression of GSNO post infection with rotavirus
2.5 乳鼠空肠内ZO-1、GDNF、GFAP 蛋白含量变化
如图5 所示,在攻毒后第1天,各组ZO-1蛋白表达量和GFAP、GDNF整体趋势相似,均为L.a组表达量最高,RV组、BI组和AI组表达量较低。

图5 乳鼠感染RV后第1天ZO-1、GDNF、GFAP蛋白表达量Fig.5 Expression of ZO-1,GDNF and GFAP protein in suckling mice on the first day after RV infection
如图6所示,攻毒后第2天,与感染轮状病毒后变化趋势一致,仍是L.a 组3 种蛋白表达量高,RV组ZO-1蛋白表达量高于正常对照组,GFAP和GDNF蛋白表达量变化趋势一致。

图6 乳鼠感染RV后第2天ZO-1、GDNF、GFAP蛋白表达量Fig.6 Expression of ZO-1,GDNF and GFAP protein in suckling mice on the second day after RV infection
如图7所示,在感染轮状病毒后第3天,L.a组ZO-1 蛋白表达量最高,BI 组GFAP 蛋白表达量最高,AI组GDNF蛋白表达量最高。
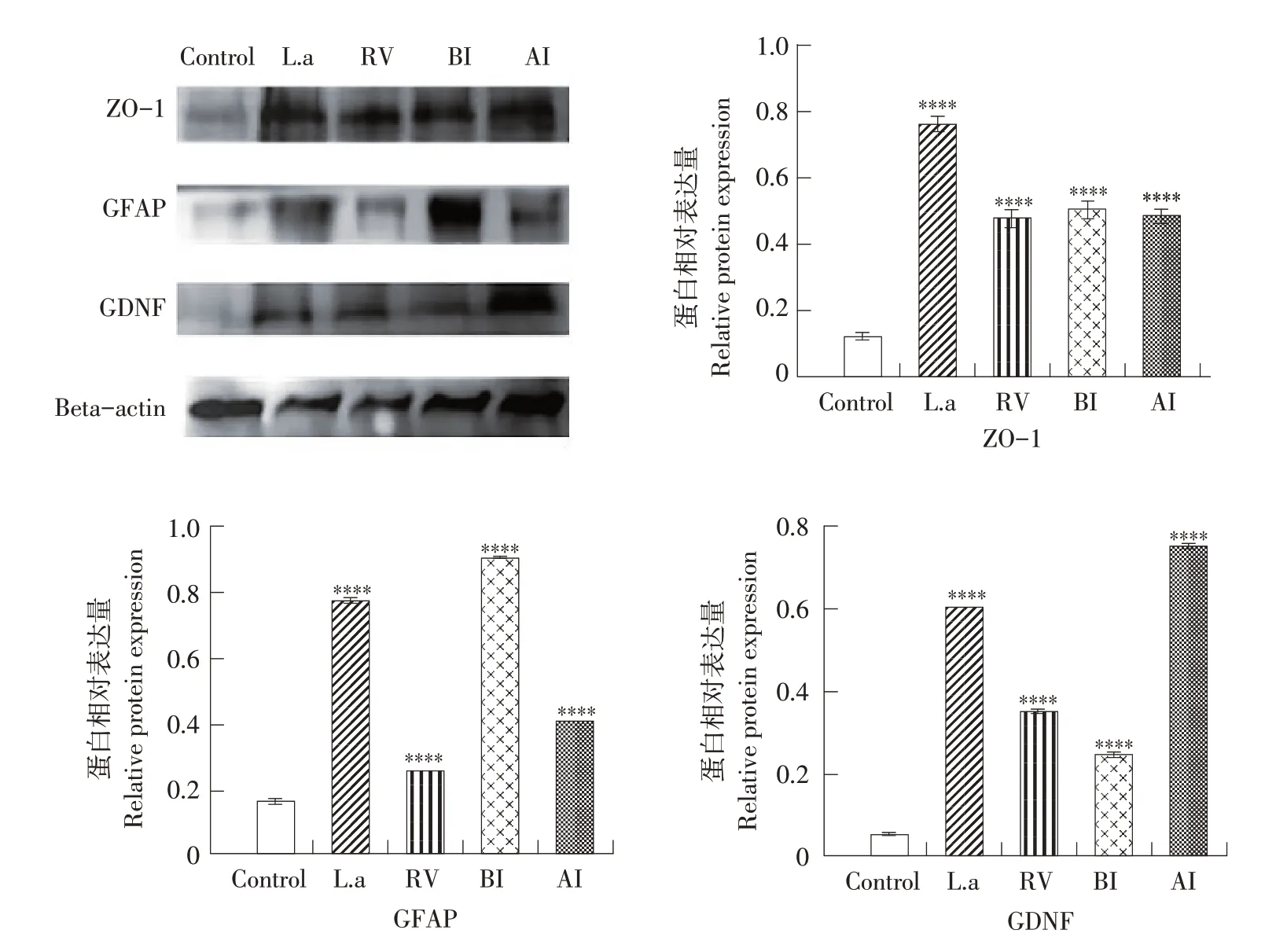
图7 乳鼠感染RV后第3天ZO-1、GDNF、GFAP蛋白表达量Fig.7 Expression of ZO-1,GDNF and GFAP protein in suckling mice on the third day after RV infection
如图8所示,在攻毒后第4天,L.a组3种蛋白表达量均最高,RV 组GFAP 蛋白表达量超过BI 组和AI组,RV组GDNF蛋白表达量最低。

图8 乳鼠感染RV后第4天ZO-1、GDNF、GFAP蛋白表达量Fig.8 Expression of ZO-1,GDNF and GFAP protein in suckling mice on the fourth day after RV infection
2.6 乳鼠空肠免疫组化
如图9 所示,紧密连接蛋白ZO-1 棕黄色粗颗粒主要分布在肠绒毛边缘,上皮细胞膜外侧,细胞质内也有少量分布。如图10 所示,各组平均光强度值从高到低依次是L.a 组、BI 组、AI 组、RV组、对照组。L.a 组棕黄色颗粒变深,表达更连续,分布更均匀(P<0.0001)。RV 组棕黄色颗粒变浅,表达不连续,分布不均匀(P<0.0001)。BI 组棕黄色颗粒较RV组颜色变化不明显,表达较之连续,分布较之明显(P<0.001)。

图9 乳鼠感染PRV后ZO-1蛋白免疫组化结果(放大倍数:400倍)Fig.9 Immunohistochemical results of ZO-1 protein in suckling mice infected with PRV(×400)
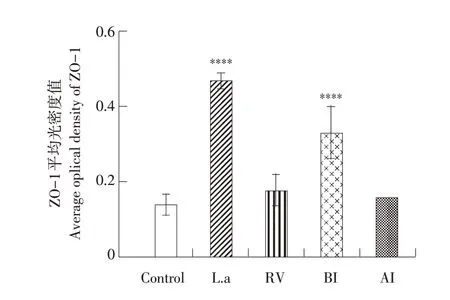
图10 乳鼠感染PRV后ZO-1蛋白平均光密度值Fig.10 Average optical density of ZO-1 protein in suckling mice infected with PRV
2.7 乳鼠空肠中抗氧化指标含量变化
结果如图11所示。
由图11 可知,NO 与MDA 含量变化趋势一致,L.a 组NO 与MDA 含量与对照组相比,无明显差异(P>0.05),各时间段含量较低且无明显变化;RV组先升后降,整体含量均高于其他组;BI组与AI 组含量均高于L.a 组。CAT 和GSH-Px 含量变化趋势一致,与对照组相比,L.a 组在各时间段含量均最高;RV 组含量呈先升后降趋势,均为攻毒后第2 天达到峰值;AI 组含量在攻毒后第1 天最高,BI 组含量变化不明显。SOD 和GSH 含量变化趋势一致,L.a组含量呈先降后升趋势;RV组的含量呈先升后降趋势;BI 组含量基本呈上升趋势;AI 组SOD含量呈下降趋势,GSH含量呈先降后升趋势。

图11 感染轮状病毒后各组NO、MDA、CAT、SOD、GSH、GSH-Px含量Fig.11 Concentrations of NO,MDA,CAT,SOD,GSH and GSH-Px in each group after rotavirus infection
3 讨论
多种肠道病毒均可刺激EC细胞释放5-HT,激活EGCs,如腺病毒-41及PEDV[10-11]。RV同样具有此功能,通过感染绒毛顶部和中间成熟肠上皮细胞,肠毒素NSP4 刺激EC 细胞释放5-HT[12],激活EGCs。本研究结果表明,攻毒后RV 组的5-HT 含量均高于正常对照组,证明轮状病毒可刺激EC 细胞释放5-HT,攻毒后第3~4天,GFAP表达量高于正常对照组,GFAP 表达增多是激活EGCs 的标志,说明轮状病毒通过上调5-HT 表达量激活EGCs,与上述结论一致。从5-HT 释放到激活EGCs 有时间差,说明在乳鼠空肠内5-HT 可能需达到一定浓度才激活EGCs。Engevik等研究证明并非所有肠道益生菌均促进5-HT释放,但人源性双歧杆菌可上调哺乳动物释放5-HT[13]。本研究中,L.a组5-HT表达量在各时间段均高于其他组,说明食淀粉乳杆菌同样具有促进肠道中EC细胞释放5-HT 的功能。攻毒后各时间段,BI 组和AI 组5-HT和GFAP表达量呈正相关,均高于RV组,说明食淀粉乳杆菌可通过上调5-HT 表达量激活更多EGCs,干预轮状病毒感染。
EGCs 分泌的促炎或抗炎因子可调节肠上皮屏障功能,如NO、GDNF和GSNO,通过不同机制对肠屏障功能起保护作用[14]。GDNF 可直接作用于肠上皮细胞,通过抑制TNF-α 和IL-1β 等多种促炎因子释放起抗炎作用,维持肠上皮屏障完整性。Boyen等研究表明,从患溃疡性结肠炎和克罗恩病病例肠活检的组织学检查中,GFAP、S100B 和发炎区域的GDNF表达量有所增加[15]。本研究中,攻毒后第3~4天,RV组GFAP和GDNF蛋白表达量均高于正常对照组,与上述结论一致。益生菌可直接调节机体肠上皮屏障功能,但维持肠上皮屏障完整性的调节因子尚未明确。BI 组与AI 组在攻毒前3 d,GDNF蛋白表达量均高于RV组,说明食淀粉乳杆菌可通过上调GDNF表达量维持肠上皮屏障完整性,干预轮状病毒感染。然而,是否通过抑制促炎因子释放发挥维持肠上皮屏障功能,需进一步研究。EGCs 来源的GSNO 通过改善如ZO-1、Occudin 等紧密连接蛋白分布维持肠上皮屏障功能[10]。本研究中,攻毒后RV 组GSNO 含量显著下调,揭示轮状病毒可能通过抑制GSNO表达破坏肠上皮屏障完整性。BI 组和AI 组GSNO 含量则高于RV 组,且免疫组化结果表明,BI 组和AI 组ZO-1蛋白较RV组排列紧密、分布均匀,说明食淀粉乳杆菌可通过上调GSNO表达量改善紧密连接蛋白分布,维持肠上皮屏障完整性,干预轮状病毒感染。
正常情况下,GSNO 在体内处于动态平衡。GSH亚硝基化和氧化反应取决于细胞内NO和GSH浓度。在NO低浓度和GSH高浓度时,机体趋向于GSH 亚硝基化反应,GSNO 表达量高;反之GSNO表达量低[16]。本研究中,RV 组NO 与GSH 表达量呈负相关,揭示轮状病毒可能通过促进GSH 氧化反应抑制GSNO 表达,间接破坏肠上皮屏障完整性。BI组NO高表达量和GSH低表达量,揭示食淀粉乳杆菌可能是通过促进GSH 亚硝基化反应,上调GSNO表达,降低肠道损伤,增强机体抗氧化能力,干预轮状病毒感染。Engevik 等研究证明机体内过氧化物含量过高,诱导紧密连接蛋白和黏附连接蛋白从细胞间连接转到细胞内,破坏肠上皮屏障完整性[13]。本研究结果表明,轮状病毒可通过感染乳鼠肠上皮细胞下调CAT、GSH-Px 表达量,导致过氧化物含量过高,破坏肠上皮屏障完整性,与上述结论一致。Hagbom 等报道乳酸菌可直接在肠道发挥抗氧化作用,通过维持肠道氧化还原平衡状态维持肠道健康,改善肠道损伤[13]。BI组和AI组证明食淀粉乳杆菌通过上调CAT、GSH-Px表达量,降低乳鼠空肠内过氧化物浓度,维持肠上皮屏障完整性,干预轮状病毒感染,但未能直接观察到紧密连接蛋白从细胞间连接进入细胞质,需进一步研究。
ZO-1 作为细胞间连接功能的重要蛋白和细胞骨架,是肠上皮屏障形成的关键因素。刘芳宁研究表明hRV 感染Gn 猪后3~6 d 腹泻越严重,回肠上皮中TJ和AJ蛋白含量越高,原因是感染后损伤的肠上皮细胞补偿性增生[17]。本研究中,攻毒后1~4 d,RV 组ZO-1 蛋白表达增多,与上述结论一致,而mRNA 表达量低于对照组,原因是样品同时采集,而mRNA 翻译成蛋白质需要时间。BI 组ZO-1 蛋白表达量在攻毒后第1 天显著低于RV 组,间接说明食淀粉乳杆菌降低轮状病毒感染造成的肠上皮损伤及增生。然而,本研究仅检测部分TJ 和AJ 蛋白,并不能全面说明问题,还需进一步研究。
综上所述,食淀粉乳杆菌可通过激活EGCs 分泌GDNF和GSNO,上调ZO-1表达,维持乳鼠空肠中ZO-1 正常分布;通过过氧化物酶分解大量过氧化物,提高乳鼠空肠抗氧化能力,两者共同作用,维持肠上皮屏障完整性,干预轮状病毒感染,为后续研究益生菌干预轮状病毒感染提供思路。

