大豆染色体片段代换系群体苗期耐盐性鉴定及评价
武小霞,郭雪田,王港庆,吴姗姗,常 丹,吴 博,石红霞,欧阳慧,孙铭江,赵 莹
(东北农业大学农学院,哈尔滨 150030)
土壤盐渍化是全球性生态问题之一,产生的高盐环境使植物受到伤害,如植物水分大量流失,植株叶片枯黄掉落,气孔关闭,胞间CO2浓度下降致使光合作用降低等,影响植株正常生长[1]。我国盐碱地分布广泛,面积较大[2-3]。由于我国土地资源有限,各种非生产用地不断增加,工业污染及环境恶化等因素导致可用耕地面积不断下降。因此,筛选耐盐植物品种资源是将盐渍土地可用化的必要手段[4]。
近年来,我国科学家对农作物耐盐性开展大量研究,研究结果在实际生产中应用广泛。张新草等比较大豆材料发芽期对盐胁迫的响应,将18份大豆材料划分为耐逆性不同的5类[5]。李依等采用相关性分析、聚类分析法,综合分析60 份豇豆品种资源,根据耐盐综合评价值(D 值)将60 份缸豆品种资源分成耐盐敏感程度不同的3 类[6]。水培法是盐处理研究常用方法,田小霞等使用此方法,从48 份紫花苜蓿材料中筛选11 份强耐盐材料[7]。相对根长和相对茎叶干重可直观表现植物生长状态,陈杨等以此为根据,计算4个耐盐性不同花生品种耐盐系数,并鉴定花生苗期耐盐性[8]。开展农作物种质资源耐盐性鉴定,可有效筛选极端材料,对耐盐品种选育具有指导意义。
本研究对大豆染色体片段代换系群体材料植株苗期作盐胁迫处理,筛选优异耐盐材料,利用主成分分析、权重和隶属函数等多种统计方法分析各株系不同指标,最终计算得到耐盐指数D 值,并综合评价大豆耐盐性,从而实现染色体片段代换系群体材料在非生物胁迫领域应用的探索,为大豆耐盐育种提供理论依据和材料支持。
1 材料与方法
1.1 试验材料
本研究所使用染色体片段代换系群体材料由东北农业大学大豆遗传改良团队构建,于2006 年以野生大豆ZYD00006为供体亲本,以黑龙江省大豆主栽品种绥农14(SN14)为轮回亲本,通过杂交、回交及自交构建一套全基因组染色体片段代换系(Chromosome segment substitution lines,CSSLs)群体,下称代换系[9]。本试验使用材料为183 份2019 年收获代换系群体种子和165 份2020 年收获代换系群体种子(2020年代换系群体由2019年收获代换系种子播种所得,所选材料同属一个代换系)。
1.2 试验设计
试验于2020~2021年在东北农业大学大豆遗传改良实验室完成。试验前期使用不同浓度梯度Na⁃Cl 溶液对代换系群体作胁迫处理,筛选出适宜耐盐性鉴定试验的NaCl 溶液浓度:使用0~240 mmol·L-1(梯度为60 mmol·L-1)NaCl 溶液对大豆代换系群体作盐胁迫处理,调查株高、根长、地上鲜重和地下鲜重4 个指标,NaCl 浓度为120 mmol·L-1时,大豆代换系群体材料间指标差异明显。因此,选择120 mmol·L-1为适宜处理浓度开展后续研究。
试验采用水培法,以SN14 为对照,每份大豆代换系群体材料取40 粒种子放置于装有蛭石的塑料盆(直径25 cm,高6 cm)中发芽,发芽后移植40株到带有打孔泡沫板(厚度1.5 cm)塑料盆中水培,海绵块固定子叶下部茎秆插入打孔的泡沫板,每盆盛满2 kg 蒸馏水,每盆种植一份材料共40 株,重复3 次。定植后,在昼夜温度为(26±2)℃/(24±2)℃,光周期为12 h,相对湿度为75%温室内培养。蒸馏水培养至真叶展开时作盐胁迫处理。
1.3 耐盐指标测定
大豆幼苗盐胁迫处理时期为真叶期,每次重复挑选胁迫5 d后长势均匀大豆植株20株,直尺测量其根长、株高(植株根茎部至顶部之间距离),称量地上及地下鲜重,测量均在采集鲜活植株后完成。测量和称重前需用水彻底清洗根部,并用滤纸吸去附着在幼苗表面水分,计算各项指标相对值和耐盐指数D值。
1.4 计算公式
①相对株高(Relative plant height,RPH)=处理株高/对照株高×100%;
②相对根长(Relative root length,RRL)=处理根长/对照根长×100%;
③相对地上鲜重(Relative ground fresh weight,RGFW)=处理地上鲜重/对照地上鲜重×100%;
④相对地下鲜重(Relative underground fresh weight,RUFW)=处理地下鲜重/对照地下鲜重×100%;
⑤隶属函数分析R(Xj, i)=(Xj, i-Xj,min)/(Xj,max-Xj,min),j=1,2,…,n;可将试验材料综合指标若干主成分值转化为隶属函数值。Xj,i表示第i个品种第j个主成分值,Xj,min表示第j个主成分最小值,Xj,max表示第j个主成分最大值。
⑥权重Wj=,j=1,2,…,n;wj表示第j个主成分在所有主成分中重要程度,即权重,Pj代表经主成分分析所得第j个主成分贡献率。
⑦耐盐综合评价D=,j=1,2,…,n;D 值为第i个大豆代换系株系在盐胁迫条件下由综合指标评价所得耐盐性综合评价值。
1.5 数据处理与分析
本研究采用Excel 2016软件计算大豆代换系群体材料各指标值平均数及相对值,使用SPSS 20.0软件对试验材料各项指标分析主成分。利用主成分分析提取主成分,计算权重和隶属函数值,最后利用各值计算耐盐性综合评价值。
2 结果与分析
2.1 代换系群体两年表型数据分析
对代换系群体株高、根长、地上鲜重和地下鲜重4个形态指标作数据统计,代换系群体株高和地下鲜重呈近似正态分布(见图1)。2019年群体株高指标平均值为13.52 cm,标准差为1.95,峰度为0.35,偏度为-0.28;2020 年群体株高指标平均值为12.60 cm,标准差为2.36,峰度为-0.51,偏度为-0.34。2019 年群体根长指标平均值为13.73 cm,标准差为2.07,峰度为-0.97,偏度为0.28;2020年群体根长指标平均值为12.80 cm,标准差为1.84,峰度为-0.20,偏度为0.23。2019 年群体地上鲜重指标平均值为0.47 g,标准差为0.18,峰度为0.63,偏度为0.79;2020年群体地上鲜重指标平均值为0.69 g,标准差为0.21,峰度为0.66,偏度为0.79。2019 年群体地下鲜重指标平均值为0.52 g,标准差为0.18,峰度为2.25,偏度为1.08;2020年群体地下鲜重指标平均值为0.49 g,标准差为0.10,峰度为0.06,偏度为-0.06(见表1)。
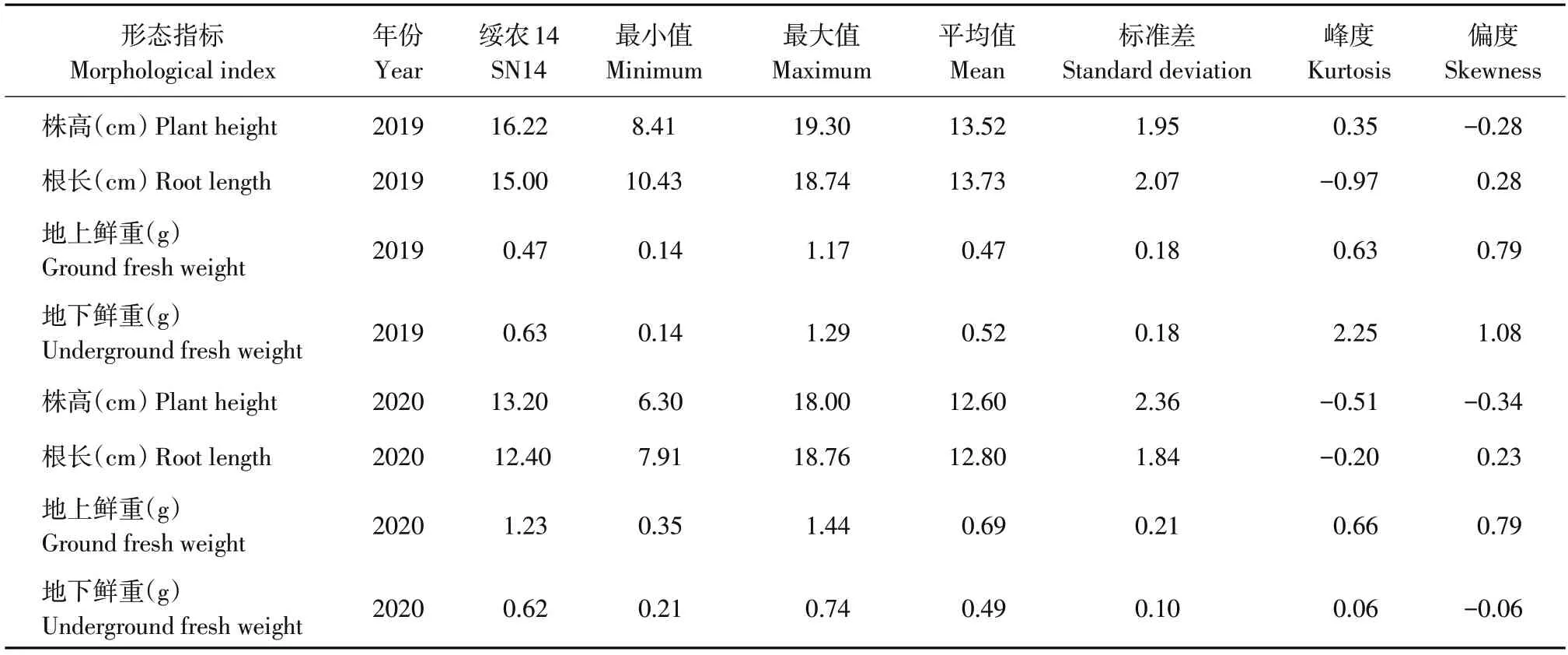
表1 两年代换系群体耐盐形态指标参数Table 1 Morphological parameters of salt tolerance of CSSLs population in two years
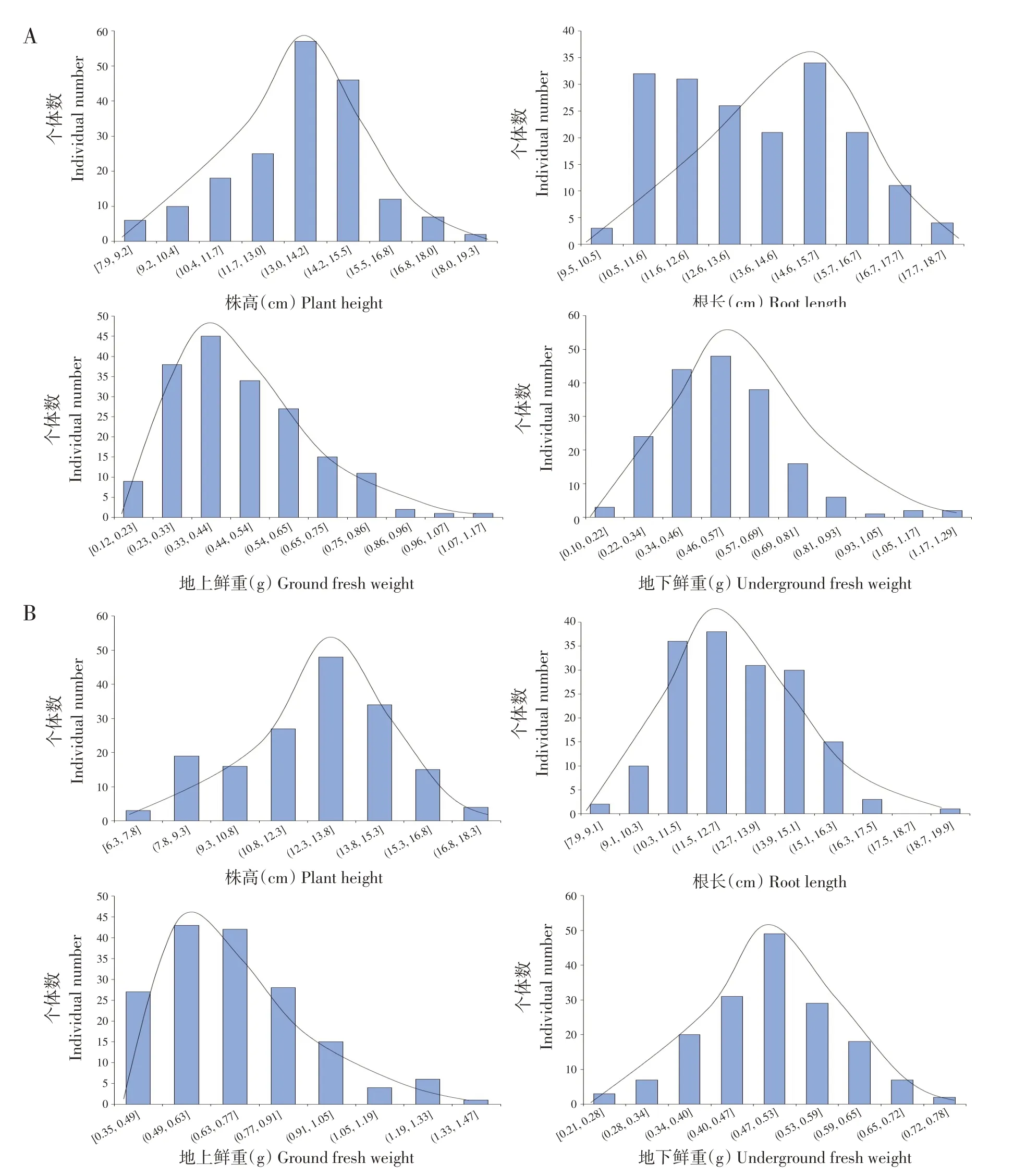
图1 2019年和2020年代换系群体耐盐指标频率分布Fig.1 Frequency distribution of salt tolerance index in CSSL population in 2019 and 2020
2.2 盐胁迫条件下大豆代换系群体苗期性状相关性分析
分析4 个形态指标之间相关性,获得相关矩阵。2019 年相对株高分别与相对根长、相对地下鲜重和相对地上鲜重呈极显著正相关(相关系数分别为0.952、0.961和0.949),相对根长分别与相对地上鲜重和相对地下鲜重呈极显著正相关(0.981和0.971),相对地下鲜重与相对地上鲜重呈极显著正相关(相关系数为0.991)。2020 年相对株高分别与相对根长、相对地下鲜重和相对地上鲜重呈极显著正相关(相关系数分别为0.970、0.980 和0.946),相对根长分别与相对地上鲜重和相对地下鲜重呈极显著正相关(相关系数分别为0.983和0.985),相对地下鲜重与相对地上鲜重呈极显著正相关(相关系数为0.974)。根据盐胁迫下大豆苗期耐盐性状之间相关性可看出,性状间均存在显著相关性,仅通过观察形态指标无法筛选得到耐盐材料,需综合分析相关数据。
2.3 主成分分析和贡献率
本研究在4个特征值中提取出特征值和贡献率较大的两个主成分(见表3)。2019年183份材料两个主成分贡献率分别为42.75%和29.87%,累积贡献率为72.61%;2020 年165 份材料两个主成分贡献率分别为34.57%和32.50%,累积贡献率为67.08%。主成分分析结果可有效反映数据情况,符合分析要求。
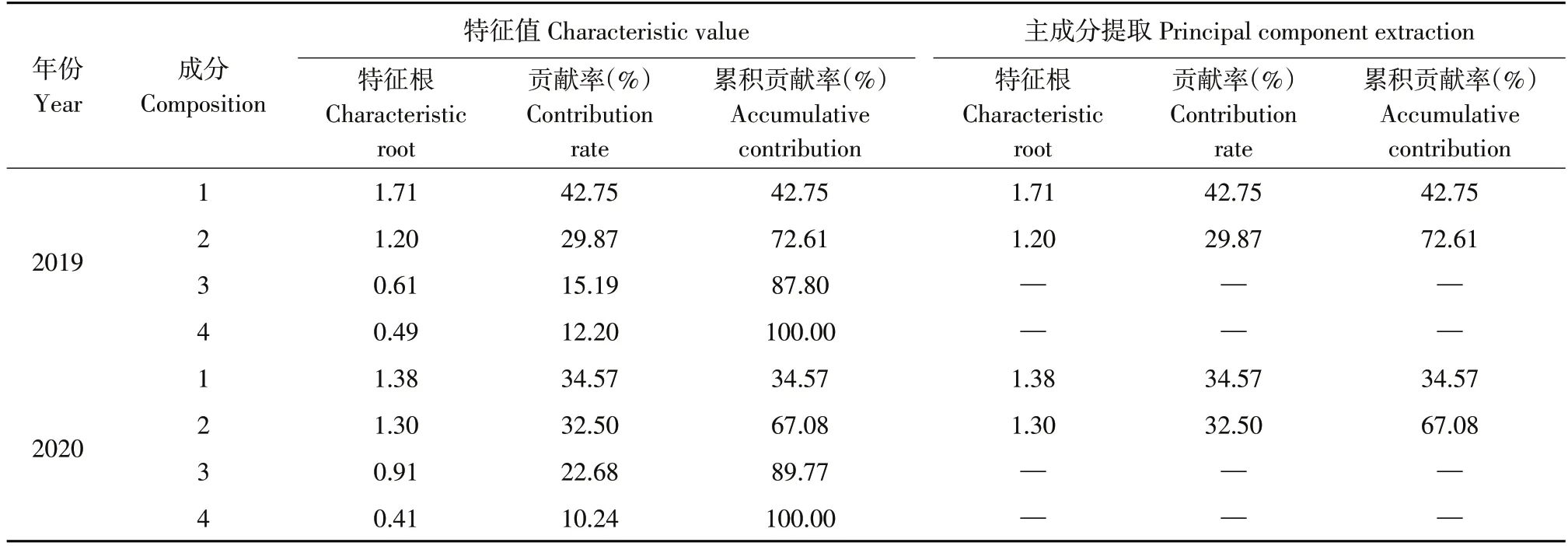
表3 两年主成分特征值及贡献率Table 3 Eigenvalues and contribution rates of principal components in two years
2.4 隶属函数分析、权重确定及综合评价
盐胁迫下,利用材料和方法中公式计算得到两个主成分在2019 年和2020 年权重值分别为58.86%、41.14%和51.55%、48.45%,并分别计算两年各综合指标隶属函数值和综合评价值D。计算2019年材料为183份和2020年材料为165份代换系材料综合评价D值平均数,开展耐盐强弱综合排名(D值越大,则表示耐盐能力强)。按照两年综合评价D 值平均数依次排名,选择排名前7%和排名后8%材料,耐盐能力排前12 试验材料为R26、R173、R115、R54、R21、R172、R35、R142、R150、R28、R193、R19;耐盐能力排后13 供试材料 为R165、R97、R136、R185、R184、R154、R102、R8、R135、R101、R137、R208、R147。根据大豆苗期耐盐性试验观察结果,该结果与大豆代换系群体材料表现的实际耐盐情况一致(见表4)。
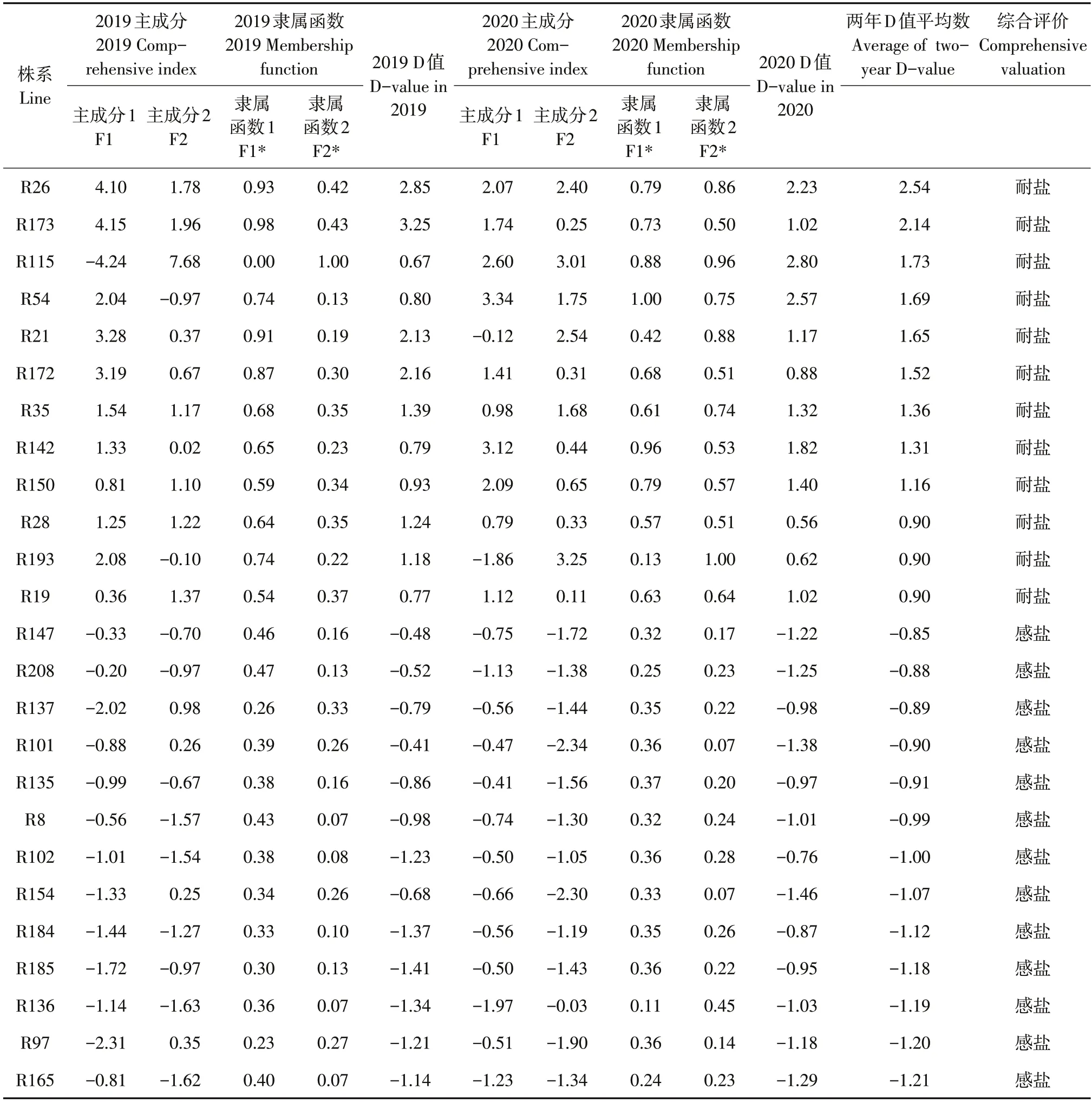
表4 大豆苗期贡献率,隶属函数值及综合评价值(D)Table 4 Contribution rate,membership function value and comprehensive evaluation value(D)of soybean at seedling stage
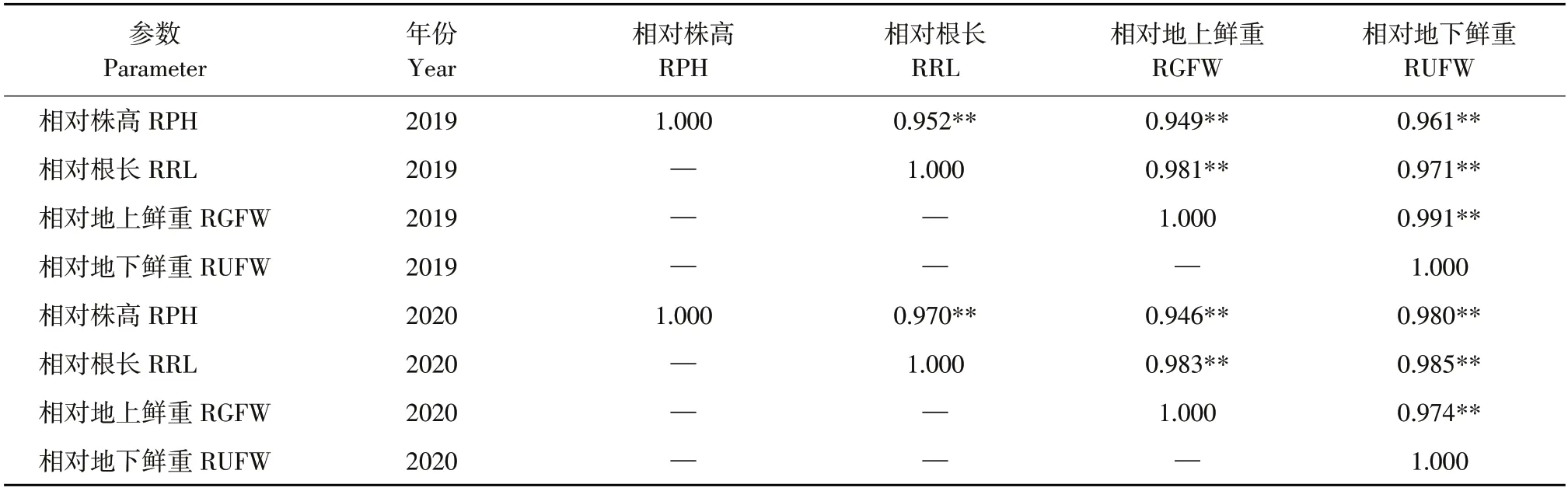
表2 两年盐胁迫下大豆各性状相关性Table 2 Correlation of soybean characters under salt stress in two years
3 讨论与结论
大部分作物在盐渍土地上无法正常生长,造成土地资源浪费[10]。大豆是一种中度耐盐作物,但盐浓度超过55 mmol·L-1时,产量和品质降低,土地盐渍化影响大豆生产[11-12]。
牛远等研究表明,无论是大豆幼苗期还是其他生长阶段,其对盐胁迫表现高度一致,大豆幼苗植株受盐胁迫后,盐分通过渗透胁迫、离子毒害和同化物积累抑制等途径降低光合效率,抑制植株茎叶部分和根系生长,导致叶片脱水收缩[13]。本研究采用120 mmol·L-1NaCl 浓度处理大豆染色体片段代换系材料,发现大豆幼苗株高、根长、地上鲜重和地下鲜重积累均减少,综合分析所筛选代换系群体中12 份材料为耐盐材料。水培法是盐处理试验常用方法,该方法操作简便,易实现对实验条件的局部控制,且易重复、实验试剂毒性危害小[14],王春语等使用水培法对636份高粱资源材料作盐胁迫处理,根据高粱抽穗期株高表现,筛选出耐盐和盐敏感材料共计16 份[15]。除水培法外,沙土水溶液培养法也可有效开展盐处理试验。柏锡等采用沙土水溶液培养方法,成功建立转基因大豆耐盐性鉴定体系[16]。
观察大豆染色体片段代换系群体株高和根长,同时比较其地上和地下鲜重发现,各指标间相互交叉的相关性对数据产生屏蔽效应。大豆耐盐性是无法直接通过形态指标观察作评价的复杂性状。因此本研究使用多元分析方法,包括方差分析、相关性分析、主成分分析、权重分析和隶属函数分析作综合评价大豆耐盐性。成分分析表明,从大豆盐胁迫处理幼苗期4个形态指标中提取两个代表性主成分,并结合隶属函数和权重,确定耐盐性综合评价D值,完成对染色体片段代换系材料耐盐性筛选。
本研究选用试验材料为大豆染色体片段代换系群体是对野生大豆资源的利用。野生大豆抗逆性较强,适应能力也较强,耐盐性较好,为培育耐盐材料提供基础[17]。Qi等采用野生大豆和栽培大豆重组自交系(RIL),利用全基因组测序作种子抗逆性等性状主效QTL 定位分析,发现耐盐关键基因GmCHX1[18]。王臻昱等从野大豆盐碱胁迫基因表达谱中筛选并克隆得到GsGST19基因[19]。以上研究揭示野生大豆在驯化过程中的变异和进化规律,为今后进一步精细解析野生大豆耐逆机理提供理论依据。

