连续性与间歇性血液净化治疗对脓毒症休克所致急性肾损伤患者肾脏血流动力学及糖代谢指标的影响
赵 敏, 李吉明, 杨宇莹, 高晓霞
(新疆医科大学第一附属医院, 新疆 乌鲁木齐 830000)
脓毒症是由感染所引起的全身性炎症反应综合征,可造成机体多器官功能障碍[1]。急性肾损伤(Acute kidney injury,AKI)是导致脓毒性休克患者死亡的重要、独立危险因素,老年脓毒症患者的发生率为50.8%。患者易合并急性肺损伤、应激性溃疡、深静脉血栓等并发症,患者在接受治疗后,仅一半患者可在出院前恢复正常肾功能。此类患者通常需要采用综合性治疗,其中血液透析方式分为连续性肾脏替代治疗(Continuous renal replacement therapy,CRRT)、间歇性血液透析(Intermittent hemodialysis,IHD)[2,3]。CRRT为连续性采用体外循环血液净化,清除水和有害溶质,对患者血流动力学影响较小[2];IHD可有效预防低血压、维持酸碱平衡,但毒素清除率不及CRRT[3],两种方式各具有优缺点。脓毒症休克所致AKI患者内环境紊乱,糖代谢、酸碱平衡等均遭受破坏,因此本研究对72例脓毒症休克所致AKI患者行CRRT治疗,另75例行IHD,通过对比两组患者的肾脏血流、糖代谢情况以评估治疗效果,为临床治疗提供参考。
1 资料与方法
1.1研究对象:选取2019年3月至2021年3月在本院接受治疗的脓毒症休克所致AKI患者147例,简单随机分组观察组和对照组,各有患者72例、75例。两组患者的一般资料见下,均无统计学差异(P>0.05),本研究经伦理委员会允许。见表1。
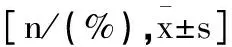
表1 两组患者一般资料的比较
1.2纳入和排除标准:纳入标准:①经检查,患者属于脓毒症休克所致急性肾损伤,48h内出现肾功能急剧下降,SCr绝对值增加26.4μmoL/L以上或超过基础值50%;②患者尿量减少为0.5 mL·kg-1·h-1;③患者家属自愿参与此次研究,并签署知情同意书。排除标准:①患者合并有其他的肾脏疾病;②患者合并有恶性肿瘤;③患者合并有血液疾病;④患者存在休克、低血症,或存在重度贫血;⑤患者存在脑血管意外。
1.3治疗方法:两组患者均行脓毒症休克、AKI常规治疗,包括体液复苏、抗感染治疗、心肺支持、营养支持等;同时,密切关注患者的生命体征,及时调整治疗方案,并做好抢救措施。对照组:采用IHD治疗。建立血管通路(右颈内静脉或右股静脉防止双腔导管),采用山外山血液净化设备(SWS-5000型),聚砜膜透析,透析液中钠浓度135~138mmoL/L、钾浓度根据患者的血钾情况调整。每4h一次,设置血流量为150~200mL/min、脱水量500~1000mL/h。观察组:采用CRRT治疗。血管通路建立方法同对照组,并做好后期维护、消毒、更换;连续性静脉-静脉型血管滤过采用瑞典金宝血液透析机(百特AK98)、Port置换液,设置置换量为200~4000mL/h、血流量为250~300mL/min,净超滤量根据患者的机体承受能力调整;在患者接受CRRT治疗期间,密切观察其各项生理指标,及时发现、处理不良事件。3次/周,4~5h/次。
1.4观察指标:①观察记录两组患者预后恢复情况,包括ICU住院时间、尿量恢复时间、器官支持时间,并记录对比。②于两组患者治疗前以治疗后第1周,抽取患者晨起外周静脉血4mL,后经离心、抽取上层清液、冷置后采用全自动生化分析仪进行血清指标检测,免疫扩散法检测反应蛋白C(C-reactive protein,CRP)浓度,试剂盒采购自深圳迈瑞生物医疗电子股份有限公司;肌酐酶法检测血清肌酐(Serum creatinine,Scr),试剂盒选购自浙江东方基因生物制品有限公司。③于治疗前以及治疗后1周,采用飞利浦超声诊断仪对两组患者进行肾血流动力学情况监测。采用凸阵探头,频率为2~5MHZ,造影剂采用声诺维。进行超声造影技术(Contrast- enhancedultrasound,CEUS)检查,指导患者依次采用左、右侧卧位,移动探头以显示患者肾冠状切面;静脉注射造影剂混悬液(声诺维、0.9%氯化钠溶液)0.02 mL/kg,嘱咐患者保持平静呼吸,以确保扫查平面的稳定;连续记录3 min内的造影剂动态影像,15 min后采用同样的方式进行另一侧肾脏检查。采集数据,利用QLAB软件进行图像处理分析,在皮质区取5 mm×5 mm的感兴趣区域(Region of interest,ROI),取样3次,绘制时间-强度曲线(Time intensity curve,TIC),后进行曲线拟合并自动生成参数峰值强度(Peak intensity,PI)、平均渡越时间(Meantransittime,MTT)、曲线下面积(Area under the curve,AUC),结果取均值。④分别于治疗前以及治疗后第1周,检测两组患者的空腹血糖(Fasting Blood Glucose,FBG)、餐后2h血糖(2 hours postprandial blood glucose,2PBG)。

2 结 果
2.1两组患者预后情况对比:观察组患者的ICU住院、器官支持、尿量恢复时间均对于对照组(P<0.05)。见表2。
2.2两组患者治疗前后血清CRP、Scr浓度对比:治疗前,两组患者的Scr、CRP均无差异(P>0.05);治疗后第1周,两组上述参数均下降(P<0.05);且观察组术后的上述参数较同时间的对照组低(P<0.05),观察组患者CRP、Scr浓度治疗前后差值大于对照组(P<0.05)。见表3。

表3 两组患者血清CRP Scr浓度的比较
2.3两组患者治疗前后肾血流动力学指标对比:两组患者治疗前的PI、AUC、MTT均无差异(P>0.05);治疗后1周,两组患者的以上参数均升高(P<0.05),观察组患者PI、AUC、MTT治疗前后差值大于照组(P<0.05)。见表4。

表4 两组患者治疗前后肾血流动力学指标对比
2.4两组患者治疗前后糖代谢水平对比:治疗前,两组患者的FGP、2FGP均无差异(P>0.05);治疗后第1周,两组的FGP、2FGP均下降(P<0.05);观察组FGP、2FGP治疗前后差值大于对照组(P<0.05)。见表5。

表5 两组患者治疗前后糖代谢水平对比
3 讨 论
肾脏供血占机体心输出量的20%,94%分布于肾皮质,脓毒症患者肾功能严重损伤,肾局部血流灌注会产生不同程度的病变,最终导致血流动力学改变,因此寻找更为有效的脓毒症休克所致AKI治疗方法意义十分重大。
尿量是评估AKI患者肾损伤程度的指标之一,本研究结果显示观察组患者尿量恢复时间短于对照组,说明该组患者的肾功能恢复更快,同时该组患者ICU住院时间以及器官支持时间均短于对照组,也可以说明CRRT对AKI的治疗效果更佳[4]。分析原因,这可能是因为CRRT具有较高的毒素清除率,对中分子类物质的清除更加稳定,从而更加有助于患者肾功能的恢复[5];同时,治疗过程中患者血流动力学较稳定。而IHD存在清除毒素存在低谷、高峰改变情况,患者血容量以及渗透压波动较大,因此观察组患者的恢复更快。张丽琴等[6]的研究中也表示,CRRT、IHD虽然都对AKI患者有一定的治疗效果,但前者更有利于AKI患者肾功能的恢复,本研究结果与其一致。
脓毒症患者细胞释放一氧化碳,致使患者全身血液阻力降低,激活交感-肾上素、肾素、血管紧张素-醛固酮系统,最终导致患者的肾脏灌注降低,因此肾血流灌注在AKI病理生理进程具有重要意义。超声造影具有较高的空间分辨率,对肾脏损伤程度进行定量评估。CEUS反应AKI患者肾脏血流灌注信息,TIC对图像进行分析得到定量参数[7,8]。CRRT、IHD均能清除患者体内小分子物质,及时清理机体内的炎性因子,从而可减轻患者肾负担,以促进肾功能的恢复,本研究结果也显示治疗后两组患者的肾功能指标均显著改善。同时观察组患者治疗后1周的肾皮质PI、AUC、MTT均高于对照组,且治疗前后差值也大于后者,说明CRRT对肾血流动力学的改善效果更好,清除机体中炎性分子、小分子物质的效果更佳。
CRP直接参数机体的炎症反应,脓毒症休克所致AKI者的机体严重损伤,内环境紊乱、免疫表达显著,CRP能够及时清理坏死的组织细胞、调节免疫系统功能,因此急性时相蛋白-CRP与脓毒症患者急性期损伤具有一定相关性。CRRT对患者血液代谢废物的及时处理,可以减轻机体的负荷,降低炎症反应,观察组患者治疗后1周治疗前后CRP、Scr浓度变化差异大于对照组可能与此有关。戴甜等[9]的研究中表示,CRRT治疗患者的CRP浓度较IHD治疗患者显著降低,本研究观点与其相同。本研究结果还显示,观察组患者治疗后1周的FGP、2FGP较对照组显著降低,这与CRRT的生物相容性更好,患者内环境显著改善有关。
综上所述,脓毒症休克所致AKI患者在基础治疗上采用CRRT,可显著缓解机体炎症、促进肾功能、肾血流动力学的恢复,提高机体的糖代谢水平,患者预后更佳。

