K14 阳性细胞在下颌下腺损伤修复中的分布特征
周 济, 张雪明, 耿江予, 牛萍萍, 孙 瑶
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔种植科,上海 200072)
颌面部肿瘤的放疗及唾液腺结石均会造成唾液腺的严重不可逆性损伤, 导致唾液分泌功能降低、腺体纤维化等[1],促进唾液腺功能修复成为临床上亟待解决的问题。 现阶段临床上针对唾液腺损伤主要以药物、手术治疗为主,近年来干细胞疗法被提出,但唾液腺干/祖细胞在其再生过程中的作用机制尚不清楚。 角蛋白 14(cytokeratin 14,K14)细胞主要为唾液腺干细胞和肌上皮细胞,K14+唾液腺干细胞可分化为导管细胞[2]。 前期研究表明,阻塞性下颌下腺在去除梗阻因素后具有再生能力,因此,本实验构建下颌下腺主导管结扎-开放模型,观察唾液腺损伤及再生过程中K14+细胞表达分布特征并探讨其在损伤修复中的潜在作用。
1 材料和方法
1.1 实验动物
8 周龄雌性野生型小鼠(C57BL/6J)36 只,购于上海南方模式生物研究中心, 饲养于同济大学附属口腔医院SPF 级动物室。 昼夜节律正常, 室温23 ℃,相对湿度55%,固体饲料喂养,消毒饮水。 所有动物实验经同济大学伦理委员会认可批准(TJLAC-017-027)。
1.2 实验材料
HE 染色试剂盒(生工生物公司,中国),逆转录试剂盒 (TaKaRa 公司, 日本),PCR SYBR Green-Master Mix (上海翊圣生物公司, 中国),PCR 引物(生工生物公司,中国),K14 抗体(赛默飞公司,美国),NGF 抗体(Abcam 公司,英国),AQP5 抗体(默克公司,德国),荧光二抗 IgG(Invitrogen 公司,美国),DAPI(Sigma 公司,美国),枸橼酸钠修复溶液(凯基,中国),小动脉钛夹(杭州康生医疗器械有限公司,中国)。
1.3 下颌下腺主导管结扎-开放模型构建
选取8 周龄雌性野生型小鼠, 腹腔注射1%戊巴比妥(80 mg/kg),颈部术区备皮、消毒,沿颈部中线剪开小鼠皮肤,暴露筋膜下双侧下颌下腺,剥离舌下腺,分离双侧近心端下颌下腺主导管,用小动脉钛夹行双侧结扎(图1),分层缝合[3-4]。主导管结扎14 d 后,对小鼠进行麻醉、备皮、消毒,去除双侧主导管钛夹,分层缝合。
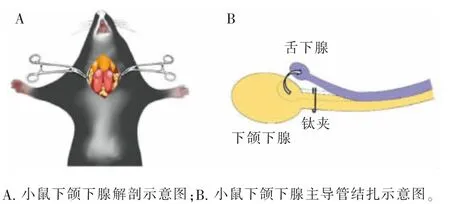
图1 下颌下腺主导管结扎示意图Figure 1 The schematic model of mouse SMG duct ligationdeligation
1.4 苏木精-伊红(hematoxylin-eosin,HE)染色
将结扎 0、14 d 及开放 3、28 和 56 d 的小鼠处死后取双侧下颌下腺, 将下颌下腺置于4%多聚甲醛溶液中,4 ℃放置48 h 后, 乙醇梯度脱水后进行石蜡包埋。 石蜡组织连续切片, 每片厚度4 μm,53 ℃恒温烤片 2 h,60 ℃烘箱 30 min, 二甲苯及梯度乙醇脱蜡后,进行HE 染色。
1.5 免疫荧光染色
石蜡切片脱蜡后, 置入枸橼酸钠溶液中98 ℃抗原修复20 min, 恢复至室温后磷酸盐缓冲液(phosphate buffered saline,PBS)洗 3 次,每次 5 min,山羊血清37 ℃封闭1 h。 加入一抗,4 ℃孵育过夜,PBS 洗 3 次,荧光二抗室温孵育 1 h,4′,6-二眯基-2-苯基吲哚 (4′, 6-diamidino-2-phenylindole,DAPI)复染5 min,封片后荧光显微镜拍照。
1.6 RNA 提取及 qPCR 检测
摘取结扎 0、14 d 及开放 3、28、56 d 小鼠右侧下颌下腺组织,提取总RNA,使用逆转录试剂盒进行逆转录。 使用 PCR SYBR Green Master Mix 和Lighter Cycler qPCR 仪进行扩增, 以甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为每个基因的内源性对照,分析靶基因相对mRNA 表达。 引物序列见表1。

表1 qPCR 引物序列Table 1 Primer sequences of qPCR
1.7 数据统计分析
实验数据采用GraphPad Prism 8.0 软件进行统计学分析。 两组间比较采用配对t 检验,多组比较采用单因素方差分析。 P<0.05 认为差异具有统计学意义。
2 结果
2.1 K14+细胞在下颌下腺发育过程中的表达特点
胚胎期16.5 d 下颌下腺中约53.9%的细胞表达K14(图 2A、E),新生 1 周龄小鼠下颌下腺中 K14+细胞数量较胚胎期减少(图2B),随着年龄增长,3 周龄小鼠下颌下腺中K14+细胞数量逐渐减少(图2C),成年后8 周龄小鼠下颌下腺中仅有少量 (约4.2%)K14+细胞存在(图 2D、E)。

图2 下颌下腺发育过程中K14+细胞表达特点(×180)Figure 2 Expression characteristics of K14+cells during the development of SMG(×180)
2.2 小鼠下颌下腺主导管结扎-开放模型中下颌下腺形态变化
8 周龄C57 小鼠, 用小型钛夹夹闭主导管,14 d后小鼠腺体出现明显萎缩, 腺体质量/体质量数值减少,表面见白色索状条纹,质地变韧(图3A~E);导管开放 3、28 d 后腺体质量/体质量指数增加(图 3E);至开放56 d 时,腺体质量/体质量数值基本恢复至对照组水平,腺体质地变软,颜色恢复正常,提示导管开放56 d 小鼠下颌下腺可能基本恢复至正常水平(图3D、E)。 在对照组中,下颌下腺腺泡结构完整,呈圆形或椭圆形,细胞核位于基底部,各级导管结构清晰(图3F); 小鼠下颌下腺主导管结扎14 d 后腺体萎缩明显,HE 染色可见明显纤维化组织形成, 导管扩张,且腺泡形态皱缩甚至消失(图3G);导管开放28 d及56 d 时,腺体形态学上逐渐恢复正常(图3I、J)。
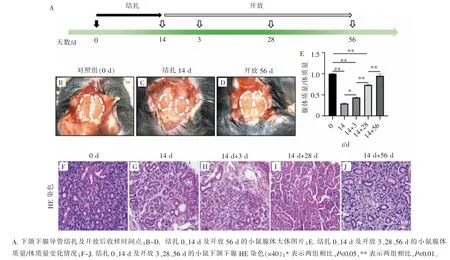
图3 下颌下腺在主导管结扎-开放模型中形态学变化Figure 3 Comparison of morphological variation of SMG in duct ligation-deligation model
2.3 下颌下腺损伤修复过程中分泌功能相关基因的表达
在对照组中,导管合成蛋白功能的标志物神经生长因子(nerve growth factor,NGF)呈颗粒状分布于导管细胞上,呈强阳性表达(图4A),腺泡分泌功能标志物水通道蛋白 5(aguaporin5,AQP5)表达于腺泡细胞顶端和侧端 (图4F)。 免疫荧光染色观察到, 下颌下腺主导管结扎 14 d 后,NGF 及 AQP5 的表达显著减少,开放56 d 后表达接近正常水平(图4B~E,4G~J);qPCR 结果显示 NGF、 表皮生长因子(epidermal growth factor,Egf) 和 AQP5 mRNA 表达水平在下颌下腺结扎14 d 时显著下调, 而开放56 d 时表达量仍低于对照组(图4L~N),提示下颌下腺组织形态基本恢复, 但功能尚未完全修复;角蛋白 5(cytokeratin5,K5) mRNA 表达量在结扎 14 d时显著上调,腺体再生阶段表达量逐渐降低(图4K)。下颌下腺损伤后修复早期K14+细胞被激活参与再生。

图4 小鼠下颌下腺损伤修复过程中分泌功能相关蛋白AQP5 和NGF 的表达Figure 4 Expression of secretory function-related proteins and genes during the injury and repair of mouse SMG
2.4 下颌下腺损伤及再生过程中的组织学变化
在对照组中, 导管中有少量K14+细胞, 且与Ki67 共染的K14+细胞约占细胞总量的 1.0%(图5A、F)。在实验组中,小鼠下颌下腺主导管结扎14 d后,免疫荧光染色观察到导管细胞中处于增殖状态的K14+细胞约2.0%, 与对照组无统计学差异 (图5B、F);导管开放3 d 时,但仍有大量纤维化组织存在, 免疫荧光染色观察到K14+及Ki67+细胞比率明显增加,约为10.9%,提示K14+细胞在修复早期被激活,且处于增殖状态(图5C、F)。导管开放28 d 及56 d 时,增殖状态的K14+细胞比率逐渐减少(图5D~F)。 qPCR 结果显示,导管开放 3 d 时,K14 基因表达显著上调,开放56 d 时恢复至正常水平。

图5 小鼠下颌下腺损伤修复过程中K14+细胞分布特征Figure 5 Expression and distribution characteristics of K14+cells during the injury and regeneration process of mouse SMG
3 讨论
唾液腺是分泌唾液的外分泌性腺体,唾液腺阻塞会导致腺体萎缩,分泌功能下降。 临床上常见的唾液腺阻塞性疾病多为唾液腺结石,长期唾液腺阻塞会导致不可逆性损伤,甚至并发感染[5]。 现阶段采取的治疗手段一般分为两种:一种是摘除不可逆性损伤的腺体,另一种是去除阻塞性因素以促进唾液腺再生[6]。 如果能够探索下颌下腺再生机制,有效保留残余腺体组织并促进其再生,将能够提高唾液腺阻塞性疾病的治疗效果,改善患者的生活质量。 唾液腺主导管结扎-开放模型有效模拟唾液腺阻塞性疾病,为探索唾液腺再生机制提供了有效手段。 小鼠下颌下腺组织学结构与人类有所差别,小鼠拥有独特的颗粒曲管结构, 尤其在雄性小鼠中比较发达, 为避免颗粒曲管对研究结果观察分析造成干扰,因此选取雌性小鼠作为研究对象[7]。
目前普遍认为唾液腺稳态是唾液腺干细胞依赖性的,但干细胞对于维持唾液腺稳态的贡献尚未明确。 Pringle 等[8]提出,在唾液腺损伤修复过程中,新生腺泡细胞及导管细胞均由腺体中干细胞分化而来,然而干细胞对唾液腺细胞更新所作贡献的机制尚不清楚;Aure 等[9]利用基因脉冲追踪技术,证明了导管结扎损伤后腺泡细胞通过自我复制来维持腺体内稳态, 存活的腺泡细胞可增殖以促进腺体再生;Kwak 等[10]通过谱系示踪技术,发现 K14+导管细胞仅能生成导管细胞, 而在腺体遭受严重损伤后,导管细胞可在唾液腺中产生腺泡细胞[11]。上述研究表明,唾液腺再生过程中腺泡细胞主要有两种来源:一类是残余腺泡细胞增殖而来[9,12],另一类是导管中干/祖细胞分化为腺泡细胞,这与唾液腺发育过程相似[2,13]。 K14+细胞分为干/祖细胞和肌上皮细胞,其中干/祖细胞主要分布于排泄管基底侧和闰管[14],能够分化为腺泡细胞的主要是肌上皮细胞。 小鼠唾液腺发育过程中, 胚胎15 d 前K14+细胞可分化为导管细胞、肌上皮细胞和腺泡细胞,胚胎16 d 开始K14+细胞具有谱系限制性,仅能够分化为导管细胞和肌上皮细胞[10]。 有研究表明唾液腺严重损伤后,K14+导管干/祖细胞分化能力增强, 由单能干/祖细胞诱导形成多能干/祖细胞,可分化为导管细胞以及腺泡细胞[11,15];同时肌上皮细胞可转分化为祖细胞样细胞,可分化为腺泡细胞促进腺体再生[2,16-18]。 本研究发现下颌下腺主导管开放早期,腺体中K14 表达显著增高, 且在导管样结构中能观察到K14+细胞,这表明唾液腺长期阻塞后,仍保留了有一定再生能力的腺体组织,并且导管样结构参与了组织的再生,这提示K14 可作为唾液腺早期再生修复的一个标志[19-20]。
下颌下腺长期结扎会导致腺体萎缩,本研究中组织学结果显示,下颌下腺主导管结扎14 d 后腺体萎缩,质量减轻,腺泡结构部分消失,导管结构扩张,纤维结缔组织增加。 基因表达分析显示,腺体功能标志物 AQP5、NGF、Egf 表达量明显下调[21-23],导管开放后,AQP5、NGF 和Egf 基因表达量在主导管开放56 d 内均保持较低水平;免疫荧光染色观察到AQP5 和NGF 表达量在导管开放28 d 时逐渐增加,腺体组织学形态在开放56 d 时基本恢复。 因此,尽管唾液腺组织学形态恢复至正常状态,但腺泡分泌功能和导管合成蛋白的能力尚未恢复,这提示K14+细胞可能在唾液腺早期形态恢复中发挥作用,但唾液腺功能的恢复是一个长期过程,K14+细胞在这过程中的作用有待进一步研究。
综上所述,本研究结果表明唾液腺主导管结扎后,其组织学形态及功能均会发生改变,导管开放后残余的腺体组织具有再生能力,K14+细胞显著增加可作为唾液腺再生过程开始的早期标志。

