山羊HABP4基因的克隆、序列分析及功能预测
王宪军,向 华*,张焕容,任玉鹏,朱江江
(1.西南民族大学畜牧兽医学院,成都 610041;2.青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041)
透明质酸结合蛋白(hyaluronan binding protein 4,HABP4)又被称为Ki-1/57,广泛分布于哺乳动物组织中。HABP4蛋白含有多个RGG/RXR盒族,这些被看做是精氨酸甲基化的靶标[1]。透射电镜分析显示,该蛋白不仅存在于细胞质,还存在于细胞核和核孔,推测该蛋白亚细胞定位的多变性可能与该蛋白中存在精氨酸和赖氨酸残基相关,这些残基能与一些带负电荷的生物大分子相结合,包括葡糖氨基葡聚糖、RNA、透明质酸,因此,它也被称为细胞内透明质酸结合蛋白,这也暗示了HABP4蛋白可能在细胞内发挥着多种功能[2]。
HABP4蛋白最初在细胞内被发现可作为单克隆抗体Ki-1的细胞内交叉反应物,且是第一个用于特异性检测霍奇金淋巴瘤恶性细胞的抗体[3]。尽管HABP4和霍奇金病之间关系尚不清楚,但研究发现,HABP4蛋白参与了肿瘤的发生,如Gray-Mcguire等[4]在分析家族性结肠癌的风险相关SNP中发现,其和HABP4的SNP存在强烈的不平衡性。此外,HABP4蛋白作为转录因子复合体,可通过与多种蛋白相互作用,在细胞转录控制与基因表达的调控中起着至关重要的作用。Lemos等[5-7]发现,HABP4蛋白与染色质重塑蛋白(chromodomain helicase DNA binding protein 3,CHD3)、转录因子(myocyte enhancer factor 2C,MEF2C和p53)相互作用后在生物体转录调控方面直接或者间接地发挥作用。Bressan等[8-11]报道,HABP4蛋白与hnRNPQ(heterogeneous nuclear ribonucleoprotein)和SFRS9(arginine/serine-rich 9)蛋白作用后调控mRNA前体的拼接,以及与 RACK1(receptor for activated C kinase 1)、CIRP(cold inducible RNA binding protein)、FMRP(fragile X mental retardation protein)和RPL38(ribosomal protein L38)蛋白作用后调控蛋白的翻译。Bressan等[8]进一步研究发现,HABP4蛋白通过与富U RNA探针的结合参与RNA的新陈代谢过程,且具有深入调节mRNA前体拼接和翻译方面的功能。2013年,Braunschweig等[12]发现,HABP4蛋白在mRNA的拼接、核染色质重建、转录和翻译中发挥作用,暗示此蛋白在调控整合基因的表达过程中具有重要作用。同时,HABP4蛋白参与了细胞内RNA的代谢作用[8]。
近年研究发现,通过微阵列数据分析显示,HABP4蛋白的表达调控了人源细胞周期、凋亡、增殖相关基因表达水平[13]。HABP4蛋白在真核细胞内本质上属于非结构蛋白家族的成员之一,其结构的灵活性也暗示了该蛋白能与许多不同的蛋白质发生相互作用[14],推测HABP4蛋白可能通过对生物体转录翻译过程的调节从而参与细胞周期、细胞凋亡、mRNA代谢等[15-17]。由此看出,HABP4蛋白在生物机体内发挥着重要的作用。基于此,研究人员对该蛋白产生了浓厚的兴趣并进行重点关注。然而,目前尚未见HABP4蛋白在调控山羊细胞凋亡中作用的相关报道。
简州大耳羊是我国自主培育的第二个肉用山羊品种,具有生长发育快、适应性好、抗病力强等特点,充分挖掘简州大耳羊的品种优势对推动肉用山羊产业的发展具有重要意义。本试验以简州大耳羊为研究对象,利用TA法克隆得到山羊HABP4基因,并利用生物信息学方法预测其结构及功能;利用实时荧光定量PCR(RT-qPCR)技术分析其在不同组织中的表达;同时,使用RT-qPCR技术检测与HABP4蛋白可能存在相互作用的10个蛋白的mRNA表达特性并分析其相关性,进行HABP4基因及相关基因的GO功能富集,以期为进一步验证HABP4在调控山羊细胞凋亡中的作用奠定基础。
1 材料与方法
1.1 样本采集及总RNA提取
试验于2020年在西南民族大学畜牧兽医学院完成。于四川省简阳大哥大牧业有限公司随机选取10月龄左右,体重为55 kg左右的健康简州大耳羊公羊16只,作为16个生物学重复样本。清晨空腹屠宰后,迅速采集各只山羊心、肝、脾、肺、肾、小肠、大肠、瘤胃和胰腺9个组织样品,DEPC水清洗后将组织样品用锡箔纸包好,立刻置于液氮中保存,待用。使用TRIzol法提取组织总RNA,并用1%的琼脂糖凝胶电泳检测RNA完整性。采用NanoDropND-1000(Agilent)分光光度计测定RNA样品的浓度以及OD260 nm/OD280 nm值,并控制在1.9~2.1之间。利用gDNAse去除基因组DNA后,使用QuantiTect Reverse Transcription Kit进行cDNA链的合成。1%的琼脂糖凝胶电泳检测cDNA的质量。
1.2 主要试剂及仪器
TRIzol、Revert Aid First Strand cDNA Synthesis Kit 试剂盒、QuantStudio3购自美国Thermo Fisher Scientific公司;Premix Taq、DL2000 DNA Marker、pMD-19T Simple载体、DH5α感受态细胞购自宝生物工程(大连)有限公司(TaKaRa);SYBR®Premix Ex TaqTM(2×)购自TaKaRa公司;胶回收试剂盒、质粒提取试剂盒购自美国Omega公司;氯仿、异丙醇、DEPC等均为国产试剂。
1.3 山羊HABP4基因的克隆及鉴定
参照GenBank 中已公布的山羊HABP4基因预测序列(登录号:XM_018052483.1),利用Primer Premier 5软件设计1对特异性引物,上游引物:5′-GGCTTCGCTAAGACTCGC-3′,下游引物:5′-G-TGTCTGGAGAAATCCCTGTT-3′,引物由上海生工生物工程有限公司合成。以山羊脾cDNA为模板,使用上、下游引物进行PCR扩增。PCR反应体系:Premix Taq 12.5 μL,上、下游引物各1 μL,模板1 μL,ddH2O 9.5 μL。反应条件:95 ℃预变性4 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳进行检测正确后,切胶回收产物连接至pMD-19T Simple载体,并转化DH5α感受态细胞,提取质粒后阳性重组质粒送上海生工生物工程有限公司测序正确后保存备用,将鉴定正确的质粒命名为pMD19-HABP4。
1.4 山羊HABP4基因的生物信息学分析
使用clustalw2 在线软件(http://www.ebi.ac.uk/Tools/clustalw2/index.html)对本试验克隆获得的山羊HABP4基因CDS序列与绵羊预测序列(XM_004005238.4)、牛(NM_001081523.1)、猪(NM_001244681.1)、人(NM_014282.4)、小鼠(NM_019986.3)和大鼠(NM_001079940.1)的HABP4基因进行同源性分析。使用BioXM2.6软件对山羊与绵羊(预测序列)、牛、人和猪进行HABP4基因序列比对。使用Protparam在线软件(https://web.expasy.org/protparam/)对HABP4的氨基酸序列一级结构和理化性质进行分析。使用ExPASy ProtScale在线软件(https://web.expasy.org/protscale/)计算HABP4的疏水性。使用 Tmpred 在线软件(http://www.ch.embnet.org/software/TMPRED_form.html)分析蛋白质的跨膜区。利用EMBL-EBI在线软件(https://www.ebi.ac.uk/Tools/pfa/phobius)进行信号肽预测。使用phyre2在线软件 (http://www.sbg.bio.ic.ac.uk/phyre2/phyre2)预测山羊HABP4蛋白质二级结构。使用SWISS MODEL在线软件(https://swissmodel.expasy.org/interactive)分析蛋白的三级结构。使用Net Phos 3.1 (http://www.cbs.dtu.dk/services/NetPhos/)预测HABP4蛋白的磷酸化位点。使用在线软件PsortⅡ(https://www.genscript.com/tools/psort)进行蛋白亚细胞定位预测。使用 MEGA7.0 软件对HABP4 基因序列构建系统进化树。利用STRING在线软件(https://string-db.org/)预测可能与HABP4蛋白发生相互作用的蛋白。
1.5 山羊HABP4基因在不同组织的表达分析
选取10月龄左右健康山羊(n=16)的9个组织(心、肝、脾、肺、肾、小肠、大肠、瘤胃和胰腺),分别对每个组织提取总RNA并反转录为cDNA。根据“1.3”中克隆的HABP4基因CDS序列,运用Primer Premier5设计1对特异性引物,RT-qPCR检测HABP4基因在各组织中的表达差异。以实验室前期保存的Ubiquitously-Expressed Transcript(UXT)基因作为内参基因,内参基因的引物序列见表1。RT-qPCR的反应体系:SYBR®Premix Ex TaqTM10 μL,上、下游引物各1 μL,模板1 μL,ddH2O 6.8 μL,ROX 0.2 μL。反应条件:95 ℃ 预变性3 min;95 ℃变性10 s,60 ℃退火30 s,同时采集荧光信号,72 ℃延伸30 s,共35个循环,熔解曲线:95 ℃变性15 s,60 ℃冷却1 min,使DNA双链充分结合,最后从60 ℃逐步加热至95 ℃,每一步增加0.15 ℃并保持1 s,同时采集荧光信号。
1.6 RT-qPCR检测HABP4互作蛋白的mRNA表达水平
根据STRING数据库预测可能与HABP4蛋白发生相互作用的蛋白为基础,利用RT-qPCR检测与HABP4蛋白发生相互作用的蛋白的mRNA表达。各基因引物见表1。RT-qPCR反应体系:SYBR®Premix Ex TaqTM10 μL,上、下游引物各1 μL,模板1 μL,ddH2O 6.8 μL,ROX 0.2 μL。反应条件:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,同时采集荧光信号,72 ℃延伸30 s,共35个循 环,熔解曲线:95 ℃变性15 s,60 ℃冷却1 min,使DNA双链充分结合,最后从60 ℃逐步加热至95 ℃,每一步增加0.15 ℃并保持1 s,同时采集荧光信号。每个待测样本设置3个重复。
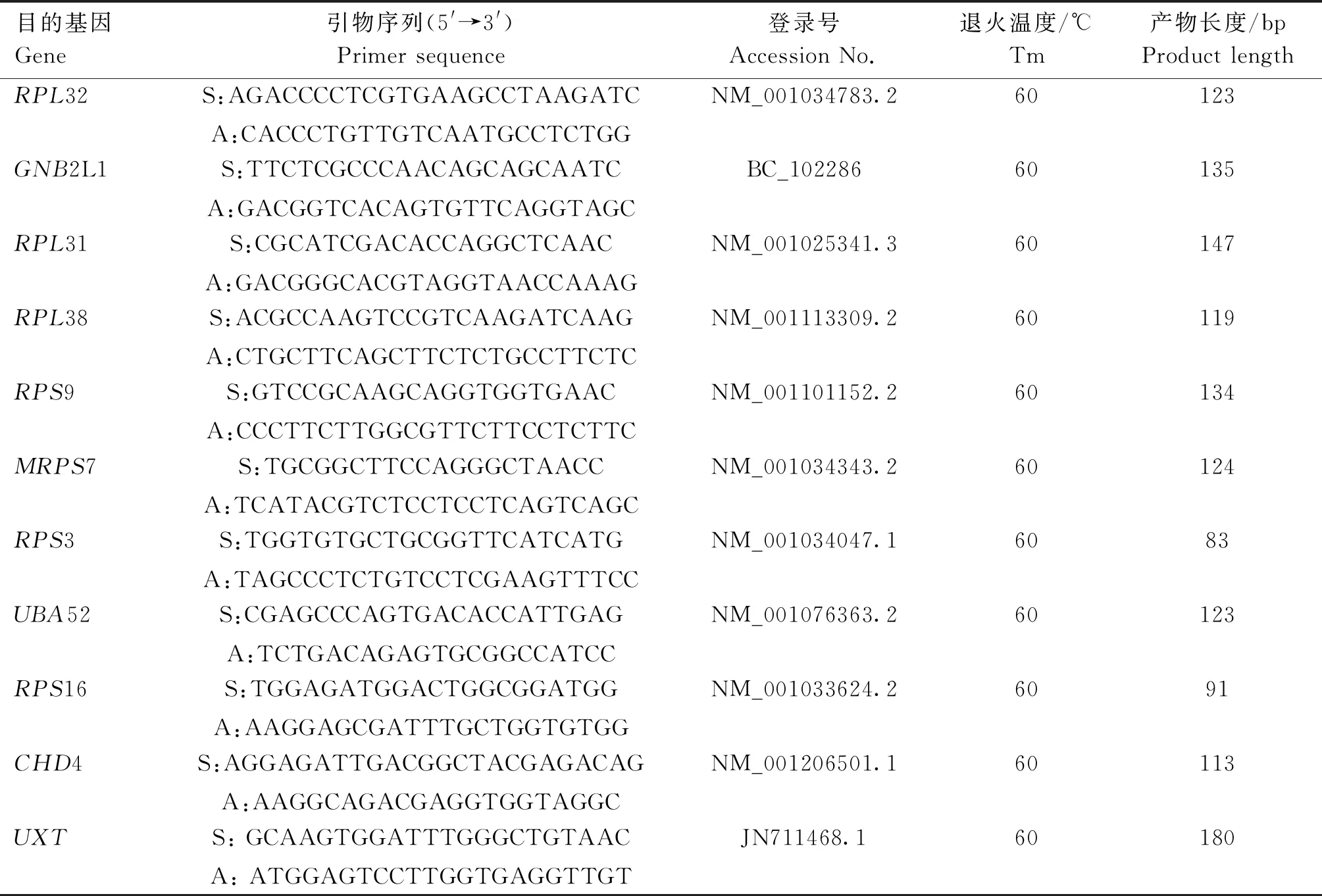
表1 引物信息Table 1 Primers information
1.7 数据统计与分析
使用Metascape在线分析软件(http://metascape.org/)对HABP4进行GO功能富集。分析HABP4基因在山羊不同组织中表达水平时,采用2-△△Ct方法分析HABP4基因相对于内参基因UXT的表达差异,其中△Ct=CtHABP4-CtUXT,△△Ct=△Ct组织-△Ct心。计算结果在SPSS 22.0中进行单因素方差分析和显著性检验。采用2-△Ct方法分析HABP4基因互作蛋白在胰腺中的表达,其中△Ct=Ct预测互作蛋白目的基因-CtUXT。并将计算结果在SPSS 22.0中进行相关性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 山羊HABP4基因的克隆及鉴定
本试验以山羊组织cDNA为模板,通过PCR方法成功扩增HABP4基因,经1%的琼脂糖凝胶电泳检测可见与预期目的片段大小(1 496 bp)相符合(图1A),包含5′UTR 61 bp,CDS区1 254 bp,3′UTR 181 bp,编码417个氨基酸,起始密码子为ATG,终止密码子为TGA。上传HABP4基因CDS区序列到NCBI获得GenBank登录号:MW748177。胶回收产物克隆转化后,进行菌落PCR,产物经1%琼脂糖凝胶电泳检测,与预测HABP4基因的大小相符合(图1B)。
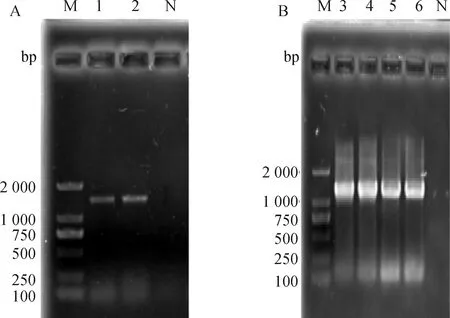
A.HABP4基因的PCR扩增检测;B.重组质粒pMD19-HABP4的PCR扩增。M.DNA相对分子质量标准;N.阴性对照;1~2.HABP4基因的扩增条带;3~6.重组质粒pMD19-HABP4扩增条带A.HABP4 gene amplified by PCR;B.Recombinant plasmid pMD19-HABP4 amplified by PCR.M.2 000 bp DNA ladder;N.Negative control;1-2.HABP4 gene amplified by PCR;3-6.Recombinant plasmid pMD19-HABP4 amplified by PCR图1 HABP4基因克隆及重组质粒鉴定Fig.1 HABP4 gene cloning and recombinant plasmid identification
2.2 HABP4基因的生物信息学分析
本研究获得的HABP4基因CDS区的同源性分析表明,山羊HABP4基因的CDS区与NCBI中牛(NM_001081523.1)的同源性高达98.41%,与绵羊预测序列(XM_004005238.4)的同源性为100%,与猪(NM_001244681.1)、人(NM_014282.4)、小鼠(NM_019986.3)和大鼠(NM_001079940.1)的同源性分别为94.03%、89.49%、84.64%、85.05%。使用BioXM2.6软件对山羊与绵羊(预测序列)、牛、猪和人进行HABP4基因序列比对,结果见图2。
利用Protparam在线软件对克隆获得的山羊HABP4基因CDS区的氨基酸序列进行分析,预测其蛋白分子式为C1 957H3 108N638O644S8,分子质量为46 134.57 u;理论等电点(theoretical PI)为6.54,不稳定指数为58.05,该蛋白为不稳定蛋白。ExPASy ProtScale在线软件计算HABP4的疏水性(图3A),推测该蛋白为亲水性蛋白。使用Tmpred Server v.2.0 对HABP4蛋白的跨膜区进行分析,推测该蛋白不属于跨膜蛋白(图3B)。使用 SIGNALP 4.0分析HABP4蛋白,预测该蛋白不存在信号肽结构,推测该蛋白为非分泌性蛋白 (图3C)。Net Phos 3.1在线软件预测HABP4蛋白可能的磷酸化位点,结果显示该蛋白有19个丝氨酸磷酸化位点、11个苏氨酸磷酸化位点和3个络氨酸磷酸化位点,无O-糖基化位点和N-糖基化位点。亚细胞定位分析显示,HABP4蛋白主要定位于细胞核(73.9%)和细胞质(8.7%)中。Phyre2在线软件对山羊HABP4蛋白进行二级结构分析,预测结果显示HABP4蛋白中α螺旋占19%,无规则卷曲占83%,β折叠占4%。利用 Phyre2 Server预测了山羊HABP4蛋白的三级结构(图3D)。同时分析了与山羊HABP4蛋白氨基酸同源性最高的绵羊(预测序列)HABP4蛋白三级结构(图3E),分析比对发现两个物种HABP4蛋白三级结构无明显差异,与猪HABP4蛋白三级结构(图3F)对比也无明显差异,预测其功能具有一定相似性;与牛HABP4蛋白三级结构(图3G)对比分析发现有差异性,预测其功能相似度较低。利用 MEGA7.0软件构建各物种HABP4基因序列系统进化树。如图4A显示,山羊与牛亲缘关系最近,与猪的亲缘关系较远,与小鼠亲缘关系最远。利用Sting数据库检索到MRPS7、CHD4、UBA52(ubiquitin A-52 residue ribosomal protein fusion product 1)、RPL32(ribosomal protein L32)、GNB2L1(guanine nucleotide-binding protein subunit beta-2-like 1,)、RPS9(ribosomal protein S9)、RPS3(ribosomal protein S3,)、RPS16(ribosomal protein S16)、RPL31(ribosomal protein L31,)、RPL38共10个蛋白可能和HABP4蛋白存在相互作用(图4B)。
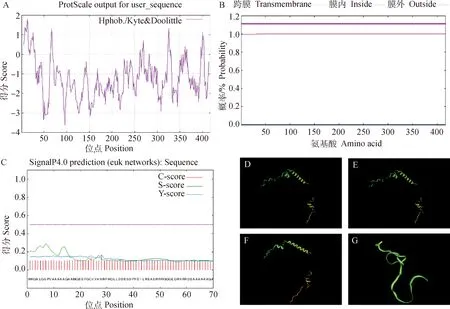
A.山羊HABP4蛋白的疏水性分析;B.山羊HABP4蛋白的跨膜区分析;C.山羊HABP4蛋白的信号肽预测;D.山羊HABP4蛋白的三级结构预测;E.绵羊HABP4蛋白的三级结构预测;F.猪HABP4蛋白的三级结构预测;G.牛HABP4蛋白的三级结构预测A.Hydrophobicity analysis of goat HABP4;B.Transmembrane region analysis of goat HABP4 protein;C.Predicted signal peptide of goat HABP4 protein;D.Predicted tertiary structure of goat HABP4 protein;E.Predicted tertiary structure of sheep HABP4 protein;F.Predicted tertiary structure of pig HABP4 protein;G.Predicted tertiary structure of cattle HABP4 protein图3 山羊HABP4蛋白的生物信息学分析Fig.3 Bioinformatics analysis of goat HABP4 protein
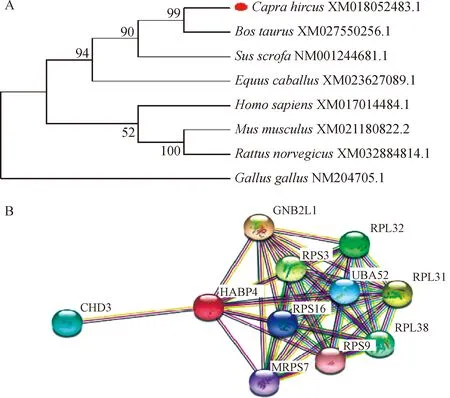
A.HABP4基因进化树分析;B.与HABP4可能存在互作的蛋白预测A.Evolutionary tree analysis of HABP4 gene;B.Prediction of proteins interacting with HABP4 protein图4 山羊HABP4蛋白的生物信息学分析Fig4 Bioinformatics analysis of goat HABP4 protein
2.3 山羊HABP4基因不同组织的mRNA表达水平分析
以UXT为内参基因,采用RT-qPCR技术检测山羊9个不同组织中HABP4基因mRNA的表达水平。结果显示,在山羊的心、肝、脾、肺、肾、胰腺、小肠、大肠和瘤胃等9个组织中均能检测到HABP4基因的mRNA表达,其中HABP4基因mRNA表达水平在胰腺中最高,极显著高于其他组织(P<0.01),肾组织次之,肝和瘤胃最低(图5)。

图5 HABP4基因mRNA在不同组织中相对表达量Fig.5 Relative expression of HABP4 mRNA in different tissues
2.4 HABP4互作蛋白预测及各基因表达量间的相关性分析
根据STRING在线软件预测到HABP4蛋白与MRPS7、CHD4、UBA52、RPL32、GNB2L1、RPS9、RPS3、RPS16、RPL31、RPL38共10个蛋白可能存在相互作用,因此推测,这些基因可能与HABP4的表达水平具有一定的相关性。以UXT为内参基因,利用RT-qPCR检测这10个基因在16只羊胰腺中的mRNA相对表达水平。结果见表2,HABP4与UAB52(r=0.642,P<0.01)具有极显著正相关,与RPL32(r=0.564,P<0.05)、RPS9(r=0.589,P<0.05)具有显著正相关性;MRPS7和RPS3(r=0.910,P<0.01)、RPL32(r=0.862,P<0.01)、RPS9(r=0.850,P<0.01)具有极显著正相关,与RPS16(r=0.570,P<0.05)具有显著正相关性;CDH4和RPL31(r=0.792,P<0.01)、RPS16(r=0.808,P<0.01)、GNB2L1(r=0.959,P<0.01)具有极显著正相关,与RPS3(r=0.501,P<0.05)具有显著正相关性;UBA52与RPL32(r=0.596,P<0.05)具有显著正相关性;RPS3与RPS16(r=0.796,P<0.01)、RPL32(r=0.710,P<0.01)、GNB2L1(r=0.653,P<0.01)、RPS9(r=0.672,P<0.01)具有极显著正相关;RPL38和RPL31(r=0.710,P<0.01)具有极显著正相关,与RPS16(r=0.619,P<0.05)具有显著正相关;RPL31与RPL32(r=-0.395,P<0.05)、RPS9(r=-0.399,P<0.05)具有显著负相关;RPS16与RPL32(r=0.298,P<0.01)、RPS9(r=0.277,P<0.01)具有极显著正相关;RPL32与GNB2L1(r=0.021,P<0.01)具有极显著正相关;GNB2L1与RPS9(r=0.040,P<0.01)具有极显著正相关,相关性网络分析发现,各个基因表达量之间均具有较强的相关性,如RPS9与7个基因具有较强的相关性,其次RPL32、RPS16、RPS3各与6个 基因具有较强相关性,GNB2L1、RPL31、CDH4、MRPS7各与4个基因具有较强相关性,UBA52、HABP4各与3个基因具有较强相关性,最少的为RPL38与2个基因具有较强相关性。
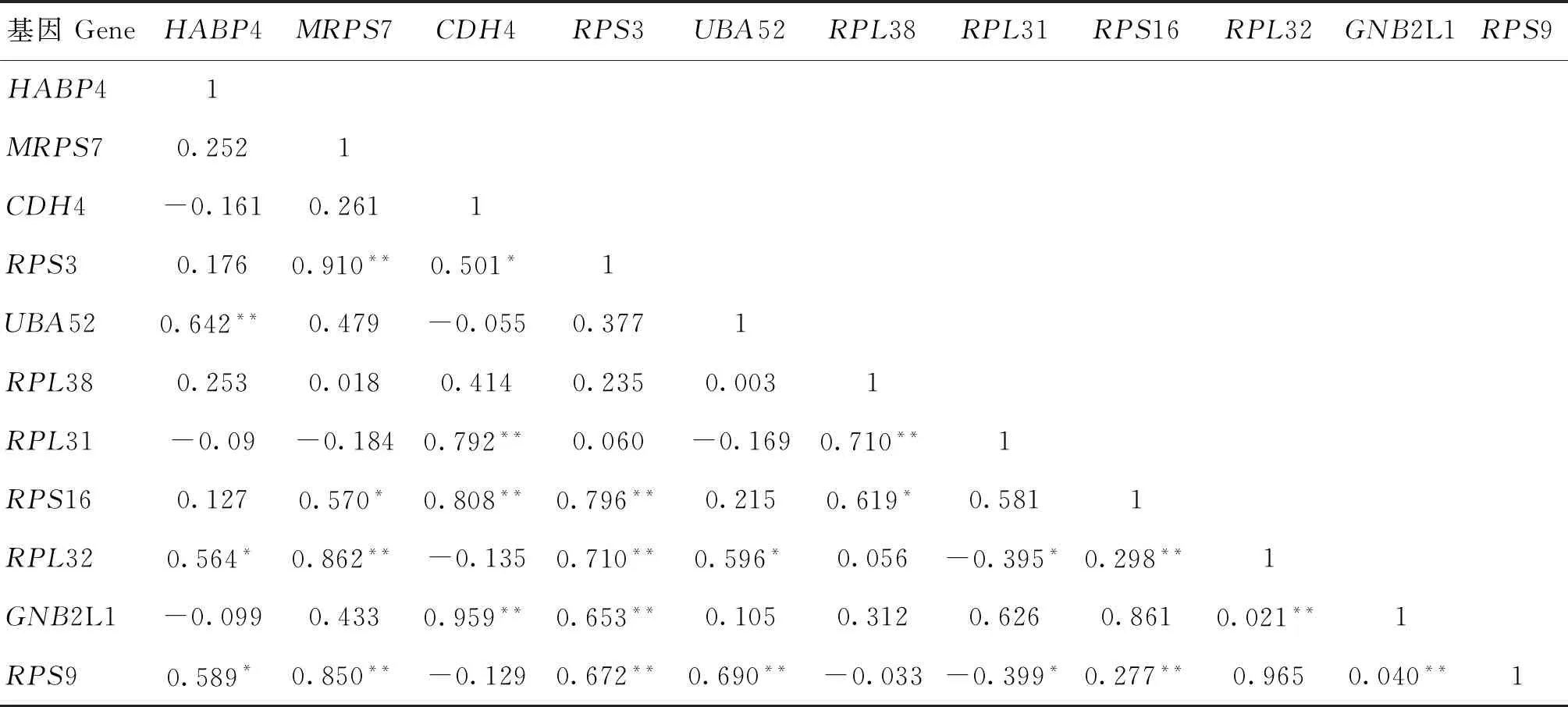
表2 与 HABP4互作蛋白的基因表达量之间相关性分析Table 2 Correlation analysis of genes expression among proteins interacting with HABP4
2.5 HABP4蛋白及相关性基因的GO功能富集
从2.4结果中得知HABP4基因与UAB52、RPL32、RPS9共3个基因具有显著相关性,对其进行GO分析,以富集结果P<0.01 为参考标准。GO 分析包括生物过程(图6A)和分子功能(图6 B)两个方面。在生物过程方面主要涉及细胞定位、新陈代谢、多生物过程以及生物过程负调节;分子功能方面与翻译起始、核糖体转录、细胞质中的代谢有关。
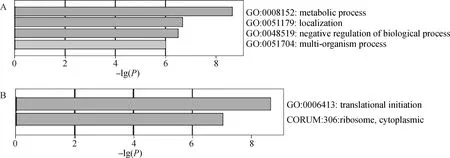
A.生物学过程分析;B.分子功能分析A.Biological process analysis;B.Molecular function analysis图6 山羊HABP4及相关基因功能富集分析Fig.6 Functional enrichment analysis of goat HABP4 and related genes
3 讨 论
本研究获得山羊HABP4基因的CDS区域以及预测其生物信息学相关信息对揭示该基因的功能将起到重要的作用。HABP4基因CDS区为1 254 bp,其中GC含量达60%以上,由于HABP4基因的GC含量较高,在扩增过程中导致多条非特异性条带的产生。本试验通过多次优化反应条件,同时使用PrimeSTAR Max Premix高保真酶(TaKaRa)克隆获得了条带单一的PCR产物。测序结果表明,本试验克隆得到的HABP4基因的CDS区与NCBI上公布的牛、猪、人、小鼠、大鼠的同源性分别为98.41%、94.03%、89.49%、86.64%和85.05%,可以看出,HABP4在哺乳动物间存在较高的保守性并且与牛的同源性最高。不同的生物信息学分析软件预测基因功能的结果可能有所不同,因此,筛选好的生物信息学分析软件对精确预测基因功能是至关重要的。如MHMM-2.0和TMPred两款在线比对软件常用于蛋白质跨膜区域的预测[18]。本研究采用ProtScale在线软件预测蛋白的亲疏水性,发现采用试验克隆获得的HABP4基因序列和其氨基酸序列得到不同的结果,其中基因序列结果分析显示为疏水性蛋白,氨基酸序列分析结果为亲水性蛋白。李武峰等[19-21]均采用目的基因的氨基酸序列来分析该蛋白对应的疏水性。可以看出,利用氨基酸序列分析蛋白的疏水性的可靠度更高。因此,本试验使用HABP4基因的氨基酸序列通过ProtScale在线软件,预测结果显示HABP4蛋白为亲水性蛋白。HABP4蛋白不属于跨膜蛋白,无明显的跨膜结构,这也与其在细胞质中发挥作用的研究结果是一致的。蛋白的磷酸化位点和糖基化位点可为研究HABP4蛋白的活性区域,并进行定点突变具有重要的指导意义,且这些位点常常对生物进化的研究具有重要的参考价值[22]。蛋白的亚细胞定位往往能一定程度上反映出该蛋白的生物学功能[23]。本研究亚细胞定位分析显示,HABP4蛋白主要定位于细胞核(73.9%)和细胞质(8.7%)中,这与Rohde等[24]的研究报道结果一致,推测山羊HABP4蛋白可能与人源HABP4蛋白的功能相似。相互作用蛋白分析显示,HABP4蛋白可能与MRPS7、CHD4、UBA52等蛋白存在相互作用。
RT-qPCR分析mRNA表达水平时,合适内参基因的选择能得到相对准确的RT-qPCR数据[25]。内参基因是一种标准化核酸样品数量的基因,从理论上其表达量应保持稳定。但有研究得出,常用的内参基因存在波动性表达,稳定表达只存在于特定的试验条件、细胞或组织中[26],因此,筛选表达水平相对稳定的内参基因显得尤为重要[27-28]。常用于研究的内参基因主要包括GAPDH、ACTIN、18SrRNA、RPLP0、TBP、UXT等,其中GAPDH长期作为公认的内参基因被大家广泛使用[29],如2017年,张蓉等[27]研究发现,GAPDH在蛋鸡组织表达中为最优选择的内参基因。池永东等[30]报道,相同的内参基因并不适合于所有的物种,且发现GAPDH基因在山羊组织中并非稳定性最强。2013年,Bonnet等[31]研究发现,UXT、EIF3K和RPLP0基因是牛或山羊肝、肌肉、乳腺和脂肪组织中最为稳定的参考基因,可使mRNA丰度正常化。同时,2020年,谢光杰等[32]以UXT为内参基因,利用RT-qPCR技术检测了山羊APOL6基因在简州大耳羊 背最长肌、皮下脂肪和腹间脂肪的表达量。许晴等[33-35]在山羊基因功能研究中以UXT为内参基因矫正目的基因的表达。因此,本研究结合前人研究结果,选择UXT作为内参基因。
分析基因在不同组织中的表达规律可为研究该蛋白的功能提供试验依据。从山羊HABP4的组织分布来看,该基因在各组织中均有表达,其中在胰腺中的表达量最高,肾组织次之,肝和瘤胃最低。HABP4在各组织间的表达差异可能和其在不同组织中的功能差异相关。研究显示,胰腺一直以一种特殊的实质器官被研究,胰腺的内分泌及外分泌功能向来被认为是相互独立存在[36],在细胞转录调控、mRNA代谢、RNA拼接以及mRNA稳定性等过程中发挥着作用,而HABP4蛋白同样在基因转录调控、mRNA代谢等水平发挥作用,从而推测HABP4蛋白可能在山羊的胰腺中发挥着类似重要的生物学功能。
目前,关于HABP4蛋白具体与哪种或者哪些蛋白之间相关性更强的研究较少。参照文献[37]的方法,本研究利用RT-qPCR技术检测可能与HABP4蛋白存在相互作用的10个蛋白在16只羊胰腺中的mRNA相对表达水平并进行GO 功能富集。结果显示,HABP4基因和各个基因之间均具有相关性,其中主要与UAB52、RPL32、RPS9 3个基因具有显著相关性。UBA52是由N端泛素和C端核糖体蛋白L40组成的融合蛋白[38]。在细胞内,被泛素化修饰的UBA52将泛素转移到靶蛋白,使靶蛋白被26S蛋白酶体识别而降解,从而有效调节细胞内蛋白质的周转,参与细胞内热休克反应、DNA损伤修复、细胞周期调控等一系列细胞生物学反应[39-40]。RPL以及RPS家族作为核糖体的主要成分,在调控蛋白质合成过程中起着重要作用[41]。同时,RPL以及RPS家族还可以参与调节DNA损伤修复、凋亡、细胞增殖和分化、耐药性、细胞迁移和侵袭[42]。研究报道显示,细胞内RPL32被敲低后会导致核糖体应激,而核糖体是细胞内翻译的重要细胞器[43],直接影响rRNA的成熟[44]。同时,RPS9蛋白与肿瘤的发生存在一定的关联[45-46]。因而,根据HABP4蛋白和UAB52、RPL32、RPS9共3个蛋白相对表达的正相关,推测HABP4蛋白可能在细胞内蛋白质的翻译、合成以及细胞周期、凋亡等方面发挥一定的调控作用,具体作用有待进一步研究。GO功能富集分析常被用于检测差异基因在GO term的富集程度,能一定程度上对基因的功能进行限定和描述[47]。2007年,Uenishi等[48]利用GO功能富集分析了猪源HABP4基因可能存在的分子功能并绘制了树形结构图。本研究通过GO功能富集发现,HABP4基因的生物学过程分析主要富集于细胞定位、新陈代谢、多生物过程以及生物过程负调节;分子功能方面与翻译起始、核糖体转录、细胞质中的代谢有关。
4 结 论
山羊HABP4基因cDNA全长1 496 bp,包含5′UTR 61 bp,CDS区1 254 bp,3′UTR 181 bp,编码417个氨基酸,在胰腺中表达水平最高。HABP4与UAB52表达量呈极显著正相关,与RPL32、RPS9呈显著正相关,推测其在细胞定位、新陈代谢、多生物过程及生物过程负调节以及翻译起始、核糖体转录、细胞质中的代谢等方面发挥着重要作用,为进一步探讨HABP4在调控细胞凋亡过程中的作用提供了数据参考。

