安肠愈疡汤对溃疡性结肠炎大鼠肠黏膜屏障的修复作用及机制研究*
孙大娟,王晗潞,王帅,迟莉丽
(1.山东中医药大学附属医院脾胃病科,济南 250000;2.山东中医药大学第一临床医学院,济南 250000)
溃疡性结肠炎(UC)是一种涉及感染、免疫、遗传等多因素的慢性非特异性炎症性肠病[1]。近20年来,中国UC的发病率急剧增加[2],但其发病机制仍未完全阐明,目前认为肠黏膜屏障功能受损是其重要病理改变,与疾病的发生发展密切相关[3],故维护肠黏膜屏障的完整性和通透性是其治疗的关键[4-5]。目前西医治疗药物主要以5-氨基水杨酸、糖皮质激素、生物制剂等为主[6],疗效确切、起效快,但不良反应大、复发率高[7]。中药具有修复肠黏膜损伤等作用,可长期维持缓解、降低复发率,在防治UC方面具有独特优势[8-11]。前期临床实验[12-15]发现安肠愈疡汤具有健脾理气、化湿助运、清热解毒的作用。本研究在前期研究基础上,进一步从动物实验方面观察安肠愈疡汤对UC大鼠咬合蛋白(Occludin)、紧密连接蛋白 1(Claudin-1)及白细胞介素-13(IL-13)/酪氨酸激酶(JAK1)/信号转导与转录激活因子6(STAT6)信号通路的调控作用,探讨其修复肠黏膜屏障的机制,为中医药治疗UC提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 36只SPF级雄性SD大鼠购自济南朋悦实验动物繁育有限公司,体质量(200±20)g,动物合格证号:SCXK(鲁)20190003,动物伦理审查批件号:AWE-2019-002。动物饲养于山东中医药大学附属医院动物实验中心,温度20~26℃,相对湿度40%~70%,12 h光照和12 h避光循环交替。
1.1.2 实验药品 安肠愈疡汤是山东省名中医迟莉丽教授自拟方,药物组成:生黄芪30g,败酱草30g,黄连 9g,黄芩 9g,炒白术 30g,薏苡仁 30g,木香 9g,槟榔 15 g,地榆炭 15 g,白及 15 g,当归 9 g,炒白芍12 g,防风6 g,生甘草9 g。药材购于山东中医药大学附属医院中药房,并在本院制剂室浸泡、煎煮、过滤、浓缩,按照所需配成高、中、低浓度药液,生药含量为分别为 0.375、0.75、1.5 g/mL,置于 4 ℃冰箱保存。美沙拉嗪缓释颗粒(法国Ethypharm公司,批号:190108)。
1.1.3 主要试剂和仪器 葡聚糖硫酸钠(DSS,MW36000-50000)(美国 MP Biomedicals公司,批号:0216011080);苏木精-伊红(HE)染色试剂盒(北京索莱宝科技有限公司,批号:G1120);兔多克隆IL-13抗体(北京博奥森生物技术有限公司,批号:bs-0560R);兔单克隆STAT6抗体、JAK1抗体(英国Abcam 公司,批号:ab217998、ab133666);兔单克隆Occludin抗体、Claudin-1抗体(英国Abcam公司,批号:ab167161、ab180158);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司,批号:Cat.#ZB-2301);Claudin-1、Occludin、JAK1、STAT6、IL-13、PCR引物均由宝日医生物技术(北京)有限公司设计合成。全自动样品快速研磨仪(上海净信实业发展有限公司);冷冻高速离心机(美国Thermo Scientific公司);RT-6000自动酶标仪(深圳雷杜生命科学股份有限公司);FluorChem Q蛋白印迹成像和定量分析系统(美国Proteinsimple公司);电泳、电转系统(美国BIO-RAD公司);PCR仪(德国Roche公司)。
1.2 实验方法
1.2.1 建模及分组给药 大鼠适应性饲养1周后,采用随机数字表法随机分为6组:空白组(6只),模型组(6只),中药低、中、高剂量组(各6只,简称低、中、高剂量组)和美沙拉嗪对照组(6只)。除空白组外,其余各组均连续7 d自由饮用4.5%DSS溶液,并于饮用DSS溶液第2天开始进行药物灌胃,依据《实验动物和动物实验技术》动物给药量计算,根据大鼠与人的体表面积等效剂量比值进行折算,中药低、中、高剂量组分别给予含生药为 0.375、0.75、1.5 g/mL的中药灌胃,美沙拉嗪对照组以0.035 g/mL的美沙拉嗪混悬液灌胃,空白组、模型组均以去离子水灌胃,以上各组均每次2 mL,每日1次,连续2周。
1.2.2 标本的采集与处理 干预结束后,将大鼠麻醉后取距肛门1 cm以上的结肠组织,冲洗干净后,肉眼观察炎症、溃疡情况,取病变最明显的组织,一部分结肠组织固定、包埋、切片后,HE染色,由2名经验丰富的病理科医师显微镜下观察,并参照文献[16]进行组织病理学评分。另一部分结肠组织于-80℃冰箱冻存,分别用于Occludin、Claudin-1蛋白、基因表达及IL-13、JAK1、STAT6的基因表达。
1.2.3 Western Blot法检测 Occludin、Claudin-1 蛋白的表达 先于液氮中研磨、裂解结肠组织,离心收集上清液,提取总蛋白,采用蛋白浓度测定(BCA)测定其浓度。取含有40 μg的蛋白溶液为上样量,经电泳、转膜、封闭后,分别加入结合一抗、二抗,再分别洗膜后,避光显色2 min,再置于全自动化学发光图像分析系统中进行扫描。量化标准为目标蛋白灰度值与标准蛋白灰度值的比。
1.2.4 逆转录-聚合酶链反应(RT-PCR)法检测结肠组织 Occludin、Claudin-1、IL-13、JAK1、STAT6 的表达 参照RNAiso Plus说明书采用RNAiso Plus提取总RNA,逆转录为cDNA、荧光定量PCR试剂盒进行荧光定量PCR反应,以GADPH为内参,2-ΔΔCt法计算,引物序列见表1。扩增引物见表1。

表1 目的基因与内参基因引物序列信息表Tab.1 Primer sequence information of target genes and internal reference genes
1.3 相关性分析 除空白组外,将各组中检测的Occludin和Claudin-1基因表达量逐一与 JAK1、STAT6、IL-13的基因表达量使用Spearman相关分析,计算出相关系数(γ),测定P值,从而分析各指标之间的相关性。
1.4 统计学分析 采用SPSS 24.0统计软件,计量资料用均值±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。相关性分析采用Pearson线性相关,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠结肠组织病理学变化
2.1.1 病理学观察结果 模型组结肠组织结构不完整,局部可见隐窝消失及隐窝炎,大量淋巴浆细胞浸润,炎症累及黏膜下层。空白组结肠组织结构完整,隐窝结构存在,密集排列,固有层少量淋巴浆细胞浸润。低剂量组结肠组织结构较模型组好转,隐窝结构轻度改建,固有层大量炎性细胞浸润。高剂量组、美沙拉嗪组结肠组织趋于正常,隐窝结构改建,少量炎细胞浸润。中剂量组结肠组织病理变化程度介于低剂量组和高剂量组之间。见图1。

图1 各组大鼠结肠组织病理改变(HE,×200)Fig.1 Pathological changes of colon tissue in rats of each group(HE,×200)
2.1.2 病理学评分结果 与空白组比较,模型组结肠组织病理学(HPS)评分升高(P<0.01);与模型组比较,各用药组 HPS 评分均下降(P<0.01),其中高剂量组低于低、中剂量组(P<0.01 或 P<0.05),差异均具有统计学意义;高剂量组与美沙拉嗪组比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠结肠黏膜组织病理学评分(±s)Tab.2 Colon mucosal histopathology score of rats in each group(±s) 分

表2 各组大鼠结肠黏膜组织病理学评分(±s)Tab.2 Colon mucosal histopathology score of rats in each group(±s) 分
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△△P<0.01。
组别 动物数 HPS评分空白组 6 2.50±2.07模型组 6 15.33±1.51**低剂量组 6 9.50±2.51##△△中剂量组 6 5.33±1.16##△△高剂量组 6 1.83±1.60##美沙拉嗪组 6 2.83±1.17##
2.2 各组大鼠结肠组织Occludin、Claudin-1的蛋白及基因相对表达水平比较
2.2.1 Occludin、Claudin-1的蛋白表达 1)Occludin表达:模型组较空白组明显下调(P<0.01),各用药组较模型组均明显上调(P<0.01);美沙拉嗪组不同程度优于低、中剂量组(P<0.01 或 P<0.05),差异均具有统计学意义。与高剂量组差异无统计学意义(P>0.05)。2)Claudin-1 表达:模型组较空白组下调(P<0.01),各用药组较模型组均上调(P<0.01),美沙拉嗪组优于低、中剂量组(P<0.01),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P>0.05)。见表3、图2。
表3 各组大鼠结肠组织Occludin、Claudin-1蛋白表达(±s)Tab.3 Expression of Occludin and Claudin-1 protein in rat colon of each group(±s)

表3 各组大鼠结肠组织Occludin、Claudin-1蛋白表达(±s)Tab.3 Expression of Occludin and Claudin-1 protein in rat colon of each group(±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△P<0.05,△△P<0.01。
组别 动物数 Occludin Claudin-1空白组 6 1.00±0.00 1.00±0.00模型组 6 0.45±0.12** 0.66±0.03**低剂量组 6 0.71±0.13##△△ 0.83±0.02##△△中剂量组 6 0.96±0.12##△ 0.98±0.04##△△高剂量组 6 1.05±0.14## 1.25±0.13##美沙拉嗪组 6 1.11±0.03## 1.42±0.20##
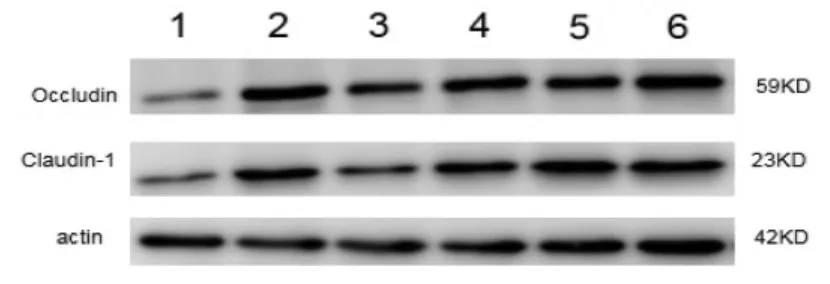
图2 各组大鼠结肠组织Occludin、Claudin-1蛋白变化Fig.2 Changes of Occludin and Claudin-1 protein in colonic tissues of rats in each group
2.2.2 Occludin、Claudin-1的基因表达 1)Occludin基因表达:模型组较空白组下调(P<0.05),各用药组较模型组均上调(P<0.01),美沙拉嗪组不同程度优于低、中剂量治疗组(P<0.01 或 P<0.05),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P>0.05)。2)Claudin-1 基因表达:模型组较空白组下调(P<0.01),各用药组较模型组均上调(P<0.01),美沙拉嗪组优于低、中剂量组(P<0.01),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠结肠组织Occludin、Claudin-1基因表达(±s)Tab.4 Expression of Occludin,Claudin-1 gene in colon of rats in each group(±s)

表4 各组大鼠结肠组织Occludin、Claudin-1基因表达(±s)Tab.4 Expression of Occludin,Claudin-1 gene in colon of rats in each group(±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△P<0.05,△△P<0.01。
组别 动物数 0ccludin Claudin-1空白组 6 1.00±0.00 1.00±0.00模型组 6 0.60±0.10* 0.58±0.08**低剂量组 6 0.79±0.15##△△ 0.84±0.15##△△中剂量组 6 1.02±0.18##△ 1.01±0.15##△△高剂量组 6 1.18±0.21## 1.31±0.22##美沙拉嗪组 6 1.30±0.20## 1.51±0.21##
2.3 各组大鼠结肠组织IL-13、JAK1、STAT6基因转录水平变化
2.3.1 IL-13基因表达 模型组较空白组下调(P<0.01),中、高剂量组及美沙拉嗪组较模型组均上调(P<0.01),差异具有统计学意义;低剂量组与模型组比较,差异无统计学意义(P>0.05);美沙拉嗪组优于中、低剂量组(P<0.01),差异具有统计学意义。与高剂量组比较,差异无统计学意义(P>0.05)。见图3。

图3 各组大鼠结肠组织IL-13基因变化Fig.3 Changes of IL-13 gene in colon tissue of rats in each group
2.3.2 JAK1基因表达 模型组与空白组相比,差异有统计学意义(P<0.01),中、高剂量组及美沙拉嗪组较模型组均不同程度下调,差异具有统计学意义(P<0.05 或 P<0.01),低剂量组与模型组比较,差异无统计学意义(P>0.05);美沙拉嗪组优于低剂量组,差异具有统计学意义(P<0.05),与高剂量组、中剂量组比较差异无统计学意义(P>0.05)。见图4。
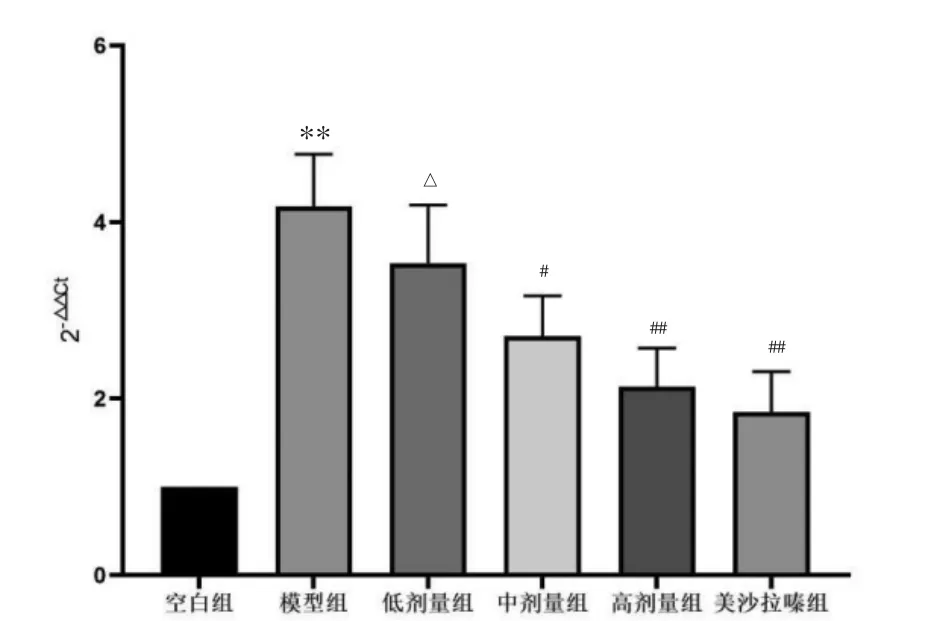
图4 各组大鼠结肠组织JAK1基因变化Fig.4 Changes of JAK1 gene in colonic tissues of rats in each group
2.3.3 STAT6基因表达 模型组与空白组相比,差异有统计学意义(P<0.01),各用药组与模型组相比,差异有统计学意义(P<0.01);美沙拉嗪优于低、中剂量组,差异具有统计学意义(P<0.01),与高剂量组比较,差异无统计学意义(P>0.05),见图5。

图5 各组大鼠结肠组织STAT6基因变化Fig.5 Changes of STAT6 gene in colon tissue of rats in each group
2.4 相关性分析结果 对Occludin和Claudin-1基因表达量逐一与JAK1、STAT6、IL-13的基因表达量使用Spearman相关分析,结果发现,Occludin和Claudin-1与 JAK1、STAT6表达水平呈负相关,Occludin和Claudin-1与IL-13表达水平呈正相关,Occludin、Claudin-1 与 JAK1、STAT6、IL-13 的基因表达量具有相关性,具体数值见表5。

表5 Occludin、Claudin-1 与 JAK1、STAT6、IL-13的相关性分析Tab.5 Correlation analysis of Occludin,Claudin-1 and JAK1,STAT6,IL-13
3 讨论
UC的治疗目标逐渐由诱导并维持临床缓解、黏膜愈合、防治并发症转变为快速诱导缓解、长期维持缓解、完全的黏膜愈合等[17]。最近更提出了深度缓解和达标治疗的新策略[18-20],即经过治疗后,达到和缓解,这是治疗UC的终极目标。因此治疗的关键是修复受损的肠黏膜屏障。Claudin-1蛋白作为肠黏膜机械屏障中紧密连接蛋白Claudins家族的一员,主要维护肠黏膜机械屏障的完整性和通透性[21]。Occludin蛋白是紧密连接中最重要的结构蛋白,参与紧密连接形成的信号调节[22-23],研究表明,Occludin、Claudin-1表达下调,肠道通透性增加,导致肠腔内的细菌、抗原物质移位激活免疫细胞反应,是UC发生的重要机制之一[24]。因此,上调Occludin、Claudin-1表达水平可以修复肠黏膜屏障,可能是治疗UC的重要靶点。
近年来研究发现[25],针对JAK/STAT通路的靶向治疗是修复肠黏膜屏障功能的重要突破点。STAT家庭共有7个成员,其中STAT6被证明在UC发病过程中可能发挥着重要的负性调节作用[26-28]。研究表明[29-30],IL-13主要的信号通路为JAK/STAT途径,在UC中,抗炎细胞因子IL-13与IL-13RA结合,通过JAK/STAT途径,磷酸化STAT6,启动转录以调节免疫应答反应,参与肠上皮细胞的紧密连接、抗凋亡和黏膜修复过程。所以,通过激活IL-13/JAK/STAT6信号通路,加速肠道屏障功能的修复,是治疗UC的核心环节。
Kim等[31]研究发现:细胞模型实验中STAT3核转位增多,Occludin等多种肠屏障结构的蛋白基因表达降低。卫江鹏等[32]研究亦显示,UC患者肠黏膜Occludin和Claudin-1蛋白表达低于正常肠黏膜,而STAT3蛋白高于正常肠黏膜,两者间呈负相关,且病情越严重,相关性越明显。本研究结果也显示,安肠愈疡汤各用药组Occludin、Claudin-1基因、蛋白表达水平较模型组均不同程度上调,且高剂量组效果较好。除低剂量组外其余用药组不同程度激活IL-13/JAK1/STAT6通路的基因表达,高剂量组、美沙拉嗪组效果最好。Occludin和Claudin-1与JAK1、STAT6表达水平呈负相关,与IL-13表达水平呈正相关,提示Occludin、Claudin-1基因表达可能与IL-13/JAK/STAT信号通路有相关性,中药安肠愈疡汤可能通过激活IL-13/JAK1/STAT6信号通路,上调Occludin和Claudin-1的表达水平,促进UC大鼠肠黏膜修复。通过激活IL-13/JAK1/STAT6信号转导通路修复肠黏膜屏障,可能是治疗UC的一个新靶点。