可见光引发的3D 生物打印技术及其生物墨水材料在组织工程领域的研究进展
郑子卓,David Eglin ,Mauro Alini ,Geoff R. Rihards ,秦岭,赖毓霄,e,*
a Centre for Translational Medicine Research and Development, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China
b Key Laboratory of Health Informatics, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China
c AO Research Institute, Davos CH-7270, Switzerland
d Musculoskeletal Research Laboratory, Department of Orthopedics and Traumatology, The Chinese University of Hong Kong, Hong Kong 999077, China
e Guangdong Engineering Laboratory of Biomaterials Additive Manufacturing, Shenzhen 518055, China
1. 引言
随着人体重要器官终末期衰竭率的激增,医学界迫切需要一种能够有效修复和恢复受损器官的创新治疗方法。此外,器官移植领域面临的挑战在于最佳捐赠者器官短缺和匹配的困难。近年来组织工程在再生受损组织方面取得了显著成就并引起了临床移植医生和研究人员的广泛关注。组织工程被认为是一种可能的手段,用于解决临床对活体器官日益增长的需求以及解决活体器官移植的局限性[1-4]。细胞、支架和生物/生化因子一般被称为基于组织工程的再生医学策略的“构建模块”的基本要素[5-7]。理想的组织工程生物活性支架将为细胞、生物活性因子和周围组织之间的相互作用提供平台[4]。此外,支架为细胞提供物理支撑并控制因子的释放。
Charles W. Hull于1986年首次提出三维(3D)打印技术[8]。3D打印是一种由计算机辅助设计模型来构建物体的制造过程[5]。与传统制造(如铸造和锻造工艺)相比,3D打印是指通过逐层增加材料的方式将数字模型制造成3D实体物件或支架的过程,属于增材制造技术的一种[1,3,5]。生物打印技术可通过设计有利于细胞生长的支架微观结构以及调节生物活性因子的分布满足组织再生需求,使其变得越来越有吸引力。打印材料、细胞和打印设备/方法是3D生物打印技术中最重要的三个因素。
根据美国材料与试验协会标准(F2792),3D打印技术分为光聚合成型、材料喷射成型、材料挤出成型、粉末床融化、黏结剂喷射、层压和直接能量沉积等8种打印技术[9]。在细胞活力和可打印性方面,基于光聚合的打印方法相较于其他类型的生物打印方法具有许多优势,如室温下能够快速固化、高保真打印以及温和的反应过程。通过调节光强、曝光时间和照射面积,该打印方法可以方便地控制打印结构和速度[7]。在各种生物打印方法中,有4种方法被广泛应用于光固化生物打印:喷墨打印、挤出式打印、立体光刻印刷和数字光固化。
生物墨水是生物打印中的打印前体,通常是基于包含细胞的热敏或光聚合材料[10]。它作为细胞载体,能够确保打印成型中的精确定位、避免打印过程中细胞机械损伤和保护打印后材料形成的有利于细胞生长的微环境。在众多的打印材料中,水凝胶是一类通过化学键或物理力形成的3D网络聚合物。它可以在水中膨胀,但不会溶于水。一些水凝胶显示出类似于天然细胞外基质(ECM)的可渗透结构。这种结构为细胞增殖提供了优越的3D微环境[11-15]。鉴于这些特性,许多类型的水凝胶都可以应用在组织工程的各个领域。聚合物链之间会发生两种交联:化学交联和物理交联。不同的交联方法对水凝胶的凝胶动力学以及性质会产生不同的影响。物理交联的水凝胶主要依靠分子间作用力、氢键和其他弱相互作用力。化学交联的水凝胶则由共价键形成,相比物理交联的水凝胶强度更高[11]。在化学交联方法中,光聚合因其独特的性能而备受关注[16-18]。
光聚合是获得共价交联水凝胶的一种简单、干净且方便的方法。光聚合可以在空间和时间上有效地控制水凝胶的形成和结构。目前,光聚合主要是用紫外线(UV)来实现的,但细胞在暴露期间可能会受损[19]。相比之下,当将紫外线换成可见光时,水凝胶体系则拥有更高的细胞相容性和更广泛的应用前景。此外,可见光具有更高的穿透深度,这使得水凝胶的结构更均匀[20]。可见光交联水凝胶已在组织工程[21]、3D细胞封装[22]和药物输送[23]等众多领域得到广泛的研究和应用。
在本文中,我们简要讨论了可应用于可见光诱导生物打印的3D生物打印技术及设备的操作原理和特点(表1 [20,21,24-33])。然后,系统概述了可见光交联生物墨水,包括交联机制和可见光引发剂,并重点介绍了它们在生物医学中的应用。最后,讨论了生物打印和可见光交联水凝胶所面临的挑战,并且对发展前景与发展方向进行了展望。
2. 光诱导3D 生物打印法
2.1. 基于喷墨技术的生物打印
喷墨打印源于商业的2D喷墨打印技术,该技术将载有细胞的生物墨水滴落并沉积到预定区域,形成预设的形状[34]。从喷嘴喷射到基板上的液滴通常是由热驱动或压电驱动产生的,如图1 [24]所示。热驱动通过加热元件产生液滴,在2 μs内使生物墨水过热,因此高温(如300 ℃)不会影响细胞活力[9]。压电驱动可快速调节电压,迫使生物墨水通过压电材料排出液滴。生物墨水的物理和化学凝胶过程可以与打印过程同时发生,以保证印刷保真度。由于液滴体积小(直径为10~50 μm)且喷射速度很快(每分钟高达10 000个液滴),所以基于喷墨技术的打印可确保高打印分辨率(低于50 μm)和较快的打印速度[24]。此外,打印后的细胞活力可以超过80%。然而,基于喷墨技术的生物打印的一个缺点是该技术仅限于使用低黏度生物墨水,因为高黏度生物墨水往往会堵塞喷嘴,导致高剪切应力[8]。因此,基于喷墨技术的生物打印在生物墨水的材料和细胞浓度的选择方面有限制。此外,构造大而复杂的3D结构也是一项挑战。Acosta-Vélez等[25]开发了一种药物片剂,该药物可以在30 s内在可见光下通过喷墨打印制造出来。使用可见光系统而没有使用紫外线,是因为后者会影响药物的稳定性[25]。
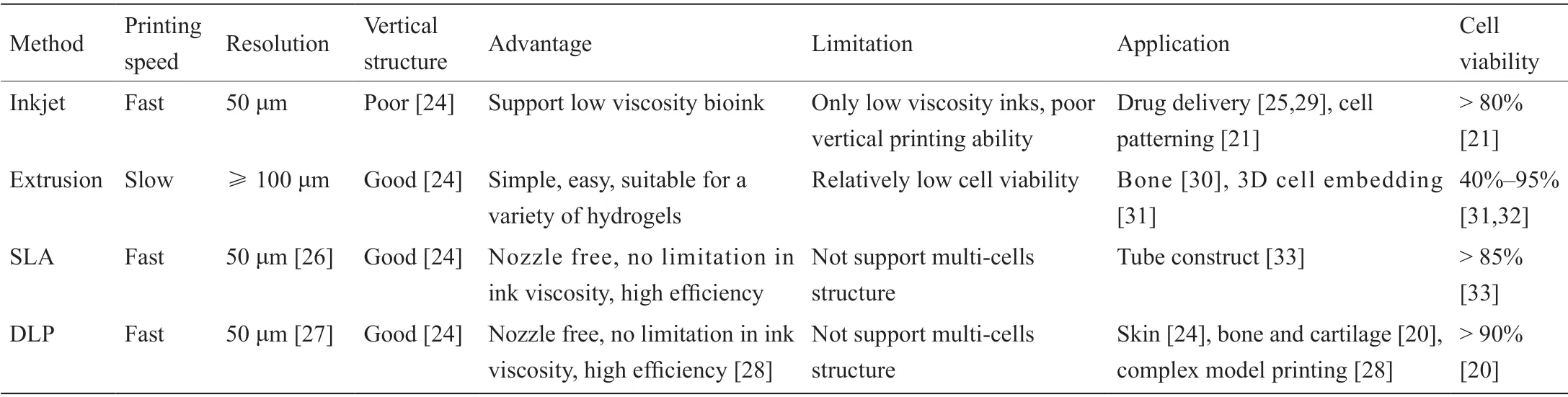
表1 可见光诱导的生物打印方法
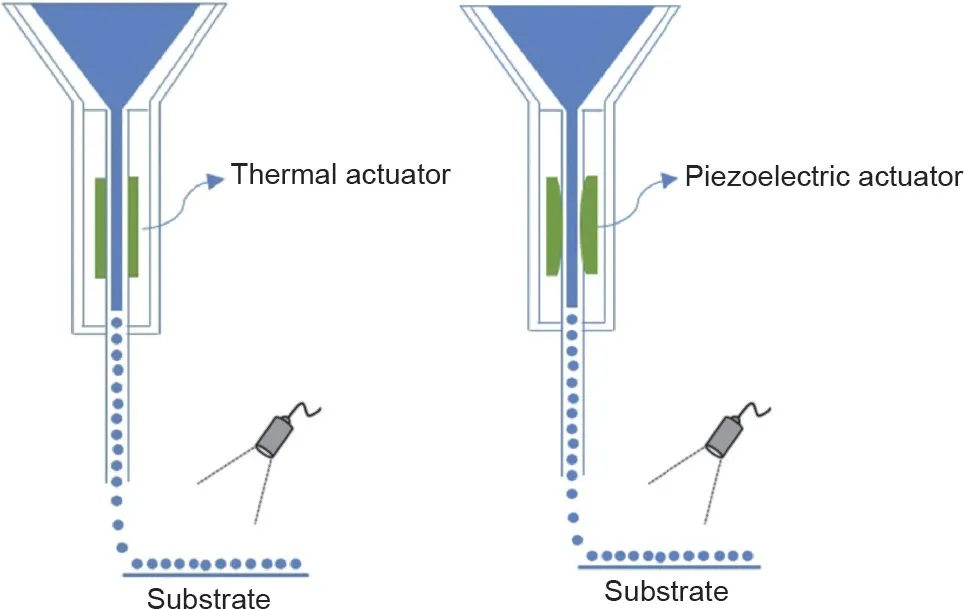
图1. 喷墨生物打印示意图。经Elsevier许可转载自参考文献[24],©2018。
2.2. 基于挤压技术的生物打印
基于挤压技术的打印是用于制造支架的最常见的增材制造方法之一。挤压由气动、活塞驱动和螺杆驱动系统控制[35]。与基于喷墨打印的情况不同,挤压过程的压力更方便控制,因而生物墨水的黏度可选范围更广(30 ~ 6 × 107MPa·s)。也就是说,尽管在活细胞支持方面受到限制,但该技术可选的材料更加多样化[37]。根据挤压过程的基本理论,基于挤压技术的打印方法主要的缺点是针头大小导致的分辨率低和打印速度慢。当前生物打印应用的挤压式打印技术的分辨率可以达到100 μm[9]。当将光交联生物墨水应用于基于挤压的生物打印时,光学设备位置的设置至关重要。光固化过程可以在挤压之前(预交联)、之后(后交联)或过程中(原位交联时)进行,如图2 [38]所示。Ouyang等[38]的研究表明,预交联会导致挤压力过高且不一致、结构不均一和细胞活力低(约47%)。尽管后交联可以提高细胞活力且降低挤压力,但生物墨水在稳定之前就流动了,因此无法保持细丝结构。当用透光毛细管替换针头时,水凝胶可以在沉积之前交联(用紫外线或可见光进行原位交联),从而使打印更具高保真度且有相对较高的细胞活力(超过95%)[38]。通过调整水凝胶浓度,在基于挤压的生物打印中,后交联在可见光下能够实现比在紫外线下更高的保真度,并确保高细胞活力(超过90%)[39]。
2.3. 立体光刻印刷技术和数字光固化
立体光刻印刷(SLA)与数字光固化(DLP)具有相似的成型机制。
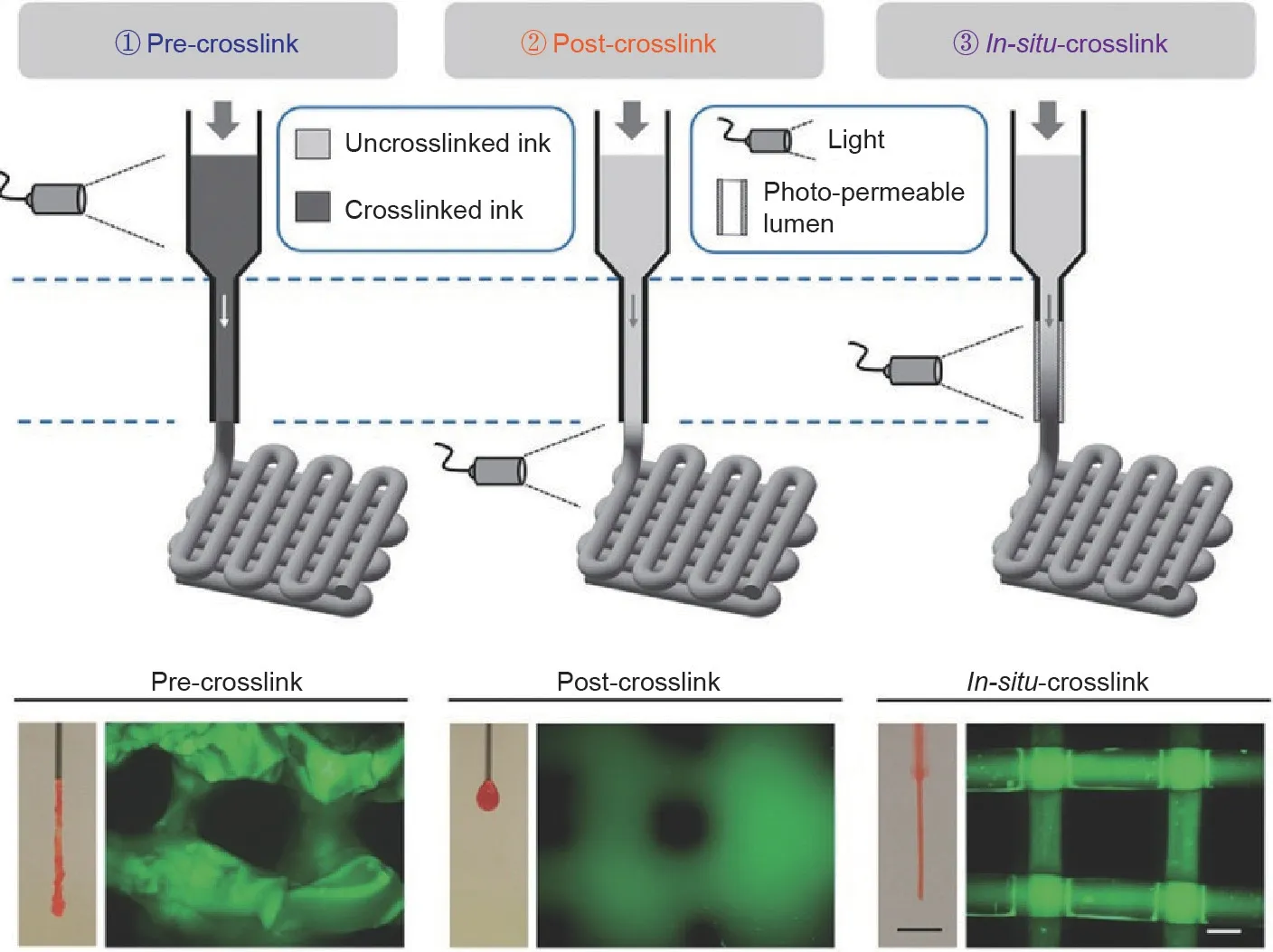
图2. 三种挤出式生物打印示意图。经Wiley许可,转载自参考文献[38],©2017。
SLA是使用数字微镜阵列来控制打印区域每个像素光强度的打印方法之一[6]。在SLA打印过程中,激光以点对点的方式投射到液体感光材料上以形成固化层。在第一层固化后,平台会上升一定高度,之后对第二层进行光交联。重复此操作,直到打印出完整的形状[图3(a)]。SLA不需要通过喷嘴挤出,并且比基于挤压的打印更快、更准确且具有更高的分辨率(< 100 μm)[40]。一般来说,SLA生物打印使用紫外线作为光源。由于紫外线在生物打印过程中会使细胞受损,因此该方法具有一定的局限性。Wang等[26]开发了一种可见光诱导的基于SLA的生物打印法,并将其与基于曙红Y(EY)的光引发剂一起使用,以制造聚乙二醇二丙烯酸酯(PEGDA)和甲基丙烯酸明胶(GelMA)的复合水凝胶。该方法所达到的分辨率为50 μm,细胞能够存活至少5 d,且细胞活力达85% [26]。
DLP生物打印类似于基于SLA的打印法,不同之处在于它通过投影仪来固化层图像而不是以点的形式将光投射到光聚合材料上[41-43] [图3(b)]。DLP的打印速度高于SLA,尤其是在打印较大的物体时更为明显。然而,受限于数字光镜的投影面积和分辨率,与SLA相比,DLP的可打印区域变少了。因此,DLP方法通常只用于打印小的物体。Lim等[39]探索了丝素蛋白(SF)水凝胶的3D DLP打印分辨率。他们在X方向获得了66 μm的分辨率,在Z方向获得了146 μm的分辨率。这表明该方法能够高精度地打印复杂结构(如埃菲尔铁塔)[39]。Lim等[39]开发了一种可见光诱导的DLP系统。该系统实现了50 μm的分辨率和超过90%的细胞活力[27]。DLP是一种高效的逐层打印法。Kelly等[44]基于DLP方法提出了更新一代的制造方法,通过将光敏聚合物预聚液在动态演化的光场中旋转来进行光聚合而生成打印结构[图3(c)]。这种方法可以允许打印更大体积的物体,并且比普通的DLP方法打印速度快几个数量级[44]。Bernal等[28]使用可见光(405 nm)介导的体积式生物3D打印技术[图3(d)]打印厘米级的复杂结构(如有血管嵌入的复杂骨小梁结构和复杂的半月板结构),且其中包覆的细胞存活率很高(> 85%),打印的整体时间只需要几秒到几十秒[28]。这些方法见表1。
3. 可见光交联材料
3.1. 可见光引发剂
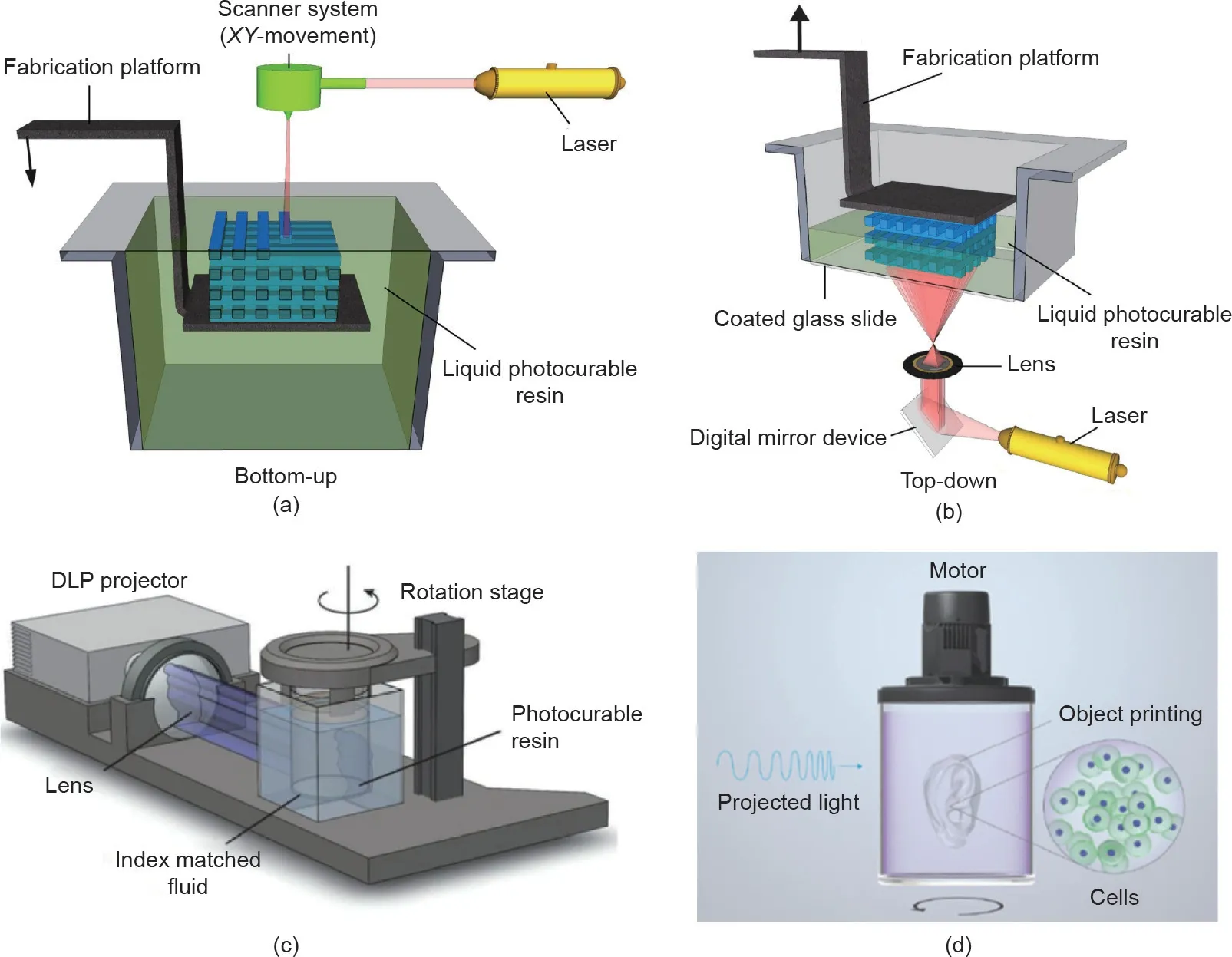
图3. SLA(a)和DLP(b)生物打印方法示意图。经Elsevier许可,转载自参考文献[10],©2012。(c)转轴式立体光刻打印示意图。经Science许可,转载自参考文献[44],©2019。(d)转轴式生物3D打印物料平台。经Wiley许可转载自参考文献[28],©2019。
大多数可见光交联的生物墨水都需要光引发剂来引发。光引发剂的类型和暴露于可见光中的持续时间会影响细胞活力和光引发效率。因此,选择可见光引发剂时需要考虑吸收光谱、水溶性、产生自由基的能力和稳定性。
根据聚合的活性物质,可见光引发剂可分为自由基光引发剂和阳离子光引发剂两种。然而,阳离子光引发剂在聚合开始时会产生质子酸,因此不能应用于生物医学领域[7,16]。由此可知,可见光交联水凝胶主要依赖于可见光引发的自由基聚合。自由基光引发剂可分为I型光引发剂(单组分热解)和II型光引发剂(光敏剂/共引发光引发剂)[45]。I型光引发剂吸收入射光子,并在光作用下可以裂解为两个自由基。然而,在可见光区域内可选的I型光引发剂较少,通常使用苯基-2,4,6-三甲基苯甲酰基次膦酸锂(LAP)作为光引发剂[46]。相比之下,II型光引发剂有更加多样化的替代品,它们从共引发剂中提取氢以生成二级自由基。目前,钌吡啶络合物、EY和樟脑醌(CQ)引起了学者的关注并被广泛应用于组织工程。在可见光交联水凝胶系统中,引发剂的细胞毒性和吸收光谱对于封装细胞尤为重要。常用的可见光引发剂见表2 [39,46-56]。
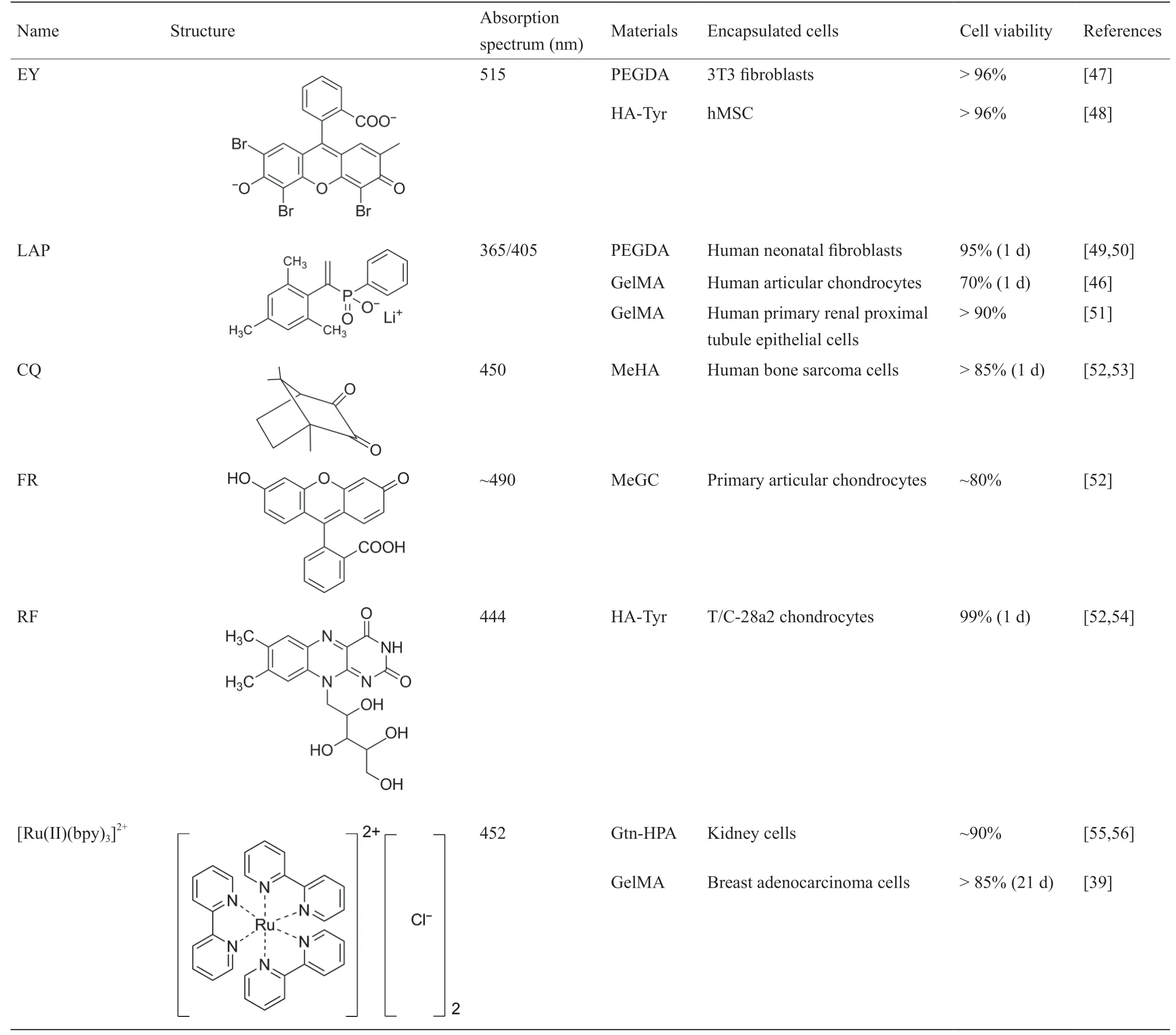
表2 可见光引发剂的类型
CyQuant细胞增殖直接检测法(CyQuant direct cell proliferation assay method)表明,随着LAP浓度的增加,人原发性肾小管上皮细胞(hRPTEC)的存活率虽然略有下降,但仍然能满足生物相容性的标准[51]。Lin等[57]在早期工作中开发了一种由LAP光引发剂引发的GelMA水凝胶,并在其中搭载了人骨髓间充质干细胞(MSC),在凝胶中该干细胞具有长期的细胞活力、增殖能力超过90 d,并且细胞形态良好。虽然LAP可以通过吸收近紫外线蓝光(405 nm)的能量而产生自由基,但是用这种产生近紫外线蓝光元件使得生物打印设备的成本很高,因此这种类型的设备在成本上并没有明显优于目前的紫外生物打印系统。这种强烈的近紫外线蓝光对哺乳动物细胞有害并会破坏细胞生命活动的进程[51]。CQ、荧光素和核黄素(RF)具有相似的吸收光谱(在400 nm和500 nm之间)[52]。利用甲基丙烯酸乙二醇壳聚糖(MeGC)水凝胶对这几种引发剂进行细胞毒性测试,实验结果表明,RF引发的壳聚糖水凝胶机械强度最高、细胞毒性最低。此外,胶凝时间和细胞呈负相关[52]。Donnelly等[54]开发了一种RF引发的酪胺取代透明质酸(HA-Tyr)水凝胶,并将其覆盖在TC-28a2软骨细胞上,一天后,超过99%的细胞仍然存活。
在可见光引发剂中,EY比其他的引发剂具有更多的优势[2]。EY是高度水溶性的,在大约515 nm处有一个吸收峰,并且细胞毒性很低[51]。EY和LAP对肝祖细胞HepaRG表现出相似的细胞相容性。值得注意的是,与LAP相比,在由EY引发的明胶水凝胶中,肝脏相关基因的表达程度相对更好[58]。Gwon等[59]研究证明,人脂肪间充质干细胞在肝素修饰的透明质酸(HA)水凝胶中能够有效生长和增殖(细胞活力为95%)。此外,水凝胶可以支持脂肪来源的间充质干细胞[58]的3D结构舒展以及成脂分化。Kerscher等[60]证明,EY可以在1 min内引发低密度的GelMA水凝胶聚合成胶,并能够促进高效的心肌细胞分化。在分化的第8天,水凝胶会自发性收缩,同时相关基因的表达、凝胶收缩的同步性、频率、速度都随时间而变化[60]。
钌吡啶络合物[Ru(II)(bpy)3]2+/硫酸钠(SPS)系统也显示出独特的优势。[Ru(II)(bpy)3]2+/SPS可缓减聚合过程中氧的抑制作用,从而提高3D生物打印时垂直方向的保真度[39]。3D生物打印虽然广泛用于打印复杂结构的水凝胶,但在打印过程中维持垂直方向上的结构和保持水平方向上的精度仍具有挑战性。一些研究表明,氧气抑制效应直接影响3D生物打印的光固化打印保真度和水凝胶结构。由于氧气会影响自由基的存在,自由基会与氧气发生反应,并转化为过氧化氢自由基,而过氧化氢自由基不能与不饱和键发生反应。同时,过氧化氢自由基会减少系统中质子的数量,形成氢过氧化物或醇类,使共价交联的形成受阻。这些反应会导致水凝胶的成型结构不充分,从而影响层与层之间的堆叠和垂直方向的印刷保真度。为了解决这个问题,Lim等[39]应用了[Ru(II)(bpy)3]2+/SPS引发的可见光3D打印,与I2959引发的紫外线3D打印相比较,前者减轻了氧气抑制多孔生物膜构建的影响(图4 [61]),并在21天内可以保持85%的细胞存活率。Al-Abboodi等[55]开发出一种由[Ru(II)(bpy)3]2+/SPS引发的明胶-羟基苯丙酸(Gtn-HPA)结合水凝胶,该水凝胶也显示出了良好的细胞存活率(超过85%)。
3.2. 光聚合机制和凝胶化机制
光聚合有两种类型:无光引发剂聚合和由光敏剂、光引发剂受光激发而引起聚合。无光引发剂聚合由紫外线直接引发聚合。Farkas等[6]开发了一种无光引发剂的3D支架。它是在波长为248 nm或308 nm [6]的光下通过准分子激光光固化来制造的。该支架相比由光引发剂引发制造的支架具有更高的细胞活力。然而,这种类型的聚合所需的能量高于单体共价键的能量。此外,在可见光范围内满足这一要求有一定挑战性。因此,它不太可能应用于可见光诱导的聚合领域。可见光下的聚合需要光引发剂。研究中被广泛应用的三种凝胶化机制包括自由基链式聚合机制、硫醇-烯烃“点击”反应机制和光催化的自由基偶联反应机制。凝胶化机制的详细信息如下所述。
3.2.1. 自由基链式聚合机制

图4. 紫外线和可见光聚合的GelMA/胶原蛋白(Col)打印支架的结构差异。Vis:可见光;Ru:[Ru(II)(bpy)3]2+。经American Chemical Society许可,转载自参考文献[61],©2016。
合成化学的发展和进步使功能单体和大分子链能够通过各种方法进行改造和合成。此外,可以通过自由基聚合(FRP)的方法来生成光交联生物墨水。如图5所示,FRP过程有三个反应阶段:链引发、链增长和链终止[14]。将引发剂暴露在光下生成自由基后,自由基会与双键反应形成新的自由基。新的自由基进一步与单体上的双键发生反应或形成低聚物,并进一步进行链增长直至链终止[7]。
由于甲基丙烯酸酯单体的细胞毒性,适用于FRP的生物墨水是通过向天然或合成的大分子链中引入少量的甲基丙烯酰基团(使用甲基丙烯酸酐[62]、甲基丙烯酸甘油酯[63]或甲基丙烯酰氯[24])制成的,之后通过选择合适的光引发剂来制作水基光交联生物墨水。自由基聚合机制和凝胶化机制的说明如图5所示。
3.2.2. 硫醇-烯烃“点击”反应机制
硫醇-烯烃“点击”反应是一种快速、高度选择性的通用方法,用于制备可光交联的水凝胶。19世纪中叶,当Charles Goodyear发现天然橡胶(聚顺式异戊二烯)的硫化时,标志着经典的硫醇化学出现了。此后,学界对巯基/乙烯基聚合的机理、动力学特征和特性进行了广泛的研究[64,65]。巯基/自由基光聚合的自由基增长机制与乙烯基自由基链的生长机制不同。此外,巯基单体相当于交联剂[65]。巯基-烯烃反应不受空气中氧抑制的影响,可快速实现光聚合[66,67]。因此,光引发剂的使用量较少。此外,形成的硫醚键可以增强材料的强度。
引发剂活化后,从巯基中提取质子形成硫基自由基。之后,硫基自由基与乙烯基键发生反应。该反应会形成硫醚键和碳中心自由基,它们可以生成另一个硫基自由基。巯基-烯烃反应会持续至可反应部分耗尽为止[64]。与富含电子的乙烯基单体(如降冰片烯[68]、丙烯酸酯、甲基丙烯酸酯、苯乙烯或共轭双烯[13,39])的反应涉及乙烯基单体的均聚反应以及巯基和乙烯基之间的共聚反应[65](图6)。
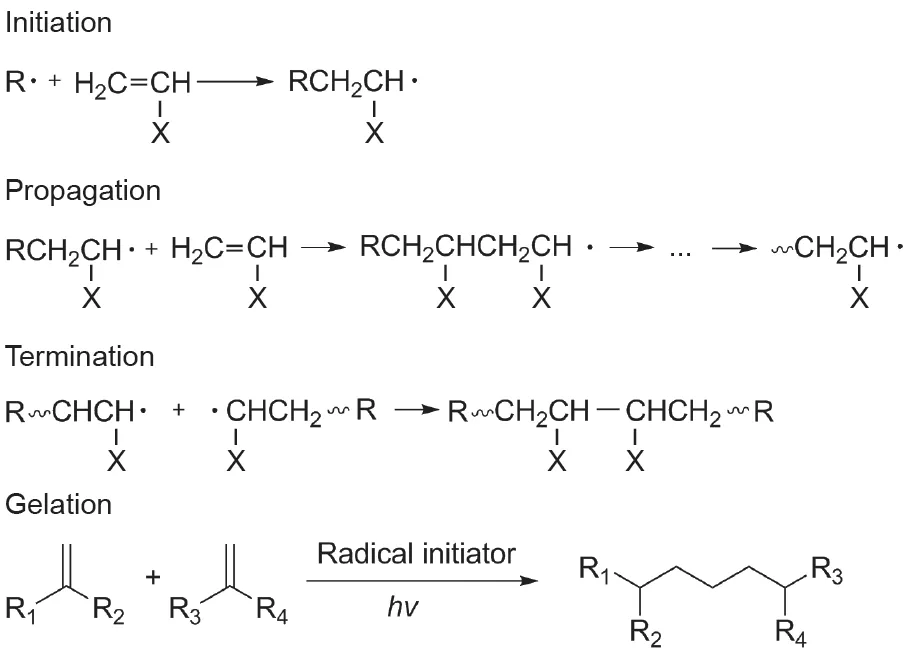
图5. 自由基聚合机制和凝胶化机制。hv:光子能。
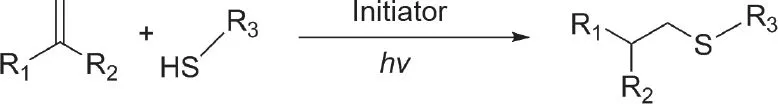
图6. 硫醇-烯烃“点击”反应机制。hv:光子能。
3.2.3. 光催化的自由基偶联反应
这类反应通常需要含酚羟基化合物的参与,如酪胺。此外,钌[Ru(II)]和EY常被用作该反应的可见光引发剂。不同的光引发剂在反应中有不同的引发机理。[Ru(II)(bpy)3]2+在可见光下被光氧化成[Ru(III)(bpy)3]3+。然后,活化的Ru(III)从酚羟基中吸引一个电子。这就生成了一种可以进攻多种其他基团的自由基[69],如图7(b)所示。然而,基态EY吸收光子后转变为单重态(1EO),之后通过系统间的交叉转换为长寿命的三重态(3EO*)。能量在氧气存在时用于形成单态氧(1O2)[70]。然后,单态氧与酚羟基反应生成维持交联的自由基,如图7(c)所示。实现这一反应的常用策略是用含有酚羟基的分子修饰聚合物。Sakai等[33]通过用酪胺修饰海藻酸盐成功地开发了一种生物墨水。这种墨水在普通台灯的照射下,10 s内就能完成凝胶化[33]。
3.3. 可见光交联的材料
光聚合材料主要分为天然衍生材料和合成材料。让材料具有光聚合能力最常见的方法是用含有双键的化合物,如丙烯酸酯、甲基丙烯酸酯、苯乙烯、共轭二烯和酪胺修饰特定的侧基或端基。常见的光聚合材料类型及改性方法见表3 [23,27,33,46,51,55,71-85]。
3.3.1. 天然衍生材料
细胞周围由复杂的结构和多种功能性大分子组成,称作细胞外基质(ECM)。天然材料来源于有机体中的多糖和蛋白质。明胶、胶原蛋白等天然材料大多具有优越的细胞响应性和细胞黏附性,并可在体内降解。此外,天然材料价格低廉且可再生,但存在降解速率高、净化工艺复杂、机械性能差等缺点。
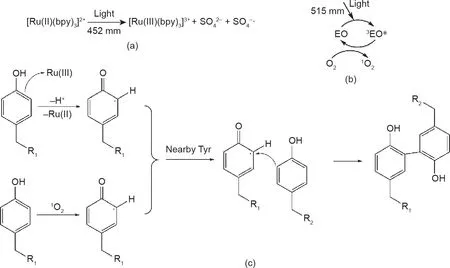
图7. 光催化的自由基偶联反应的机理。(a)钌的引发机理;(b)EY的引发机理;(c)光催化的自由基偶联反应机理。
明胶是一种从动物组织中分离出来的动物蛋白,通过胶原蛋白的热变性制备而成[6,85],其中胶原蛋白是含有18种氨基酸的多肽的多相聚集[86]。考虑到明胶的结构,明胶具有功能单体改性的潜力,并且不会显著降低其细胞相容性。Lin等[85]介绍了可降解的明胶水凝胶包裹的人骨髓间充质干细胞,它们具有持久的活力、增殖能力(超过90 d)和良好的完整性。2000年,Van Den Bulcke等[87]首先开发了可光聚合的明胶甲基丙烯酰衍生物GelMA,并申请了专利。该衍生物由(羟基)-赖氨酸和鸟氨酸侧链上的伯胺与甲基丙烯酸酐反应得到[47,48]。在低温下(< 25 ℃),GelMA预聚液可以在链之间形成氢键从而增加溶液的黏度。这有助于达到3D打印挤出工艺的黏度需求。GelMA作为一种独立材料或通过与其他材料复合共同交联形成水凝胶,在生物打印领域得到了广泛的应用。除了GelMA外,还开发了几种类似修饰方法的可光交联明胶衍生物。Mazaki等[71]开发了一种呋喃胺共轭明胶,它可以通过可见光交联,同时又可以在体外支持骨髓间充质干细胞的软骨分化进程[71]。
壳聚糖是一种多糖,由自然界中广泛存在的几丁质(虾壳、蟹壳等)经过脱乙酰作用得到,化学名称为聚葡萄糖胺(1-4)-2-氨基-β-D-葡萄糖[75]。由于其具有抗菌活性,壳聚糖已被美国食品药品管理局(FDA)批准用于医用伤口敷料。就其化学性质而言,氢键的存在会降低壳聚糖在水中的溶解度[88]。壳聚糖中丰富的基团,如酰胺基,为修饰局部性质提供了许多机会。壳聚糖可与甲基丙烯酸酐或甲基丙烯酸甘油酯反应,形成可光聚合的壳聚糖衍生物。这种衍生物可用于制备生物活性载体[23,75]和生物墨水[89]。
透明质酸是一种由D-葡萄糖醛酸和N-乙酰葡萄糖胺结构单元组成的天然糖胺多糖[90,91]。透明质酸通常以阴离子形式存在,广泛分布于结缔组织、上皮组织和神经组织。透明质酸的每个单体都有活性基团修饰位点[92]。因此,研究人员对现有合成透明质酸大分子单体衍生物,如甲基丙烯酰透明质酸[38]和降冰片烯功能化透明质酸的化学方法进行了改进[77]。就其在细胞外基质中的作用而言,透明质酸表现出高亲水性和细胞相容性,以支持细胞增殖、迁移和分化[91]。Gwon等[59]研究表明来自人脂肪的间充质干细胞在肝素修饰的透明质酸水凝胶中生长和增殖状况良好。在细胞培养过程中,可以观察到几种功能标记的蛋白的分泌和其协同作用[82]。Hinton等[93]利用甲基丙烯酸酯化透明质酸(MeHA)、胶原蛋白等软材料,测试了一种基于挤压的新型生物打印方法(悬浮支撑自由打印法),该方法在生物打印天然材料中展现出巨大的应用潜力[93]。
丝素蛋白(SF)是一种从蚕丝中提取的不溶性蛋白。SF有三条分子链:轻链、重链和糖蛋白P25。重链和轻链之间通过二硫键连接。此外,它们再与糖蛋白P25通过非共价作用结合[94]。由于其无毒、免疫原性低、降解率低[95],SF可用于创面敷料、酶固定化基质、血管修复体和结构种植体[79]。经改性后的SF也可应用于生物打印。Kim等[79]开发了一种改性的甲基丙烯酸缩水甘油酯SF生物墨水。它可以构建心脏、血管、脑、气管、耳朵等高度复杂的器官结构,具有优秀的结构稳定性和可靠的生物相容性[79]。
海藻酸盐是一种阴离子多糖,是由β-D-甘露糖醛酸和α-L-古洛糖醛酸按(1→4)键连接而成的长链聚合物[81]。海藻酸盐具有优越的生物相容性、低毒性、低成本和方便凝胶化等特性,适用于生物打印[96]。一般来说,海藻酸盐的生物打印过程涉及二价阳离子(Ca2+等)的添加[97]。然而,普通海藻酸盐水凝胶在体外培养过程中迅速失去这些机械性能(9天内失去约40%)。此外,它们的细胞黏附位点不足[61]。如果海藻酸单体的羧基与2-氨基乙甲丙烯酸酯(AEMA)反应,得到的甲基丙烯酸酯化的海藻酸钠进行光交联并改善其机械性能[80]。降冰片烯功能化海藻酸盐可在较低浓度(质量分数为2%)下实现打印,并保持比纯离子交联打印更稳定的3D结构[81]。
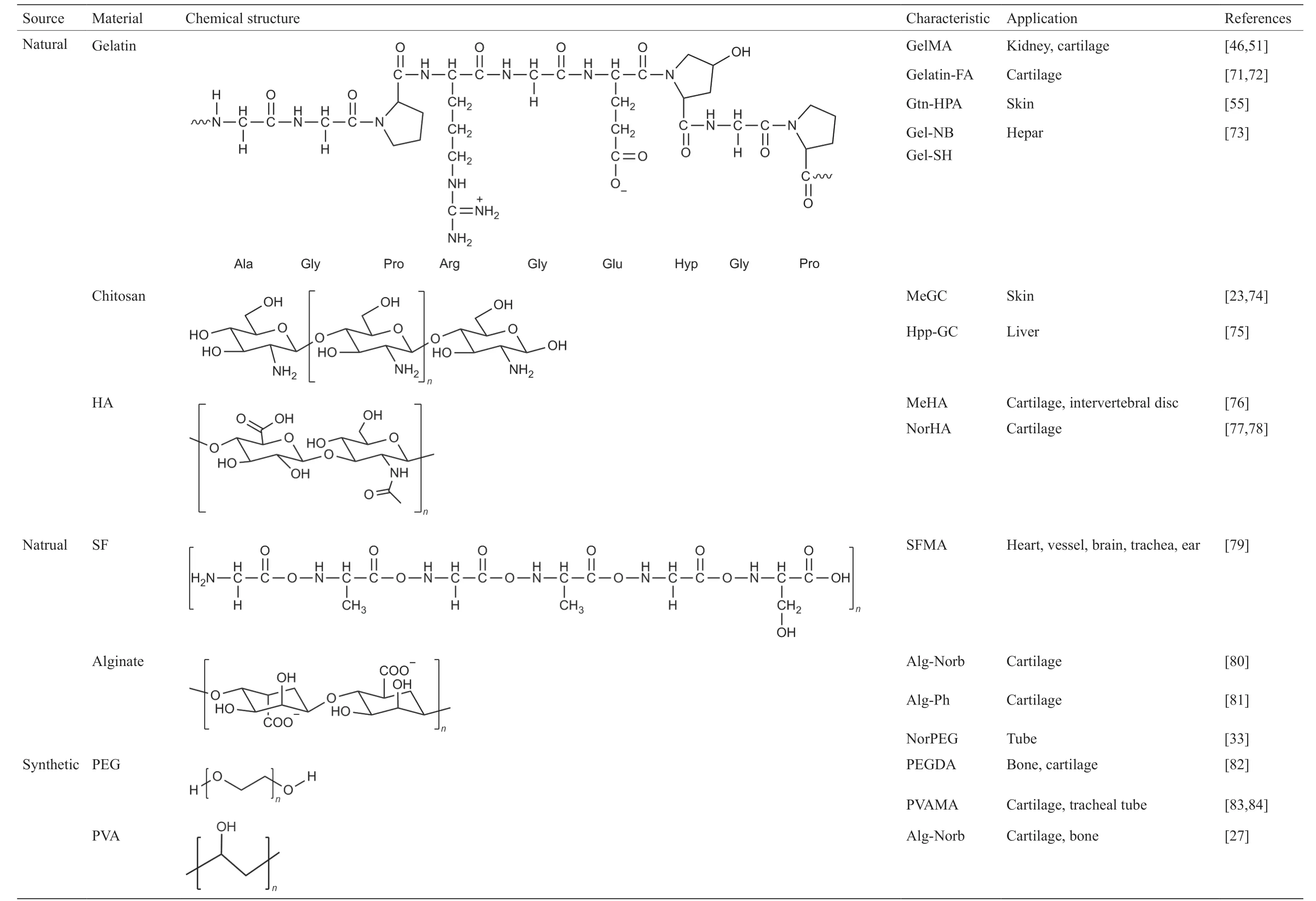
表3 光聚合材料的特点及应用
3.3.2. 合成材料
与天然材料相比,合成材料的生物活性不足,但由于控制了化学和生物官能团[15],它们的化学和机械性能具有可重复性、稳定性和可调性。
聚乙二醇(PEG),又称聚环氧乙烯或聚氧乙烯,是乙二醇的线型合成聚醚,具有亲水性。PEG的末端官能团及其高度可控的分子量使其末端官能团[98]及合成物可以被修饰成四臂[99]或八臂[100],从而增加了材料的多样性。PEG应用于组织工程的主要优点包括结构和力学性能可调、生物相容性、亲水性、低细胞毒性和非免疫原性[101]。由于PEG是不可降解的,对细胞没有足够的黏附位点,通常与其他材料或多肽混合制成生物墨水。Bal等[102]使用几种多肽来抑制PEG水凝胶(由EY引发),以此观察水凝胶中间充质干细胞和受体的结合如何影响胰岛中胰岛素的分泌。
聚乙烯醇(PVA)是一种亲水性线性合成乙醇均聚物。大量的侧羟基为生物分子提供了附着位点和修饰的可能。由PVA及其衍生物制备的水凝胶,因化学性质可调节而得到了广泛的应用。纯PVA水凝胶无法供细胞长期生长:从第1天到第14天,MSC细胞活力从87%下降到71%。与GelMA结合后,第14天时细胞活力可达92% [27]。
3.4. 可见光诱导的3D 生物打印应用
3.4.1. 组织工程
3D生物打印主要用于组织工程和再生医学。最终目标是制造人造组织替代品,进而构建人造器官。然而,目前还无法形成一种功能完整的人工组织替代品用于体内。因此,为了实现这一目标,主要研究集中在模拟体内条件的体外模型。
为了实现体外模型的制造,研究人员需要高打印分辨率来模拟体外组织的复杂结构。Wang等[26]开发了一种基于SLA的可见光诱导生物打印系统,用EY制备PEGDA和GelMA水凝胶。垂直3D结构的分辨率为50 μm[图8(a)],NIH 3T3成纤维细胞活力为85%且保持了至少5 d [26]。Bertlein等[56]的研究表明,可见光 + [Ru(II)(bpy)3]2+/SPS体系比紫外线 + I2959体系具有更高的保真度[图8(b)、(c)]和能维持更长时间的(3周)细胞活力。Lim等[27]还开发了一种用于DLP生物打印的载细胞丙烯酸甲酯聚(乙烯醇)(PVAMA)/明胶甲基丙烯酰氯(GelMA)生物墨水。它能够以高分辨率(25~50 μm)对复杂结构进行生物打印[图8(d)]。它还能使装载的细胞在14d [27]内的存活率高达90%。
除了高分辨率外,打印结构中细胞增殖、黏附和分化的状态也很重要。Wang等[103]也开发了EY/GelMA水凝胶体系,该体系在打印图案的第5天形成了3D细胞网络(这揭示了研究细胞生长形态的潜在好处),如图9(a)所示。Sakai等[33]的研究表明,人脂肪间充质干细胞在酪氨酸化的透明质酸/明胶打印结构中装载25 d后,Nanog、Oct-4和Sox-2基因显著上调(是第1天的2~3倍)。这表明人脂肪间充质干细胞保持了多能性[32]。Lim等[27]证实PVAMA/GelMA水凝胶支持间充质干细胞成骨和成软骨分化。Ouyang等[38]报道了将降冰片烯修饰的透明质酸水凝胶用于包覆MSC。经过56 d的软骨形成培养后,组织学分析证实了被包裹的MSC可以产生糖胺聚糖(GAG)和胶原蛋白[104]。Petta等[48]最近介绍了一种通过酶和可见光交联的双交联透明质酸生物墨水。在挤压生物打印过程中,它在低取代条件下表现出柔性剪切细化性能,而且它保留了主要结构和性质,使人骨髓间充质干细胞、软骨细胞、人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)成纤维细胞得以培养,并恢复其3D形态[20]。
制备由不同细胞和材料组成的多层结构是模拟皮肤结构的关键要求。DLP生物打印可以逐层形成类似于皮肤含有水凝胶的细胞。Kwak等[105]利用可见光诱导的DLP开发了SF/PEG复合水凝胶作为人造皮肤模型。在保持较高的细胞存活率的同时,水凝胶表面在6周时形成致密的角蛋白层,如图9(b)所示[105]。
心脏是人类最重要的器官之一,复杂的结构和多细胞的相互作用决定了心脏的功能。为了研究心肌细胞和成纤维细胞在体内的相互作用,Kumar等[73]使用呋喃明胶和RF打印含有C2C12成肌细胞和STO成纤维细胞的多层薄片。在培养和孵育过程中,不同的细胞水凝胶层在交界处并没有分开,而是因细胞间的相互作用结合在一起[图9(c)] [72]。Kumar等[106]也开发了一种纤维蛋白-明胶生物墨水,用于心肌细胞和心脏成纤维细胞的共培养和偶联。此外,免疫化学数据显示,两种类型的细胞之间通过Connexin43黏附连接实现了异细胞偶联,这对细胞相互作用至关重要[106]。
功能齐全的人工器官重建离不开血管化网络的构建。生物3D打印技术是一种构建血管结构的有效方法。Sakai等[33]使用[Ru(II)(bpy)3]2+/SPS来聚合经过酪胺化修饰的海藻酸盐生物墨水,成功打印出一个包含直径为1 mm的可灌注的光滑螺旋腔的凝胶方块。这种凝胶方块也为以后在体外构建包含血管网的复杂3D细胞培养结构打下基础,如图9(d)[33]所示。
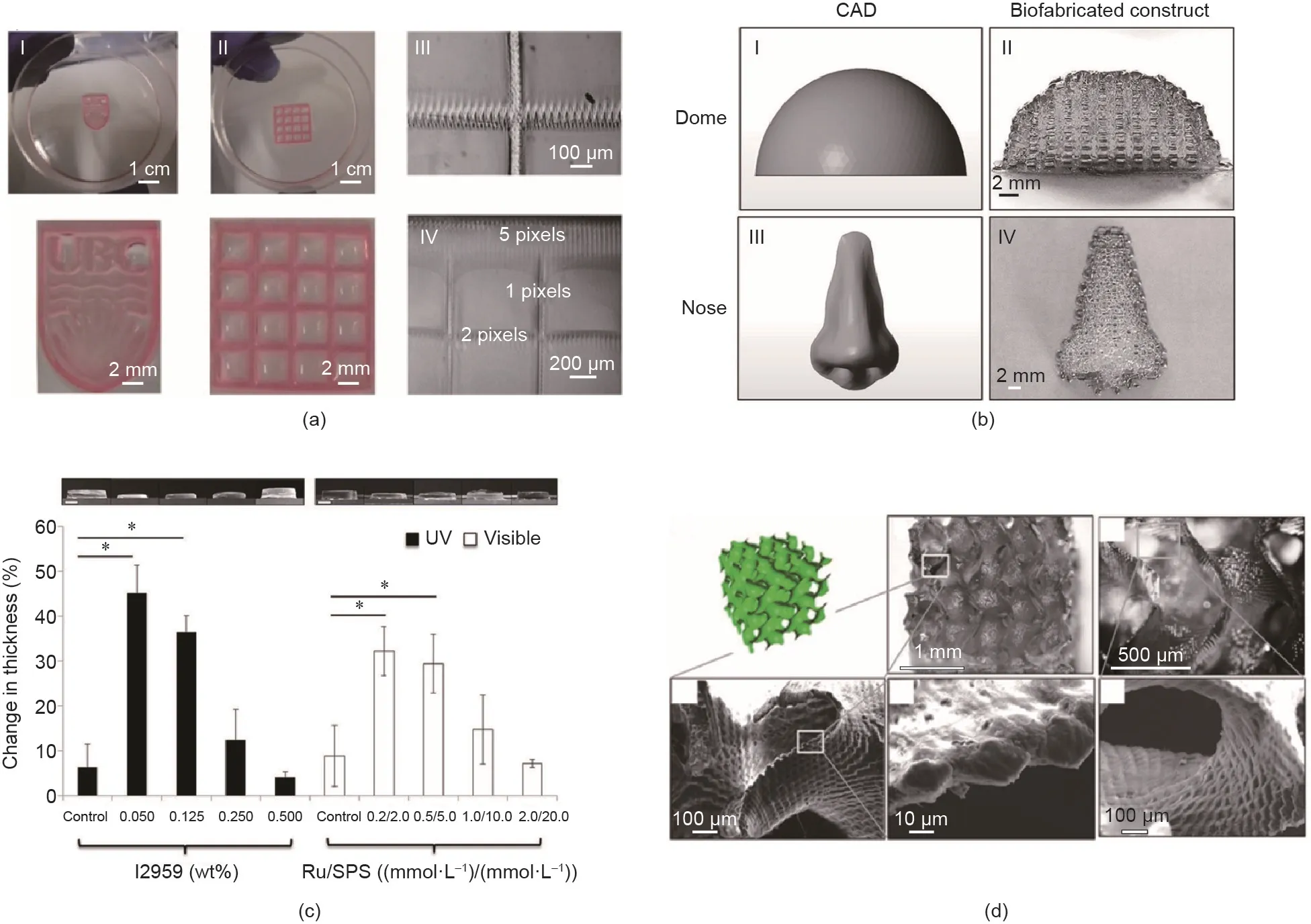
图8. (a)可见光诱导立体光刻法制备水凝胶结构。转载自参考文献[26],经IOP Science许可,©2015。(b)GelMA/Col水凝胶打印的具有连通孔的3D结构。转载自参考文献[39],经American Chemical Society许可,©2016。(c)不同引发剂引发的GelMA/Col水凝胶厚度变化比例。Ru:[Ru(II)(bpy)3]2+。转载自参考文献[39],经American Chemical Society许可,©2016。(d)螺旋二十四面体,展现打印的复杂程度。*:P < 0.05。转载自参考文献[27],经IOP Science许可,©2019。
3.4.2. 药物输送
3D生物打印技术,特别是基于喷墨打印技术,已被应用于药物输送治疗。3D生物打印技术为传统片剂制造技术提供了一个可行的替代方案:根据基因组和病理生理学特征定制个性化剂型。此外,利用生物打印技术可以方便地设计片剂的形状,从而控制药物的释放。如由紫外线交联PEGDA和N-乙烯基吡咯烷酮(NVP)制成的药片,通过3D喷墨打印来控制用于治疗高血压和心力衰竭的卡维地洛的释放[107]。然而,紫外线会影响活性药物成分的稳定性。可见光诱导喷墨生物打印是一种更有效的方法。Acosta-Vélez等[29]使用喷墨生物打印技术研发了一种含有亲水性罗匹尼罗的可见光交联降冰片烯修饰透明质酸片剂,用于治疗帕金森病和不安腿综合征。在酸性条件下,罗匹尼罗在15 min内释放60%,适用于口服药物[29]。Acosta-Vélez等[25]开发了一种含有奈普生的经EY引发的可见光固化的PEGDA片剂,该片剂根据配方中PEGDA的含量以及固化生物墨水的光照时间来控制其释放[25]。
4. 结论、挑战和展望
光聚合水凝胶得到了广泛的研究。本文综述了可见光固化3D生物打印方法及可见光引发的光聚合水凝胶的研究现状,总结了引发剂的类型及其活化机理,并研究了从自由基聚合到硫醇-烯烃“点击”反应的直接和间接光诱导反应。本文还综述了近年来可见光交联水凝胶在组织工程中的几种常见生物医学应用。然而,可见光诱导的3D生物打印体系和相应的水凝胶仍具有更多的潜在应用领域。
图9.(a)3D生物打印水凝胶中细胞微丝网络荧光染色图。转载自参考文献[103],经American Chemical Society许可,©2018。(b)3D打印包载成纤维细胞的SF/PEG水凝胶表明形成的角蛋白层。转载自参考文献[105],经Elsevier许可,©2019。(c)STO成纤维细胞与C2C12成肌细胞共培养界面。MyoD1:肌原性调节蛋白。转载自参考文献[94],经Wiley许可,©2019。(d)3D打印水凝胶中空可灌流的螺旋导管结构(直径为1 mm)。转载自参考文献[33],经American Chemical Society许可,©2018。
在过去的几年里,3D生物打印技术取得了显著的进步。由于其发展潜力和应用多样性,光固化3D生物打印技术得到了广泛的研究和发展。光固化3D生物打印技术的发展趋势引人注目。生物打印领域的一些共同挑战必须得到解决。其中包含:①打印设备,特别是打印分辨率、印刷保真度和微观结构复制;②细胞活力,涉及细胞营养和供氧;③生物墨水性能,包括物理强度和生物相容性。此外,在可见光诱导的3D生物打印领域,我们还必须解决光聚合速度和打印结构保真度的问题。这些问题可以通过改善光聚合水凝胶的性能来实现。
可见光交联材料比紫外线诱导的光聚合水凝胶具有更好的性能和更高的应用潜力。虽然可见光比紫外线的细胞毒性低,但它也有局限性。普通可见光引发剂的活化一般需要共引发剂和共单体的存在。例如,EY活化需要三乙醇胺作为共引发剂,NVP作为共单体。因为它们需要在相对较高的浓度下进行,而且由于共引发剂的细胞毒性,它们的应用受到了限制。应该在不增加细胞毒性的情况下,通过提高凝胶效率来克服这一缺点。解决这一问题的方法之一是提高光强或减少含有多官能团的链。成功克服这些问题后,可见光诱导的3D生物打印可以有效地集成到组织工程中。
3D生物打印和组织工程在方法和材料方面取得了相当大的进展。可见光交联水凝胶可以像紫外线交联水凝胶一样快速地进行光聚合,从而实现适当的机械强度和所需的空间结构。因此,这些水凝胶已经成为3D生物打印和组织工程的通用生物材料平台。近年来的进展赋予了可见光交联水凝胶诸多优点,如与不同类型细胞的高细胞相容性、通过结构调节强度和更廉价的交联装置。此外,可见光生物打印还有许多潜在的应用领域,如疾病模型和药物筛选。与在培养皿中培养相比,生物打印技术能更方便地在体外观察细胞在3D空间内的动态通信行为。水凝胶模拟ECM的组成,可以精确模拟体内的动态变化以及自然组织的功能[78]。此外,光聚合水凝胶在空间布局上的微观结构设计和调整也更加方便。总体而言,可见光诱导的生物打印对未来的组织再生和生物医学工程具有很高的价值。
致谢
本研究由广东省重点领域研发计划项目(2019B010941001)、深圳市工业和信息化局创新发展产业双链项目(201908141541)、深圳市基础研究专项基金项目(GJHZ20170314154845576和GJHS20170314161106706)支持。
Compliance with ethics guidelines
Zizhuo Zheng, David Eglin, Mauro Alini, Geoff R.Richards, Ling Qin, and Yuxiao Lai declare that they have no conflict of interest or financial conflicts to disclose.

