新冠病毒肺炎抗体应答、细胞因子的动态变化及其与生存状况的关联
——一项回顾性队列研究
刘莉,陈亨贵,李莹,李辉军,李娇元,王意,姚霜,秦川,童书韬,袁旭,罗霞,缪小平,潘安,*,刘争*,程黎明,*
a Department of Epidemiology and Biostatistics, Ministry of Education Key Laboratory of Environment and Health, School of Public Health, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
b Department of Laboratory Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
c Department of Neurology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
d Department of Otolaryngology-Head and Neck Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
1. 引言
由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的新冠病毒肺炎(COVID-19,简称新冠肺炎)是百年一遇的重大传染性疾病。截至2020年9月4日,新冠肺炎确诊病例已超过2600万,世界范围内的死亡人数超过86万[1]。新冠肺炎患者的临床特点已得到广泛认识[2-5]。此外,越来越多的研究发现,病毒载量对病毒的活跃复制程度有作用。因此,病毒载量检测常用于监测疾病进展、治疗效果与复发状况[6-9]。对新冠肺炎患者而言,病毒抗原特异性抗体反应的出现,揭示了免疫球蛋白G(IgG)与免疫球蛋白M(IgM)的早期和同步血清学转化,及其在发病一个月内的短期变化特征[10,11]。然而,发病一个月后,病毒载量的动态变化及机体对新冠病毒的免疫应答情况还鲜为人知。此外,抗体应答与新冠肺炎患者临床结局之间的关系还有待进一步研究。
约20%的新冠病毒感染病例会出现严重的疾病表现[12]。在新冠肺炎重症病例中,细胞因子释放综合征(cytokine release syndrome, CRS)较为常见。血清白细胞介素6(interleukin-6, IL-6)和C反应蛋白(CRP,一种由IL-6驱动的蛋白)的升高与急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)和不良预后相关[5,13]。细胞因子水平与新冠病毒的载量有关[14]。总之,新冠肺炎患者的康复能否归因于由机体强劲的抗体应答抑制了细胞因子风暴的假说还有待进一步证实。
鉴于目前亟需可靠的数据来探知血清抗体随时间的变化特征及其在新冠肺炎患者恢复过程中的作用,以用于新冠肺炎相关的临床治疗和预后评估,本研究系统地评估了一项大型队列中新冠肺炎患者体内病毒载量的动态变化及病毒特异性抗体的变化特征,并进一步探索了特异性抗体、炎性细胞因子与新冠肺炎患者生存状况三者之间的关联。
2. 方法
2.1. 研究对象
2020年1月27日至3月24日,从中国武汉同济医院招募了新冠病毒核酸阳性或表现出特异性IgM和(或)IgG血清学转化的患者。由医务人员询问每位患者的发病日期。所有患者的人口学特征和入院日期均摘自临床病历记录。根据国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》,我们将新冠肺炎病例划分为轻型、普通型、重型和危重型[15]。在分析时,轻型和普通型新冠肺炎患者被划分为非重症病例,重型和危重型患者被划分为重症病例。轻型和普通型新冠肺炎患者的诊疗方案包括抗病毒治疗、对症治疗和支持疗法。而重型和危重型病例则是在轻型和普通型新冠肺炎患者诊疗方案的基础上,必要时运用氧疗、激素治疗、血浆治疗、机械通气和(或)体外膜肺氧合治疗等。所有纳入病例随访截止至2020年5月11日,且均得到明确的临床结局(即康复或死亡)。此外,我们还通过检索传染病报告信息管理系统(Notifiable Disease Report System),以进一步查证出院患者的生存状况。本研究获得了同济医院医学伦理委员会的批准,符合《赫尔辛基宣言》。因该急性传染病采用电子病历进行调查,医院伦理委员会予以免除签署书面知情同意书。
2.2. 新冠病毒核酸、特异性抗体及细胞因子的检测
在患者住院期间,必要时连续采集新冠肺炎患者的咽拭子、鼻拭子和静脉血标本。检验科采用新冠病毒检测商用试剂盒(中国广州,达安基因),通过定量逆转录聚合酶链反应(quantitative reverse-transcriptase polymerase chain reaction, qRT-PCR)对核苷酸蛋白(N)和开放阅读框1ab(ORF1ab)基因进行检测[16]。根据Genbank数据库上发布的新冠病毒核酸序列(MN908947.3),对刺突蛋白和核衣壳蛋白的融合蛋白进行表达并纯化,构建可用于IgM和IgG免疫检测的重组新冠病毒抗原。采用化学发光免疫分析试剂盒(中国深圳,亚辉龙生物),检测血清中的特异性新冠病毒抗体IgM和IgG。抗体浓度大于或等于10 AU·mL−1即为阳性。附录A提供了核酸检测的阳性标准及抗体检测的特异性。血清炎性细胞因子的检测包括IL-6、白细胞介素1β(IL-1β)、白细胞介素2受体(IL-2R)、白细胞介素8(IL-8)、白细胞介素10(IL-10)和肿瘤坏死因子-α(TNF-α)的检测。
2.3. 统计方法
在主分析中,仅纳入新冠病毒核酸阳性的患者,但在敏感性分析中,还纳入了新冠病毒核酸阴性但存在病毒特异性IgM和(或)IgG血清学转化的人群。用中位数[四分位数间距(interquartile range, IQR)]来描述连续型变量的分布,用频率(百分数)表示分类型变量的分布。计算患者住院期间血清样本每周的阳性检出率及病毒特异性抗体浓度,并酌情使用χ2检验、Fisher确切概率法、Kruskal-Wallis检验和Mann-WhitneyU检验进行比较。绘制患者每日病毒载量[循环阈值(cycle threshold, Ct)]、抗体的阳性检出率及对数转换后的抗体和细胞因子浓度。另外,使用局部加权回归散点平滑法(locally weighted scatter plot smoothing, LOWESS)对图形进行拟合——这是一种基于局部多项式拟合抗离群值的方法,能避免少量离群值对结果的扭曲。LOWESS不需要特定函数来使模型适用于样本中的所有数据。相反,它需要庞大且密集采样的数据集来生成合适的模型[17]。鉴于N基因的检出率高于ORF1ab基因,我们使用N基因的Ct值代表新冠病毒的Ct值。为了更好地揭示病毒载量的动态变化,绘制趋势曲线时设定Ct值40为新冠病毒载量的检出限。根据所有患者中每个炎性细胞因子浓度的上四分位数将每个患者的炎性细胞因子重新分为2组(0表示低于上四分位数组,1表示高于上四分位数组),用于建立细胞因子评分[18]。6个细胞因子总评分在3~6分的患者被认为处于高炎症状态,总评分为0~2分的患者被认为处于低炎症状态。通过中介分析[19],判断细胞因子得分是否介导了病毒特异性抗体与新冠肺炎患者生存状况之间的关联。所有统计分析都基于双侧检验,P值小于0.05被认为具有统计学意义。统计学分析使用Stata MP 16.0软件(StataCorp,College Station,美国)。
3. 结果
3.1. 新冠肺炎患者的血清学转化
本研究共招募了1830例患者,其中1435例(78.4%)为新冠病毒核酸阳性患者,另外395例(21.6%)为核酸阴性人员但其特异性抗体呈阳性。1435例新冠病毒核酸阳性患者的年龄中位数为61岁(IQR:50~69岁),其中男性有683例(47.6%)。这些患者中的334例(23.3%)为重症病例,1101例(76.7%)为非重症病例。在院期间,共49例(3.4%)患者死亡,他们(本文称为病亡患者)住院天数的中位数为23 d(IQR:17~40 d)。在1435例新冠病毒核酸阳性患者中,有35例(2.4%)住院期间未出现IgM或IgG的血清学转化。未观察到IgM或IgG血清转化率因年龄、性别或疾病严重程度不同而有明显差异。病亡患者的IgM血清转化率略低于出院患者(71.4% vs.82.3%,P= 0.053)(表1)。在重型/危重型患者中,65.8%和5.9%的患者分别接受了激素治疗和单克隆抗体治疗。在1830例患者中,观察到类似的抗体应答反应(见附录A中的表S1)。与新冠病毒核酸阳性患者相比,核酸阴性而抗体阳性人群死亡的可能性更低(2.0% vs. 3.4%)。
3.2. 新冠病毒特异性抗体的动态变化
共收集了来自1435例新冠肺炎患者的3456份血液样本进行抗体检测。其中,505名、402名、236名、158名和134名患者分别接受了1次、2次、3次、4次和大于或等于5次的血清学检测。动态分析时,排除了2例发病日期不明确患者的5份血液样本。此外,为避免离群值效应,将收集的4例患者在发病84 d后的7份抗体检测血清也予以剔除。在发病第1周收集的血清样本中,有51.9%未表现出IgM或IgG血清学转化,但在第3周时这个比例迅速降至5.0% [图1(a)]。发病后每周IgM和IgG的阳性检出率见图1(b)和表S2。不同年龄、性别或疾病严重程度的组别间,IgM和IgG的每周阳性检出率是相当的[图1(c)~(e)]。病亡患者组的IgM阳性检出率从第2周开始下降,直至第11周基本消失。然而,出院患者组中,IgM的血清阳性率在前3周内上升,第4~6周达到峰值(约80%),随后逐步下降至第12周的60%左右[图1(f)]。在重症病例中,这种出院和病亡患者组间的抗体变化趋势差异依然存在[图1(g)]。在1830例患者中,也能观察到类似的血清学转变模式(见附录A中的图S1)。
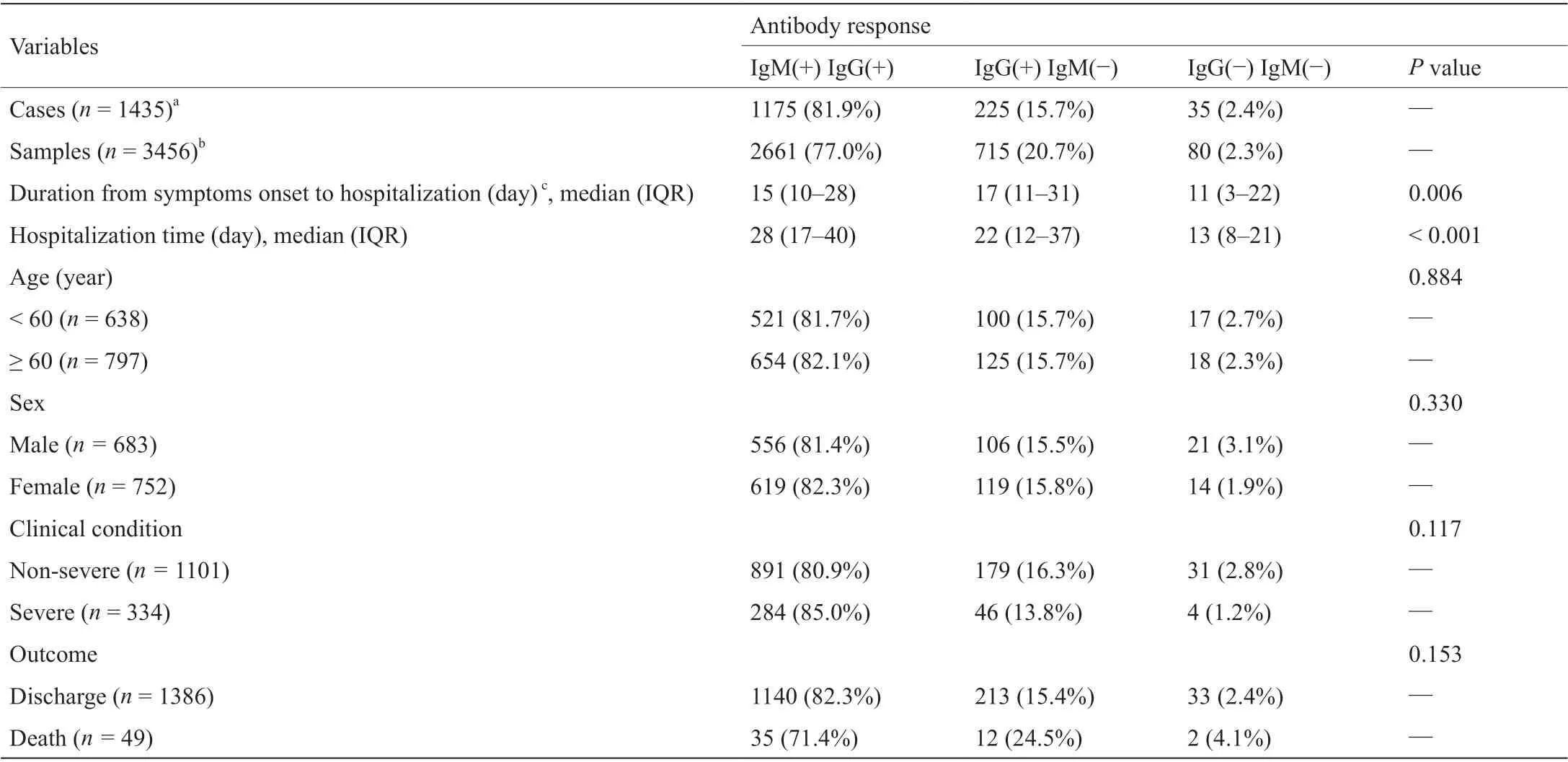
表1 新冠病毒核酸阳性患者的抗体应答情况
与病亡患者组相比,出院患者组的IgM和IgG水平呈显著性提高(P< 0.001,见表S3)。在前5周,随着病毒载量的下降,病毒特异性抗体的浓度逐渐增加。在所有新冠病毒阳性病例中,IgG水平在第5~12周内基本维持在180 AU·mL−1左右。然而,平均IgM水平在第12周降至临界值10 AU·mL−1[见表S4和图2(a)]。未观察到这种抗体变化趋势在年龄、性别和疾病严重程度分层中的明显差异[图2(b)~(d)]。在出院的患者中,发病后第12周,IgM水平缓慢下降至约18.4 AU·mL−1,而IgG水平基本维持在187.8 AU·mL−1左右。相反,在病亡患者中,IgM在第7周就降到了临界值10 AU·mL−1,IgG在第12周也下降至87 AU·mL−1左右[图2(e)和表2]。即使在重症病例中,IgM和IgG抗体谱的时间变化特征在不同临床结局的患者中也基本类似[图2(f)]。在1830例患者中,新冠病毒载量及其特异性抗体也表现出了类似的动态变化特征(见图S2)。与新冠病毒核酸阳性的患者相比,新冠病毒核酸阴性患者的IgG水平更高[见图S2(b)]。
3.3. 细胞因子在病毒特异性抗体与临床结局关联中的中介效应
附录A中的表S5列出了每种细胞因子每周检测次数的分布情况。与出院患者组相比,病亡患者组的IL-6、IL-8、IL-10、IL-1β、IL-2R和TNF-α水平均较高[所有P< 0.001,图3(a)~(f)]。在根据生存结局对重症患者进行分组时也观察到类似的细胞因子分布差异(见图S3)。在有细胞因子检测数据的1131例患者中,251例被归为处于高炎症状态(细胞因子评分≥3)。未观察到高炎症状态在IgM [每标准差(standard deviation, SD)增加]与生存状况的关联中具有统计学显著的中介效应[图3(g)]。然而,高炎症状态在IgG(每SD增加)和生存状况关联中的中介效应占比为12.5% [总效应:优势比(odds ratio, OR)为0.43;95%置信区间(CI):0.28~0.67;间接效应:OR为0.90;95% CI:0.87~0.95] [图3(h)]。
4. 讨论
在本研究中,约有一半的患者在发病后第1周出现了新冠病毒特异性抗体的血清学转换,这与先前报道的37%~60%血清转化率大体相当[11,20-22]。随后,发病第3周时的血清转化率达到95%。这与西班牙全国新冠病毒流行率的调查结果一致,该调查表明从聚合酶链反应(PCR)检测结果呈阳性后的第14天,血清阳性率接近90% [23]。此外,我们还发现IgM和IgG的滴度在第5周达到峰值,此后开始降低。这一发现也得到了先前研究的支持,先前研究揭示了IgM和IgG阳性率最高分别出现在第4周和第6周[22]。在一项基于人群的调查中也观察到新冠病毒特异性抗体的下降[24]。据巴西前后两次全国血清学家庭调查显示,与第一次调查中观察到的最高流行率相比,一个月后在巴西布雷维斯的第二次调查发现新冠病毒抗体下降了近50%。推测可能在两次调查期间,前一次检测阳性患者的血清滴度已降至检测的阈值以下。这种血清学下降在新冠病毒无症状感染者中较为常见,40%的患者在8周后血清学检测呈阴性[25]。由于本研究的参与者均为有症状的患者,因此抗体滴度下降得相对缓慢。在这些患者中,35例(2.4%)在院期间未出现血清学转化。最近一项研究也发现63名患者中有2名在院期间始终维持着IgG和IgM的阴性状态[11]。因此,有理由推测,极少数新冠病毒感染病例可能在免疫学上呈现无反应性,这也意味着在某些人体内可能难以诱导出清除新冠病毒的免疫反应[26]。
先前的研究表明,新冠病毒的初始载量与疾病预后相关[27]。本研究中,新冠肺炎病亡患者的初始病毒载量比出院患者更高。与出院患者的IgM从第5周到第12周缓慢下降相比,病亡患者的IgM水平下降得更加迅速。此外,与出院患者的IgG维持在高水平不同,进展为死亡的患者IgG水平从第5周开始下降。考虑到IgM是抵御病毒感染的第一道防线,而IgG代表着机体对抗新冠病毒的主要体液免疫[28],可以推断,抗体的快速消除可能会导致不良临床结局。令人担忧的是,既往研究发现靶向对抗中东呼吸综合征(Middle East respiratory syndrome, MERS)冠状病毒刺突蛋白受体结合域的中和单克隆抗体可增加病毒的入侵[29],故有研究推测新冠病毒感染也可能出现抗体依赖的增强作用(antibody-dependent enhancement, ADE)[30]。然而,本次队列研究发现,与病亡患者相比,在出院人群中包括重症患者,都能观察到显著提高的IgG水平及其血清阳性率,这提示新冠病毒的ADE可能并不是决定临床结局的关键,而维持高水平的IgM和IgG可能才是更快康复的指标。

图1. 新冠病毒核酸阳性患者的特异性IgM和IgG检出率的动态变化。(a)抗体每周检出率;(b)自发病起IgM或IgG抗体检出率的动态变化;(c)~(f)不同年龄、性别、疾病严重度、临床结局新冠肺炎病例自发病起IgM或IgG抗体检出率的动态变化;(g)不同临床结局的重症新冠肺炎病例自发病起IgM或IgG抗体检出率的动态变化。从1435例新冠病毒核酸阳性病例中,累积收集3456份血清学样本。在动态分析时,排除了2例发病日期不明确患者的5份血液样本。此外,为避免离群值效应,将收集的4例患者在发病84 d后的7份抗体检测血清也予以剔除。故最终3444份血清样本被纳入新冠病毒抗体检出率的趋势分析。
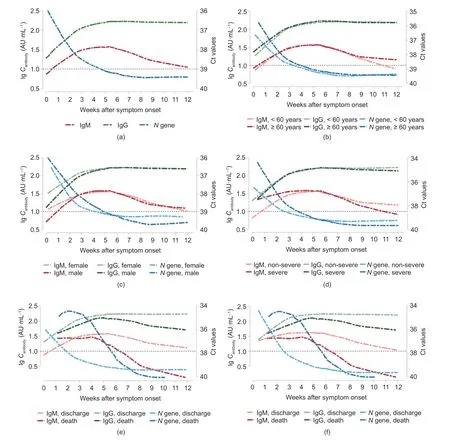
图2. 新冠病毒核酸阳性患者的IgM、IgG及病毒载量的动态变化。本分析共纳入3444份血清样本及4062份口咽/鼻咽拭子样本。(a)自发病起,IgM、IgG浓度及病毒载量的动态变化;(b)~(e)不同年龄、性别、疾病严重程度、临床结局的新冠肺炎病例自发病起,IgM、IgG浓度及病毒载量的动态变化;(f)不同临床结局的重症新冠肺炎病例自发病起,IgM、IgG浓度及病毒载量的动态变化。横线代表IgM或IgG浓度对数的阳性界值(≥1,阳性;<1,阴性)。Cantibody:抗体浓度。
重症及预后不良新冠肺炎患者的I L-6 水平较高[12,31],提示疾病的进一步恶化可能归咎于病毒驱动的过度炎症反应。据报道,重症监护病房(intensive care unit, ICU)新冠肺炎患者的IL-10和TNF-α水平高于非ICU的新冠肺炎患者[32]。本研究表明这些细胞因子在IgG与疾病预后的关联上发挥了中介效应。尽管先前没有流行病学研究探讨过细胞因子对抗体与预后关联的中介效应,但最近有研究支持性地表明,利用含有高滴度新冠病毒特异性抗体(IgG)的恢复期血浆进行治疗有助于提高IgG水平,降低CRP和IL-6水平,从而改善新冠肺炎患者的临床表现[33-36]。
本研究有如下优点:第一,基于这项1800多例新冠肺炎患者的大型队列研究,揭示了从发病至12周内机体抗体应答的动态变化特征。与先前的研究相比,本研究样本量更大,随访时间更长,确保了结论的准确性。第二,本研究首次发现机体对新冠病毒的抗体应答越强,越有助于提高新冠肺炎患者的生存状况,且这种保护作用与疾病的严重程度无关。这表明对新冠肺炎患者,尤其是重症病例,监测抗体水平的重要性。这一发现从某种程度上也消除了临床上使用恢复期血浆治疗时,对感染新冠病毒后出现ADE的担忧。第三,我们首次报道了细胞因子对较低IgG与较差存活结局关联的中介效应,这可以部分解释新冠病毒免疫应答带来的保护作用。
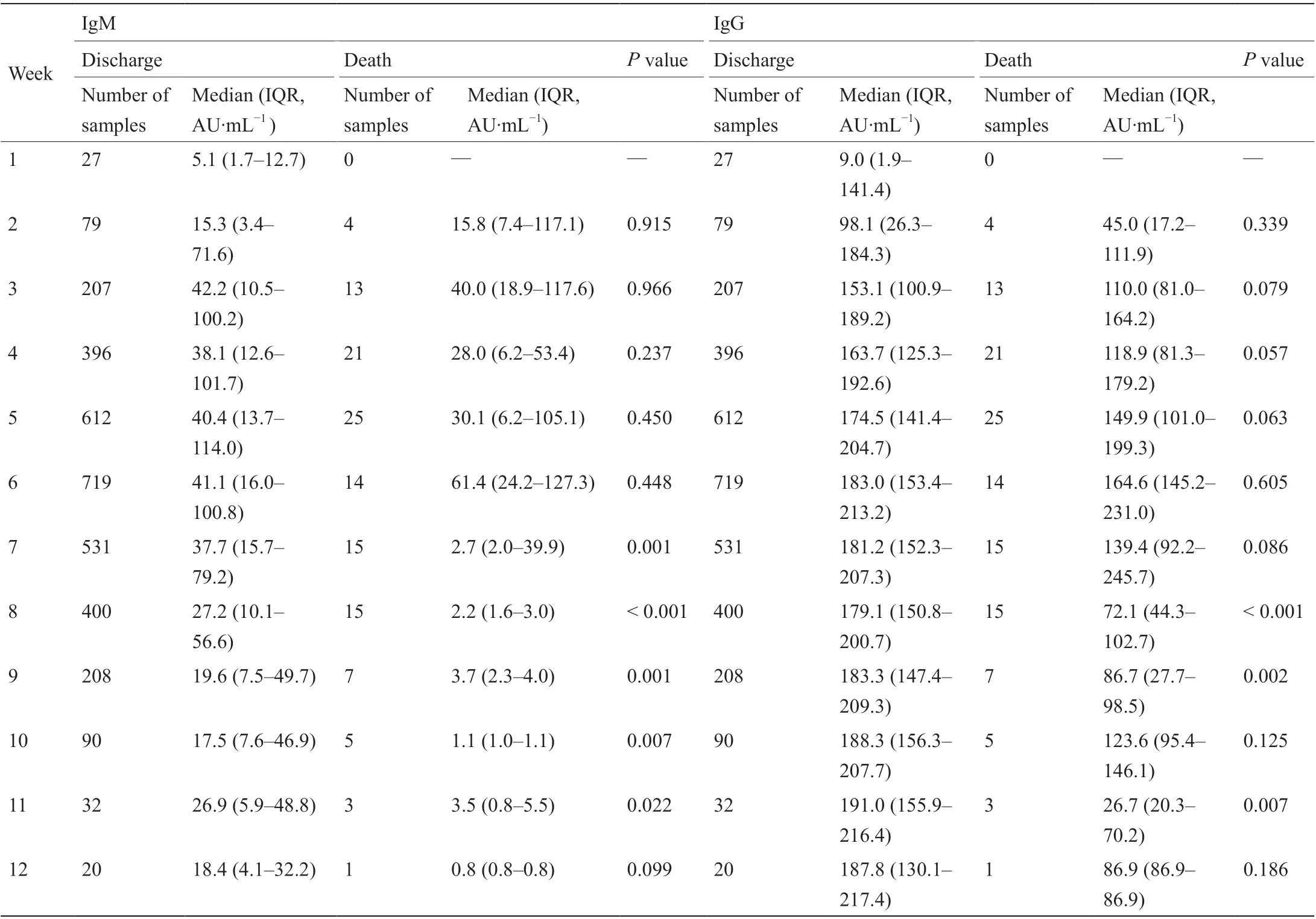
表2 不同临床分组的新冠病毒核酸阳性患者的每周IgM和IgG浓度比较(n = 3444)a
本研究也存在一些局限性。第一,在发病的较早时期和较晚时期,收集的标本量有限,因此在解释这段时期的数据时应当谨慎。第二,细胞因子对抗体应答与临床结局之间关联的中介效应是基于流行病学数据提出的,还需进行进一步的功能研究来揭示其潜在机制。第三,尽管未发生特异性抗体血清学转换的患者住院时间更短,但发生与未发生血清学转换的患者在院期间的平均采样数是相当的(平均2.4人次/例 vs. 2.3人次/例)。因此,住院时间过短可能并不会导致无法观察到血清学转换。第四,干扰素(interferon, IFN)系统在抗病毒防御中起着举足轻重的作用,可能是决定新冠病毒感染结局的关键性因素[37];但本研究中没有相关数据(如IFN-α或IFN-β),在未来的研究中应考虑。
5. 结论
作为一种新兴传染病,人们对新冠病毒的了解程度远不如其他广泛存在的病毒那么透彻。本研究揭示了新冠病毒感染患者体内抗体随时间的动态变化特征,以及抗体应答对生存状况的保护作用,这可能有助于指导新冠肺炎患者的预后监测。

图3. 细胞因子的动态变化及其在疾病预后和IgM/IgG关联中的介导效应。(a)~(f)不同临床结局新冠病毒核酸阳性患者IL-6、IL-8、IL-10、IL-1β、IL-2R及TNF-α浓度的动态变化。C:浓度。(g)IgM抗体与新冠肺炎病例生存关联的中介分析。OR:比值比;CI:置信区间。(h)IgG抗体与新冠肺炎病例生存关联的中介分析。根据每个炎性细胞因子浓度的上四分位数将每个患者的炎性细胞因子重新分为2组(0表示低于上四分位数组,1表示高于上四分位数组)。基于6个细胞因子得分建立细胞因子评分。细胞因子评分大于或等于3为高炎症状态,细胞因子评分小于3为低炎症状态。所介导的比例为直接效应的对数值除以总效应的对数值。所有模型均调整了年龄、性别、激素治疗及单克隆抗体治疗情况。
致谢
本研究获得了国家自然科学基金(81572017)、国家重点研发计划项目(2016YFC1302702、2020YFC0860800)、中国科学技术协会支持湖北疫后重振项目(20200608CG111311)、武汉市卫生健康委员会关于新冠肺炎疫情防控应急科研专项(EG20M01)的支持。上述资助机构未参与研究设计、数据收集和分析、结果解释、论文写作及投稿工作。
Compliance with ethics guidelines
Li Liu, Heng-Gui Chen, Ying Li, Huijun Li, Jiaoyuan Li, Yi Wang, Shuang Yao, Chuan Qin, Shutao Tong, Xu Yuan, Xia Luo, Xiaoping Miao, An Pan, Zheng Liu, and Liming Cheng declare that they have no conflict of interest or financial conflicts to disclose.
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2021.04.015.

