光芬顿深度处理制药废水的参数影响研究
祁浩杰,马 磊,邢佳枫,陈 平
(1.天俱时工程科技集团有限公司 陈平实验室,河北 石家庄 050000;2.北京石油化工学院 化学工程学院,燃料清洁化及高效催化减排技术北京市重点实验室,北京 102617)
0 引言
随着我国工业化的快速推进,环境监管的日趋严格,制药废水的环境问题日益突出。制药废水中盐含量高、毒性大、有机污染物结构复杂,使其降解极为困难[1]。传统的生物处理方法一般不适用于制药废水的处理[1-2]。制药废水不经处理直接排放到环境中,将严重威胁着水生生物和人类的生命安全。为解决制药废水无害化问题,对制药废水的深度无害化处理进行了大量研究,开发出了一套“光芬顿氧化+电氧化+生化法”处理制药废水工艺。该工艺首先通过光芬顿氧化体系去除废水中约40%的COD,再通过电催化氧化工艺进一步去除40%COD,电氧化通过“A+O”工艺处理至出水。目前该工艺已在多家制药厂推广使用,效果良好。研究发现要保障该套工艺的稳定运行,第一步光芬顿氧化过程的COD 去除率应达到40%以上。
光芬顿氧化过程是一种在传统芬顿法基础上改进的极为有效的高级氧化法处理工艺,将有机污染物氧化为更容易生物降解的副产物,降低对下游生物处理工艺微生物的整体毒性,进而可与生化处理工艺相结合[2-3]。
光芬顿过程由经典的芬顿反应开始(无需光照),见公式(1)和公式(2)。Fe2+引起过氧化氢(H2O2)的快速分解,生成高活性羟基自由基(HO·),这些羟基自由基能够降解大部分有机污染物。同时,Fe3+可以通过类芬顿反应被H2O2还原为Fe2+,从而使HO·连续产生[4-12]。

在紫外光作用下,光芬顿体系产生一系列其他反应[6-11]。主要包含:溶液中Fe3+和Fe(OH)2+在紫外光作用下生成可用于芬顿反应的Fe2+,并产生羟基自由基,见公式(3)和公式(4)。H2O2能够在紫外光作用下直接分解产生羟基自由基,见公式(5)。另外,当溶液中存在SO42-和Cl-时,溶液中所形成的络合物Fe(Cl)2+,FeSO4+在紫外光作用下可以光解生成用于芬顿反应的Fe2+和应用于降解有污染物的氧化性Cl·及SO4-·自由基,见公式(6)和(7)。

操作条件是选择降解特定化合物最合适的氧化工艺要考虑的关键因素[4]。光芬顿体系的降解效率显著高于传统芬顿法,在成本效益和易操作性方面有很好的发展前景。
在实验室条件下,将光芬顿氧化法作为制药废水的一种有效预处理工艺,以探究其预处理某药厂制药废水的适用性。考察相关操作参数(初始pH值、Fe2+浓度、H2O2投加量、Cl-浓度和SO42-浓度)对光芬顿体系中制药废水COD 去除效果的影响,从而获得最佳的工艺条件,为随后的电催化和生化处理奠定基础。
1 材料与方法
1.1 实验仪器与试剂
主要仪器:pH 计(PHS-3C,杭州雷磁分析仪器厂);电子分析天平(ATX239,日本岛津公司);磁力搅拌器(84-1A,上海梅颖浦仪器仪表制造有限公司);紫外灯254 nm/15 W(ZW23D15W-436,广东雪莱特光电科技股份有限公司);COD 分析仪(5B-3C(V8),兰州连华环保科技有限公司)。
主要试剂:浓硫酸(质量分数为98% H2SO4,AR)、浓盐酸(HCl,AR)和过氧化氢(质量分数为30%H2O2,AR)(天津市科密欧化学试剂有限公司);氯化钠(NaCl,AR)、硫酸钠(Na2SO4,AR)和硫酸亚铁(FeSO4,AR)(天津市大茂化学试剂厂);以上药品均未进行纯化。
1.2 实验水样
制药废水原水(河北某制药集团有限责任公司):COD 质量浓度为19 266 mg/L;pH 值=8.9;NH4+-N质量浓度为292 mg/L;TN 质量浓度为1 134 mg/L 和总盐质量浓度为2 330 mg/L。
1.3 实验方法
取900 mL 制药废水原水置于烧杯中。在原水磁力搅拌过程中,根据实验要求加入适量的浓H2SO4/浓HCl(调节pH 值)和H2O2及FeSO4。随后打开紫外灯进行光芬顿氧化反应。
每隔1 h 取样进行COD 测试,计算溶液中COD的降解效率,计算公式如下:

式中:C0和Ct分别为初始时和时间t 时制药废水中COD 的测试值,mg/L。
2 结果与分析
2.1 废水中初始pH 值
向废水中加入适量质量分数为98%的H2SO4以调节其不同的pH 值来探究光芬顿体系中制药废水的COD 去除效果。不同pH 值下光芬顿体系中制药废水的COD 去除率见图1(实验条件:900 mL 的制药原水;Fe2+质量浓度为600 mg/L;100 mL H2O2;紫外光)。由图1可以看出,随着废水初始pH 值上升,废水中COD 去除率呈先增后减趋势。当pH 值从1升至3 时,制药废水COD 去除率明显上升,pH 值=3 时,COD 去除率达到最大,为50%。但随着pH 值进一步升高,废水中COD 去除率开始明显下降。推断原因是因为在较低的pH 值下,Fe3+的浸出率较高,并且有大量的光活性物质(Fe3+,Fe(OH)2+和Fe(OH)2+)生成,有利于更快的光芬顿反应。pH 值=1 时,反应速率较低,主要是由于溶液中过量的H+可作为羟基自由基的清除剂。在较高的pH 值条件下,H2O2稳定性较差,容易自行分解生成H2O 和O2[5-6]。同时更多的OH-将占据Fe3+的位点,Fe3+和H2O2之间的相互作用将被抑制,从而降低羟基自由基的生成,致使反应速率下降[7]。然而,在pH 值进一步提升过程中(pH值=6,7),COD 去除率相对于pH 值=5时进一步提高,推断原因是因为随着pH 值的升高,溶液中大量生成的Fe(OH)2和Fe(OH)3有絮凝作用,产生有机物絮凝沉淀,从而降低制药废水中的COD[8]。在高pH值光芬顿降解体系中,研究发现水中的絮状沉淀物并未完全沉降,给后续的催化降解过程带来挑战。结果表明,较低的pH 值有利于光芬顿体系中制药废水COD 的去除,最优pH 值=3(与芬顿体系中最优pH 值为3 一致)。

图1 不同pH 值下光芬顿体系中制药废水的COD 去除率
2.2 Fe2+浓度
在含有不同质量浓度(100~800 mg/L)的Fe2+溶液中,探究光芬顿体系中制药废水的COD 去除效果,在不同Fe2+浓度下光芬顿体系中制药废水中COD 去除率见图2(实验条件:900 mL 的制药原水;pH 值=3(加入适量质量分数为98%H2SO4调节pH值);100 mL H2O2;紫外光)。由图2可以看出,随着Fe2+浓度的增加,制药废水中COD 去除率和反应速率得到明显提升。这是由于随着溶液中Fe2+浓度的增加,提升了Fe2+与H2O2碰撞的可能性,促进了芬顿反应的发生。芬顿反应引起过氧化氢(H2O2)的分解,生成高活性羟基自由基(HO·),能够将废水中大量有机物质降解,使得废水中COD 浓度降低。但是,当Fe2+质量浓度达到600 mg/L 后再增加Fe2+质量浓度值,制药废水中COD 去除率也没有显著变化。这是因为Fe2+与H2O2反应生成大量HO·的同时,过量的Fe2+自动消耗掉大量的羟基自由基。此外,过量的Fe3+提高了废水色度,限制光进入反应介质,从而影响Fe2+的再生,以致于降低降解反应效率[9-11]。因此,在去除制药废水中COD 的光芬顿体系中,溶液中最佳Fe2+质量浓度为600 mg/L。

图2 不同Fe2+浓度下光芬顿体系中制药废水中COD 去除率
2.3 H2O2 投加量
为探究H2O2对光芬顿体系中制药废水COD 去除效果的影响,将不同量的H2O2投加到废水中。不同H2O2投加量下光芬顿体系中制药废水的COD 去除率见图3(实验条件:900 mL 的制药原水;pH 值=3(加入适量质量分数为98%H2SO4调节pH 值);Fe2+质量浓度为600 mg/L;紫外光)。由图3可以看出,质量分数为30%的H2O2投加量分别为30,50,70 和100 mL 时,制药废水中COD 去除率分别为30.71%,34.29%,40.68%和49.99%。制药废水中有机物的降解随着H2O2投加量的增加而增强,显著提高了制药废水中COD 去除率。推断原因是由于在H2O2高剂量下,H2O2与Fe2+的芬顿反应产生大量的羟基自由基,提高了降解效果。但是当H2O2的剂量提高到130 mL 时则并没有显著改善制药废水中COD 去除率,推断原因是由于过量的H2O2清除了羟基自由基并生成相对较弱的过氧羟基自由基(HO2·)或进一步产生O2和H2O[9]。基于经济原则选择H2O2的最佳投加量为100 mL。
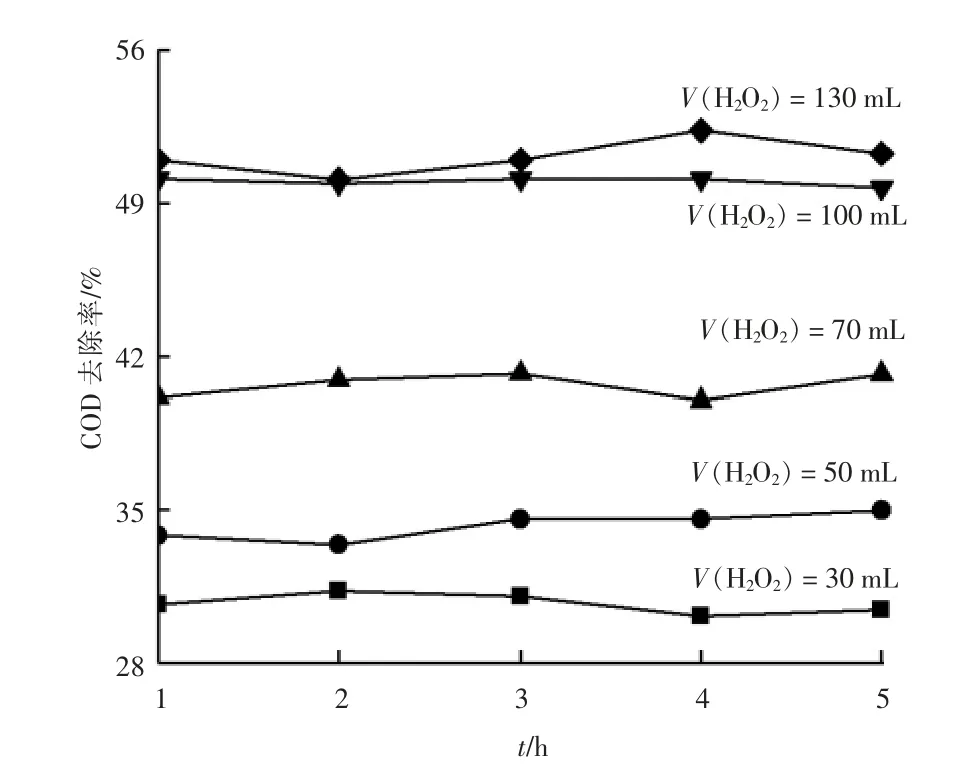
图3 不同H2O2 投加量下光芬顿体系中制药废水COD 去除率
2.4 Cl-浓度和SO42-浓度
为探究光芬顿体系中Cl-浓度对制药废水COD去除的影响,通过调节Cl-浓度进行试验。不同Cl-浓度下光芬顿体系中制药废水中COD 去除率见图4(实验条件:900 mL 的制药原水;pH 值=3(加入适量质量分数为98%H2SO4调节pH 值);Fe2+质量浓度为600 mg/L;100 mL H2O2;紫外光)。由图4可以看出,Cl-质量浓度从0 增至30 g/L 时,制药废水中COD去除率从50.93%降至38.28%。结果表明,反应介质中Cl-的存在大大降低了光芬顿反应降解效果。推断原因是由于在pH 值=3 没有氯盐加入的情况下,Fe(OH)2+是光反应主要的配合物。随着氯盐的加入,Cl-与Fe2+或Fe3+络合生成活性相对较低的络合物(FeCl+,Fe(Cl)2+和Fe(Cl2)+),影响含铁类物质(Fe2+,Fe3+和Fe(OH)2+)的分布和反应性[11]。同时Cl-清除了羟基自由基并形成反应性低于羟基自由基的无机自由基,最终影响制药废水COD 去除的效果[12]。

图4 不同Cl-浓度下光芬顿体系中制药废水COD 去除率
通过改变Na2SO4的投加量调节溶液中SO42-浓度,探究光芬顿体系中SO42-浓度对制药废水COD去除的影响。不同SO42-浓度下光芬顿体系中制药废水COD 去除率见图5(实验条件:900 mL 的制药原水;pH 值=3.0(加入适量浓HCl 调节pH 值);Fe2+质量浓度为600 mg/L;100 mL H2O2;紫外光)。由图5可以看出,由于Na2SO4的存在,光芬顿体系中制药废水中COD 去除率显著上升。COD 去除率没有因为SO42-与Fe3+形成络合物(FeSO4+和Fe(SO4)2-),导致溶液中铁离子(Fe2+和Fe3+)总量减少使得芬顿反应产生的羟基自由基减少而降低。推断原因是因为在pH值=3 的情况下,随着时间的延长水中H2O2消耗殆尽,络合物(FeSO4+和Fe(SO4)2-)成为主要活性物质。活性物质在紫外光照射下可生成高氧化性SO4-·自由基(E0(SO4-·/SO42-)=2.43 V),用于降解水中有机物[11]。同时,水中的铁离子(Fe2+和Fe3+)和SO42-进行循环反应,具有降解性能的持久性[13]。

图5 不同SO42-浓度下光芬顿体系中制药废水COD 去除率
通过对Cl-浓度和SO42-浓度的影响研究,结果对比表明,Cl2-·和SO4-·自由基可能具有选择性[10]。在制药废水进行光芬顿氧化反应中,SO42-有利于化药废水的降解。因此,综合考虑最终确定使用浓硫酸调节废水pH 值。
3 结论
对于难降解制药废水来说,光芬顿氧化体系是一种理想的处理方法,并且可以组合到调节池、沉淀池、光芬顿氧化、电催化氧化和好氧/缺氧活性污泥处理工艺中。通过探究光芬顿体系中操作参数的影响,得出以下结论:①在去除制药废水中COD 的光芬顿体系中,最佳pH 值=3,促进铁离子(Fe2+和Fe3+)的浸出和大量的光活性物质(Fe3+,Fe(OH)2+和Fe(OH)2+)的生成;②最佳溶液Fe2+浓度应选为600 mg/L;③H2O2投加量的增加,有利于对制药废水中有机物的降解,基于经济原则选择最佳添加量为100 mL;④通过对Cl-浓度和SO42-浓度的影响研究,得出SO42-有利于制药废水的降解,最终确定使用浓硫酸调节废水pH 值。在最佳条件下,光芬顿体系对制药废水中COD 去除率高达50%,可为随后的工艺运行提供有利条件。

