烂皮病菌侵染对新疆杨光合特性及碳水代谢的影响
李金鑫,张一南,苗瑞芬,邢军超,李 敏,申宛娜,王 黎,赵嘉平*
(1.中国林业科学研究院林业新技术研究所,北京 100091;2.内蒙古五原县林业和草原局种苗站,内蒙古 巴彦淖尔 015100;3.中国林业科学研究院林业研究所,北京 100091)
环境胁迫以及病原菌侵染会引起植物光合作用以及水分代谢失衡[1-4]。病菌侵染往往会导致植物组织坏死、净光合速率显著降低、碳同化减少、生长放缓甚至出现植物死亡的现象[1,5-8]。叶锈病、叶斑病等通过调节气孔开度以及抑制酶和光合作用中心改变气体交换[9-11];枝干溃疡类病害也远程改变寄主植物的叶部光合特征[12-14]。本课题组前期研究表明溃疡病菌(Botryosphaeria dothidea)、烂皮病菌(Valsa sordida)侵染早中期,新疆杨叶片净光合速率和气孔导度显著下降[15]。病菌对光合作用的抑制会减少光合产物的合成,同时,虽然溃疡类病害主要发生于枝干韧皮部,但也能侵入木质部,并最终在侵染点周围形成坏死性病斑。因此我们推测,溃疡病害的发生不仅可以抑制韧皮部碳水化合物的长距离运输,造成枝干碳饥饿[15],也可能阻碍木质部水分的向上运输[16]。
病原菌可以通过不同的途径影响植物水分代谢,如根腐病原菌可以破坏植物根系,减少水分的吸收[17],而叶部病原真菌通过调控气孔开度影响植物的水分散失[18]。枝干溃疡类病菌侵染会造成气孔导度降低,进而影响寄主叶片的蒸腾速率和水分利用效率[12,14]。研究发现,在榛子(Corylus avellanaL.)和溃疡类病菌(Anisogramma anomal)的互作系统中,临近溃疡病区域的水分运输会受到限制,进而造成溃疡病区域远端的冠层枝枯[16];溃疡病菌(Quambalaria coyrecup)引起桉树(Corymbia calophyllaLindl.)边材功能丧失,进而降低全株导水率[14],即病原真菌造成林木衰亡的原因之一是水力学失败。
碳饥饿、水力学失败以及两者共同作用造成的韧皮部运输功能失败(不包括结构破坏)是干旱导致的树木衰亡的3 种可能途径[19-20]。研究发现,碳饥饿和水力学失败之间彼此影响、相互作用,水分胁迫可以抑制韧皮部碳水化合物的运输,碳水化合物储量下降可能会通过再填充受损导致水力学失败,二者独立或者联合作用提高干旱胁迫下植物的死亡率[20-22]。研究表明,病原菌胁迫引起的林木衰亡与碳饥饿或者水力学失败有关[14-16,23-26]。然而,在病害发展的不同阶段,病菌导致树木死亡的具体方式可能并不相同。我们的研究发现,溃疡病菌侵染通过抑制碳代谢途径整体基因的表达,诱导早期碳饥饿[26];进一步研究发现,病原真菌侵染诱导早中期枝干韧皮部运输功能障碍,但水分运输状况没有明显的改变。然而,多项研究发现,在溃疡类病害发生晚期,树木水分运输状况发生显著改变[14,16],但是,我们认为,病害发生后期出现的水力学失败是碳饥饿导致的结果,而非引起树木衰亡的主要原因。因此,溃疡类病害发生的生理机制仍有很多亟待解决的问题。
本研究以1 年生新疆杨(Populus albaLinn.var.pyramidalis)为植物材料,采用微环割方法接种杨树烂皮病菌,通过测定气体交换参数、光响应曲线、叶绿素荧光、叶片水势以及根部非结构性碳水化合物含量等指标,研究寄主植物光合机制对病害胁迫的响应,枝干病菌侵染对根部碳代谢特征的影响等,揭示烂皮病菌侵染下杨树碳水代谢特征的变化,为树木溃疡类病害的有效控制奠定理论及实验基础。
1 材料与方法
1.1 植物与真菌材料
本研究以1 年生新疆杨扦插苗为植物材料,扦插幼苗在含有混合基质(草炭土∶珍珠岩=6∶1)的塑料花盆中栽培,培养于中国林科院林业新技术研究所植物生理研究室试验地。烂皮病菌(Valsa sordida)菌株CZC[15]实验菌株活化后接种于PDA培养基(pH 6.0),25℃暗培养7 天后接种新疆杨。
1.2 实验设计
选取生长健壮、无病虫害、长势一致的54 株新疆杨1 年生幼苗作为实验材料。实验设置表皮环割接种烂皮病菌(V.sordida)菌株CZC(Vso)、表皮环割接种空白PDA 对照(Ctrl)和未环割对照(UC)共3 个处理,每个处理18 株苗木。Vso 处理方法:用75%酒精对枝干表面灭菌,锋利刀片剥开并去掉距基部30 cm 处杨树枝干环周表皮,高度为1 cm,接种PDA 培养基上培养1 周的V.sordidaCZC 菌块(长3 cm,宽1 cm),封口膜包裹保湿培养;Ctrl 处理方法:将CZC 菌块更换为空白PDA 培养基,其它操作相同。
分别在接种后10、20、30 天(dpi)测定叶片生理指标(光合及气体交换参数、叶绿素荧光参数、正午水势)并收集根部样品以测定非结构性碳水化合物含量,每个处理每次测定6 个生物学重复。光合测定在上午9:00—11:00 完成,正午水势在光合参数测定之后完成。试验期间保持充足的灌水以及适当的管理。
1.3 测定指标
1.3.1 气体交换及光合参数测定 采用Li-6400XT光合仪(LI-COR,Lincoln,USA)测定苗木净光合速率(Pn)、气孔导度(Gs)等指标。测定时采用LED 红蓝光源以及环境CO2浓度,设置光合有效辐射(PAR)1 500 μmol·m−2·s−1、气体流速500 μmol·s−1。光合测定采用杨树自顶部向下第4~6 片成熟叶。根据公式(1)、(2),计算水分利用效率(WUE)和气孔限制值(Ls):


1.3.2 光响应曲线测定 光响应曲线测定于接种后15 天进行,所用光合仪同上,测定时间为上午9:00—12:00。自然光对植物叶片充分诱导后,在2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、0 μmol·m−2·s−1光合有效辐射梯度下,测定植株的净光合速率(Pn),每个处理3 个生物学重复。CO2浓度设置为400 μmol·mol−1,叶室温度和相对湿度同环境参数。
采用非直角双曲线模型,根据公式(3)拟合光合响应曲线:

其中,Pn 为净光合速率(μmol·m−2·s−1),α 为光合响应曲线的初始量子效率,I为光合有效辐射,Pnmax为最大净光合速率(μmol·m−2·s−1),θ为光响应曲线曲角(0 <θ≤ 1),Rd为暗呼吸速率(μmol·m−2·s−1)。
1.3.3 叶绿素荧光参数测定 叶绿素荧光参数采用Li-6400XT 荧光叶室进行测定。将叶片充分暗适应30 min,测定其初始荧光(Fo)、最大荧光(Fm)和PSII 最大光化学效率(Fv/Fm),以及光适应下(20~30 min)的稳态荧光(Fs)、光下最大荧光(Fm)和光下最小荧光(Fo')。叶绿素荧光与光合参数测定选用同一叶片。根据公式(4)、(5)、(6),计算PSII 的实际光化学效率(ΦPSII)、光化学猝灭系数(qP)和电子传递速率(ETR):
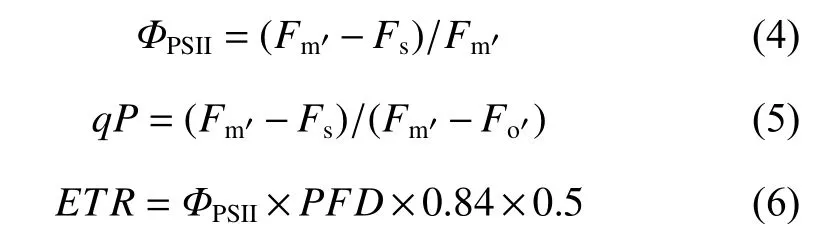
其中,PFD为光子通量密度(μmol·m−2·s−1)。
1.3.4 根部非结构性碳水化合物含量测定 采集植株细根,杀青并烘干至恒质量,研磨、100 目筛过滤后,采用植物可溶性糖和淀粉试剂盒(BC0035和BC0705;Solarbio Life Sciences)测定接种后10、20、30 d 非结构性碳水化合物含量。每个处理测定6 个生物学重复。
1.3.5 叶片正午水势测定 采用SAPSII 植物水势压力室(Model 3115,Sec Instruments,USA)测定叶片正午水势(Midday water potential,Ψmd)。水势与光合参数、叶绿素荧光测定选用同一叶片,水势测定进行3 次,分别在接种后10、20、30 d 的12:00—12:30 完成。
1.4 数据处理
采用R 3.5.0 进行数据统计以及可视化分析,不同处理之间的差异显著性采用One-way ANOVA分析,并用Tukey 检验(P<0.05)进行多重比较,各项统计数据均为平均值 ± 标准误差。本研究对Gs、Ci与Pn,Gs、VPD与Tr,以及Fv/Fm、ΦPSII、ETR与Pn作回归分析,所有拟合均进行T 检验(P<0.001)。
2 结果与分析
2.1 烂皮病菌侵染下新疆杨苗木光合特性
2.1.1 净光合速率、气孔导度、胞间CO2浓度和气孔限制值 除10 dpi(接种后10 天)之外,环割对照(Ctrl)和未环割对照(UC)植株的净光合速率(Pn)和气孔导度(Gs)无显著差异(ANOVA,P>0.05)。与环割对照相比,烂皮病菌侵染(Vso)导致新疆杨叶片的Pn和Gs(10~30 dpi)显著降低,胞间CO2浓度(Ci)(20~30 dpi)显著升高,气孔限制值(Ls)(20~30 dpi)显著降低(ANOVA,P<0.05),且Ls随处理时间呈缓慢下降的趋势,30 dpi 时达到最低值(下降66.5%)。相关性分析揭示Pn和Gs呈正相关(R2=0.91,P<0.001),Pn和Ci呈负相关(R2=0.49,P<0.001)(图1),该结果说明烂皮病菌主要以非气孔限制方式抑制新疆杨的光合作用。

图1 烂皮病菌侵染对新疆杨叶片光合特性的影响Fig.1 Effects of V.sordida infection on photosynthetic characteristics of P.alba var.pyramidalis leaves
2.1.2 烂皮病菌侵染对新疆杨苗木光响应参数的影响 如图2 所示,随光合有效辐射(PAR)的增加,环割对照(Ctrl)、未环割对照(UC)和烂皮病菌侵染(VSo)植株的净光合速率(Pn)均呈上升的趋势;Ctrl 和UC 对照的光响应无显著差异(ANOVA,P>0.05);除0 和50 μmol·m−2·s−1光强外,经VSo 处理的植株净光合速率(Pn)显著低于Ctrl 和UC 对照(ANOVA,P<0.05)。利用非直角双曲线模型拟合曲线并计算相应参数,结果显示烂皮病菌侵染显著降低新疆杨叶片最大净光合速率(Pnmax)(76.9%)及表观量子效率(AQY)(46.1%),并显著升高暗呼吸速率(Rd)(82.1%)及光补偿点(LCP)(242.4%)(ANOVA,P<0.05)(表1)。此外,病菌侵染条件下新疆杨叶片光饱和点(LSP)相比对照显著降低(P<0.05)(表1)。以上结果表明,烂皮病菌侵染严重抑制新疆杨叶片的光合以及利用弱光的能力,同时加快暗呼吸速率。

表1 烂皮病菌侵染下新疆杨苗木光响应曲线拟合参数Table 1 The light response curve parameters of P.alba var.pyramidalis seedlings under the infection of V.sordida

图2 烂皮病菌侵染下新疆杨苗木光合响应曲线Fig.2 Photosynthetic response curve of P.alba var.pyramidalis seedlings under the infection of V.sordida
2.2 烂皮病菌侵染下新疆杨苗木叶绿素荧光特性
接种后10 d,环割对照(Ctrl)植株的实际光化学效率(ΦPSII)、电子传递速率(ETR)及光化学猝灭系数(qP)显著高于未环割对照(UC)植株(ANOVA,P<0.05),除此之外,试验期间Ctrl和UC 对照植株的PSII 最大光化学效率(Fv/Fm)、ΦPSII、ETR及qP均无显著差异。除30 dpi 的qP之外,烂皮病菌侵染(VSo)显著降低新疆杨叶片的Fv/Fm、ΦPSII、ETR、qP(ANOVA,P<0.05)(图3)。以上结果揭示烂皮病菌侵染导致新疆杨叶片PSII 与PSI 之间的电子传递受阻、光能转化效率降低及天线色素捕获的光能用于光化学反应的份额减少,进而导致了新疆杨叶片净光合速率的降低。

图3 烂皮病菌侵染下新疆杨叶绿素荧光参数Fig.3 The chlorophyll fluorescence parameters of P.alba var.pyramidalis under the infection of V.sordida
2.3 烂皮病菌侵染对新疆杨根部非结构性碳含量的影响
结果显示,环割对照(Ctrl)不改变根部组织中非结构性碳水化合物(NSC)含量(ANOVA,P>0.05)。与环割对照相比,烂皮病菌侵染(VSo)显著降低根部组织中可溶性糖(20~30 dpi)和淀粉含量(10~30 dpi)(ANOVA,P<0.05)(图4A、B)。另外,值得注意的是,30 dpi 时,Ctrl 和未环割对照(UC)植株的根部组织中可溶性糖含量显著高于10、20 dpi,同时20、30 dpi 时根部组织淀粉显著高于10 dpi(ANOVA,P<0.05),显示Ctrl 和UC 植株根部组织的NSC 逐渐积累。然而,烂皮病菌处理下,根部组织可溶性糖和淀粉含量在实验期间无显著增加(ANOVA,P>0.05)

图4 烂皮病菌侵染下新疆杨根部非结构性碳水化合物含量Fig.4 Non-structural carbohydrate content in roots of P.alba var.pyramidalis seedlings under the infection of V.sordida
且NSC含量显著低于环割对照Ctrl(P<0.05,图4C),因此,本研究结果显示,烂皮病菌侵染导致根部NSC含量始终维持在10 dpi 时的水平。
2.4 烂皮病菌侵染对新疆杨蒸腾速率、水汽压亏缺、水分利用效率及叶片水势的影响
结果显示,除10 dpi 时的蒸腾速率外,环割对照(Ctrl)和未环割对照组(UC)的蒸腾速率(Tr)、水汽压亏缺(VPD)以及水分利用效率(WUE)、叶片水势(Ψmd)无显著差异(ANOVA,P>0.05)(图5)。然而,与Ctrl 相比,烂皮病菌侵染(VSo)导致新疆杨叶片的Tr和WUE显著降低,VPD显著升高(ANOVA,P<0.05)。接种后10、30 d,烂皮病菌处理与Ctrl 及UC 对照植株水势相同,并且20 dpi 时新疆杨叶片Ψmd显著高于Ctrl(ANOVA,P<0.05)。该结果说明烂皮病菌侵染不仅未造成新疆杨叶片水分状况的恶化,甚至对水分状况有一定改善。

图5 烂皮病菌侵染下新疆杨叶片蒸腾速率、水分利用效率、水汽压亏缺及叶片正午水势Fig.5 Transpiration rate,water use efficiency,vapor pressure deficit and leaf water potential of P.alba var.pyramidalis leaves under the infection of V.sordida
2.5 烂皮病菌侵染下新疆杨生理指标之间的相关性
相关性分析显示,气孔导度(Gs)与蒸腾速率(Tr)呈正相关(R2=0.94,P<0.001)(图6A),而Tr与水汽压亏缺(VPD)呈负相关(R2=0.78,P<0.001)(图6B)。叶片正午水势(Ψmd)与Gs以及VPD均无线性关系(图6C、D),说明烂皮病菌侵染引起的气孔关闭与叶部水分状况无关。净光合速率与Fv/Fm、ΦPSII以及ETR均呈正相关(图7),说明病菌侵染造成净光合速率降低的同时,也影响叶片的光合特性。

图6 烂皮病菌侵染下新疆杨各生理指标的相关性分析Fig.6 Correlation analysis of physiological indexes of P.alba var.pyramidalis under the infection of V.sordida
3 讨论
3.1 烂皮病菌侵染对新疆杨叶片光合特性与根部碳同化的影响
在生物和非生物胁迫下,植物光合机构往往会受到不同程度的破坏[27-28],而叶绿素荧光参数可以作为快速评价植物叶片光合机构、效率是否受损的指标[29]。有研究证实,病原真菌胁迫下寄主植物叶片的最大光化学效率(Fv/Fm)显著降低(如,Melampsora medusae胁迫下的杨树[9]以及Seiridium.cardinale胁迫下的柏树[30])。本研究显示烂皮病菌侵染期间,新疆杨叶片的Fv/Fm、实际光化学效率(ΦPSII)、电子传递速率(ETR)和光化学猝灭系数(qP)均显著降低(图3),并且相关性分析显示净光合速率与Fv/Fm、ΦPSII以及ETR均呈显著正相关(图7)。由此可以看出,烂皮病菌侵染抑制新疆杨叶片的光能转化效率,导致新疆杨叶片光反应中心部分关闭,阻碍PSII 与PSI 之间电子传递,使得天线色素捕获的光能用于光化学反应的份额减少,降低光合反应中心活性,从而导致光合速率降低。

图7 最大光化学效率、实际光化学效率及电子传递速率与净光合速率的相关性Fig.7 Correlations between the maximum photochemical efficiency,actual photochemical efficiency,electron transport rate and net photosynthetic rate
最大净光合速率(Pnmax)取决于光合机构关键酶Rubisco 活性和电子传递速率[31]。病原菌胁迫不仅导致叶片光合机构受损,抑制光合电子传递,也影响寄主叶片对光能的利用能力。本研究中,在烂皮病菌侵染植株Pnmax显著降低的同时(表1),ETR也显著降低,然而Pnmax降低与Rubisco 酶活性变化是否有关还需更深入的研究。另外,胁迫条件下新疆杨叶片暗呼吸速率(Rd)及光补偿点(LCP)显著升高,而表观量子效率(AQY)却显著降低(表1),表明烂皮病菌侵染增强了新疆杨植株光合产物的消耗,降低了叶片对弱光的吸收和利用能力,并最终导致叶片光合能力下降。
非结构性碳水化合物(NSC)是植物体内光合产物的主要储存形式。在生长季,光合产物在叶部产生并分配至各个器官,其浓度可以反映植物自身的碳收支状况[32-33]。本研究结果显示在接种后30 天内,环割对照(Ctrl)、未环割对照(UC)植株的根部可溶性糖、淀粉含量均呈持续增长的趋势(图4),显示未胁迫植株根部非结构性碳水化合物持续积累的特征。然而,烂皮病菌侵染下,杨树根部可溶性糖及淀粉含量始终维持在10 dpi 的水平。田间观察及本研究组研究显示,随着烂皮病菌侵染时间的延长以及侵染程度的加剧,烂皮病菌侵染40~50 天,杨树接种部位上部出现枯萎、枝枯等症状[15],这必将造成光合作用的下降甚至停止并进而造成根部碳积累的减少。因此,本研究结果显示,从接种后20 甚至10 天起,烂皮病菌已经显著抑制杨树根部非结构性碳水化合物的积累。
3.2 烂皮病菌侵染对新疆杨叶片水分状况的影响
水分吸收与蒸腾散失之间的平衡是植物正常生长发育的必要条件,病原菌侵染可以造成植物水分代谢紊乱。溃疡类病害作为典型的枝干病害,在病斑扩展的过程中会直接破坏植物的维管组织,或形成侵填体阻碍植物的体内水分运输[16],进而引起植物叶片水势和气孔导度的改变[14]。一般认为,水分相关病害,干旱高温下病害易于发生或发病严重[34-35]。Rohrs-Richey 等人在桤木与Valsa melanodiscus互作研究中发现,桤木利用气孔调节提高了叶片水分利用效率[12],杨树溃疡病菌侵染也会显著升高寄主的水分利用效率(WUE)、降低蒸腾速率(Tr)[26]。我们近期的研究发现,溃疡病菌侵染早期通过抑制碳代谢途径诱导碳饥饿[26];并且显著降低枝干非结构性碳水化合物含量,但不改变水分状况[15],说明溃疡类病害造成的树木衰亡与水力学失败无关。本研究中,虽然烂皮病菌侵染下新疆杨叶片的Tr和WUE降低,水汽压亏缺(VPD)升高,但10 dpi和30 dpi 时,新疆杨叶片的正午水势(Ψmd)并未降低,反而在胁迫20 dpi 时显著升高。该结果说明烂皮病菌侵染不仅未造成新疆杨叶片水分状况的恶化,甚至对水分状况有一定改善作用。以上研究显示,至少在早中期,溃疡、烂皮病菌侵染并不会造成水分胁迫,进一步证实了水力学途径不是病菌侵染下树木衰亡的主要原因。该现象的产生可能与较低的气孔导度和光合速率有关,病菌侵染使气孔导度和光合速率降低,进一步减少植物叶片蒸腾耗水。即使在病菌侵染下,杨树水分代谢与碳代谢之间也能保持相对的平衡。
4 结论
通过对烂皮病菌(V.sordida)与新疆杨的互作研究发现,烂皮病菌侵染导致新疆杨叶片光能转化、光合电子传递及光能利用受阻,从而降低净光合速率。与此同时,尽管烂皮病菌侵染显著升高新疆杨叶片的水汽压亏缺,降低蒸腾速率和水分利用效率,但较高的叶片水势说明烂皮病菌侵染并未造成新疆杨叶部水分胁迫,甚至有一定的改善作用。另外,烂皮病菌侵染抑制寄主植株根部非结构性碳水化合物的积累,使其含量维持在胁迫初期的水平。由此说明,烂皮病菌侵染早中期造成树木碳代谢失衡,引发碳饥饿,进而导致树木衰亡。

