鸡枞菌菌丝体液体发酵培养液配方的优化
张明星 李 洁 张玄妮 李欢欢 谢 娟 徐学锋
(华南农业大学食品学院,广州 510642)
鸡枞菌(Termitomycesspp.)隶属于担子菌门伞菌纲伞菌目离褶伞科蚁巢伞属,其子实体不仅味道鲜美、营养丰富,还具有免疫调节[1]、抗氧化[2]、降血糖[3]等功效,是一种集食用和药用于一身的珍贵食用菌。鸡枞菌作为一个与白蚁共生的菌类,其原生环境十分复杂,且菌丝生长于白蚁活动的菌圃之上,再加上其与菌圃之间的关系错综复杂、与菌圃内部的白蚁协同进化,其生理生化特性尚未明晰,故长期以来,其子实体只能在部分地区的特定季节,以野生采摘的形式获取,种质资源利用十分受限。目前,人工栽培鸡枞菌的尝试与研究较多,但效果均一般,且关于鸡枞菌生长条件的研究报道较少[4-7],故至今无法实现真正意义上的鸡枞菌人工驯化。而鸡枞菌菌丝体采用液体发酵培养技术,具有发酵速度快、周期短的特点,这有助于鸡枞菌的人工驯化和资源利用。在此背景下,笔者对鸡枞菌菌丝体液体发酵培养液的配方进行了优化,以期完善鸡枞菌菌丝体液体发酵培养技术。现将相关试验结果报道如下。
1 材料与方法
1.1 试验材料
野生鸡枞菌(Genebank:MW692851,Sequence ID:AB960801.1)于2019年7月采集于华南农业大学。该菌株菌盖长8~12 cm,中央尖突,颜色为灰褐色或暗褐色,菌盖边缘为灰白色,边缘形状不规则,呈辐射状开裂,有柱状菌索。采用组织分离法获得鸡枞菌菌丝体,其菌丝细密,易在培养基(PDA)上形成褶皱,属于匍匐型(菌丝体形态特征描述参照龙正海等[8])。
1.2 主要试剂与仪器
1.2.1 试剂及培养材料
具体为:牛肉膏、蛋白胨、酵母浸膏、麦芽浸提物、可溶性淀粉(广东环凯微生物科技有限公司生产),硝酸铵、磷酸二氢钾、硫酸镁(购于广东光华化学厂有限公司),葡萄糖、硫酸铜、氢氧化钠、氯化钾[购于福晨(天津)化学试剂有限公司],麦芽糖、乳糖、蔗糖(购于天津富宇精细化工有限公司),膨化豆粕[购于益海(连云港)粮油工业有限公司],小麦麸皮[购于益海嘉里(郑州)食品工业有限公司]。
1.2.2 试验仪器
具体为:HVE-50型全自动高压灭菌锅(日本Hirayama公司),雷磁pHs-25型数显pH计(上海伟业仪器厂),SW-CJ-1F超净工作台(苏州安泰空气技术有限公司),TG-16W台式高速离心机(长沙湘智离心机仪器有限公司),FSH-2A可调高速均质机(常州市国旺仪器制造有限公司),101AS-3电热鼓风干燥箱(上海浦东跃东欣科学仪器厂),LRH-250A型生化培养箱(广东省医疗器械厂),SPH-2102C立式恒温培养振荡器(上海四平试验设备有限公司)。
1.2.3 供试培养液制备
基础培养液(PD):取土豆200.0 g,熬汁过滤后加葡萄糖20.0 g,蒸馏水定容至1 L,pH自然。
改良PD培养液:PD培养液取1 L,加入硫酸镁1.0 g、磷酸二氢钾1.0 g,pH自然。
1.3 试验设计
1.3.1 鸡枞菌菌丝体发酵培养试验
将平板中的菌种接入50 mL锥形瓶中,加入20 mL无菌水,并用均质机在转速10 000g下工作30 s,将打碎的菌丝液吸入改良PD培养液中,每瓶加入5 mL菌液,于28 ℃、150 r/min恒温振荡培养箱中培养7 d。将活化的一级菌种过滤、冲洗,然后将菌球倒入50 mL锥形瓶中,加入5 mL无菌水,并用均质机在转速10 000g下匀浆30 s,然后将其全部转移到装有300 mL无菌水的500 mL锥形瓶中混匀。将活化的菌种液,以5%的接种量接种到改良PD培养液中,共接种54瓶,于28 ℃、150 r/min恒温振荡培养箱中培养9 d,每隔12 h取样1次,每次取3瓶,用蒸馏水将发酵好的菌液清洗3次,于80 ℃烘箱中烘至恒重,检测菌丝体生物量,并确定鸡枞菌发酵的截止时间,以作为后续单因素试验的最佳发酵时间。
1.3.2 单因素试验
为明确培养温度、培养液pH、硫酸镁添加量、磷酸二氢钾添加量、硫酸铜添加量、碳源、氮源等因素对鸡枞菌菌丝生长的影响,在不同碳源、氮源、pH和不同硫酸镁、磷酸二氢钾、硫酸铜添加量的培养液中接入5%的活化菌种液,于28 ℃、150 r/min恒温振荡培养箱中培养到鸡枞菌菌丝体最佳发酵时间,取出已发酵好的菌液用蒸馏水清洗3次,于80 ℃烘箱中烘至恒重,检测菌丝体生物量。具体为:(1)培养温度试验。向同上述1.3.1步骤中的改良PD培养液中接种一级菌种,并于22、25、28、31、34 ℃下进行黑暗培养。每处理重复3次。(2)培养液pH试验。用1%NaOH和1%HCl 调节 PD 培养液的 pH 分别为 4.0、5.0、6.0、7.0、8.0、9.0。每处理重复3次。(3)硫酸镁试验。向PD培养液中加入硫酸镁,添加量(质量浓度)分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 g/L。每处理重复3次。(4)磷酸二氢钾添加量试验。向PD培养液中加入磷酸二氢钾,添加量(质量浓度)分别为 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 g/L。每处理重复3次。(5)硫酸铜添加量试验。向PD培养液中加入硫酸铜,添加量(质量浓度)分别为 0、0.015、0.030、0.045、0.060、0.075 g/L(硫酸铜溶液要与培养液分开单独灭菌)。每处理重复3次。(6)碳源试验。碳源添加量(质量浓度)分别为葡萄糖2.0 g/L、乳糖2.0 g/L、果糖2.0 g/L、淀粉2.0 g/L、蔗糖2.0 g/L、麦芽糖2.0 g/L。每处理重复3次。(7)氮源试验。以20 g葡萄糖为基础加入氮源,氮源添加量(质量浓度)分别为酵母浸膏3.0 g/L、蛋白胨3.0 g/L、硝酸铵3.0 g/L、牛肉膏3.0 g/L、膨化豆粕5.0 g/L、麦芽浸汁2.0 g/L。每处理重复3次。
1.3.3 最优培养液配方组合筛选
本试验以菌丝体生物量为主要测量指标,并参考常见的食用菌优良液体发酵感官指标,以菌液澄清、无异味,菌球轮廓清晰、大小均一为宜[9-12],选择对鸡枞菌菌丝体生物量影响较为显著的三个因素进行组合,每个因素设3个水平,筛选出最优的培养液配方组合。
1.4 数据分析
试验数据均采用SPSS V20.0进行处理与分析。
2 结果与分析
2.1 鸡枞菌菌丝体液体发酵培养的生长特性
由图1可知,在发酵培养的第3天到第5天,鸡枞菌菌丝体生物量急剧增加;从第5天开始,鸡枞菌菌丝体生物量增速变缓;第6天到第7天,鸡枞菌菌丝体生物量虽有所增加但不显著;从第8天开始,鸡枞菌菌丝体生物量显著降低。据观察鸡枞菌菌丝体在发酵瓶中的生长状态发现,在发酵培养开始后的第2天,菌丝体变化不明显;第3天开始,能明显观察到菌丝体向四周伸长;第4天,菌丝体逐渐变圆有毛刺;第5天,能观察到菌丝体毛刺减少,菌球变饱满;第6天,菌球饱满、圆滑;第7天变化不明显;第8天菌丝体自溶,时间越往后自溶现象越明显。综合菌丝体生物量变化和发酵现象,最终确定发酵截止时间为第7天。
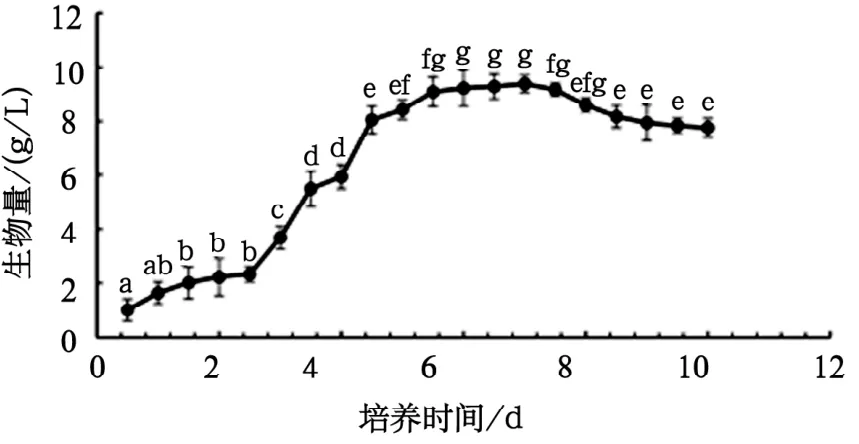
图1 鸡枞菌菌丝体在液体发酵培养中生长曲线
2.2 培养温度对鸡枞菌菌丝体生物量的影响
由图2可知,当培养温度低于28 ℃时,鸡枞菌菌丝体生物量随培养温度的增加而显著增加;当培养温度为28 ℃时,鸡枞菌菌丝体生物量达到最大,为11.03 g/L;当培养温度高于28 ℃时,鸡枞菌菌丝体生物量显著降低,且培养温度为31 ℃时鸡枞菌菌丝体生物量显著低于培养温度为22 ℃时的鸡枞菌菌丝体生物量,表明高温对鸡枞菌菌丝生长有害。但是,由于低温、高温对鸡枞菌菌丝体生物量的抑制作用均显著,且恒温振荡培养箱本身存在一定的温控误差,故在后续试验中将不再调查培养温度对鸡枞菌菌丝体生物量的影响。经综合考虑,最终确定鸡枞菌菌丝体的最适培养温度为28 ℃。

图2 培养温度对鸡枞菌菌丝体生物量的影响
2.3 培养液pH对鸡枞菌菌丝体生物量的影响
由图3可知,鸡枞菌菌丝体生物量随培养液pH的增加呈先增加后降低的趋势,当培养液pH为6.0时,鸡枞菌菌丝体生物量达到最高,为10.87 g/L。通过观察鸡枞菌菌丝体在发酵瓶中的生长状态可知,在不同pH的培养液中,菌液的澄清程度和菌球形态无明显变化。经综合考虑,最终确定鸡枞菌菌丝体液体发酵培养液的最适pH为6.0。

图3 培养液pH对鸡枞菌菌丝体生物量的影响
2.4 硫酸镁不同添加量对鸡枞菌菌丝体生物量的影响
由图4可知,鸡枞菌菌丝体生物量随硫酸镁添加量的增加大体上呈先增加后降低的趋势,当硫酸镁添加量为1.0 g/L时,鸡枞菌菌丝体生物量为最高,达11.10 g/L。通过观察鸡枞菌菌丝体在发酵瓶中的生长状态可知,当硫酸镁添加量高于1.5 g/L时,菌球会发生自溶,表明硫酸镁添加量对鸡枞菌菌丝体菌球形状的影响较大。经综合考虑,最终确定硫酸镁的最适添加量为1.0 g/L。
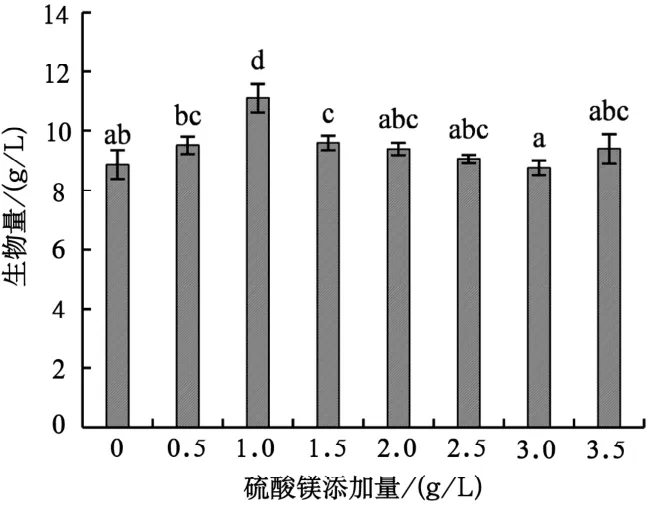
图4 硫酸镁不同添加量对鸡枞菌菌丝体生物量的影响
2.5 磷酸二氢钾不同添加量对鸡枞菌菌丝体生物量的影响
由图5可知,鸡枞菌菌丝体生物量随磷酸二氢钾添加量的增加大体上呈先增加后降低的趋势,当磷酸二氢钾添加量为1.0 g/L时,鸡枞菌菌丝体生物量达到最高,为10.70 g/L;当磷酸二氢钾添加量为1.5 g/L时,鸡枞菌菌丝体生物量显著降低。经综合考虑,最终磷酸二氢钾的最适添加量为1.0 g/L。
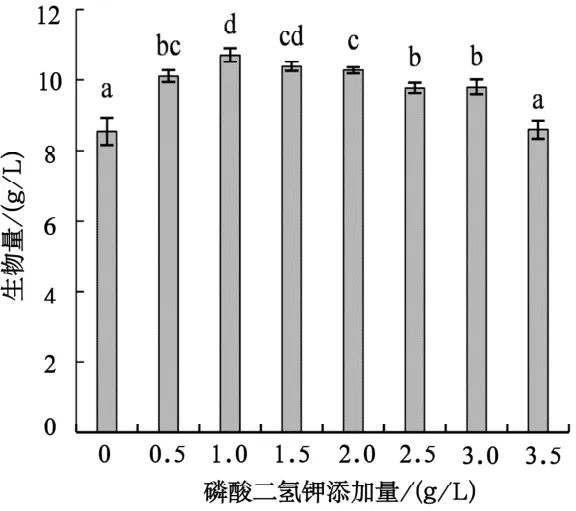
图5 磷酸二氢钾不同添加量对鸡枞菌菌丝体生物量的影响
2.6 硫酸铜不同添加量对鸡枞菌菌丝体生物量的影响
由图6可知,鸡枞菌菌丝体生物量随硫酸铜添加量的增加而显著降低,经分析,这可能是因为土豆汁中的铜离子已足够供应鸡枞菌菌丝体生长,或是硫酸铜对鸡枞菌菌丝体有毒害作用,额外添加铜离子会抑制鸡枞菌菌丝体的生长。

图6 硫酸铜不同添加量对鸡枞菌菌丝体生物量的影响
2.7 不同碳源对鸡枞菌菌丝体生物量的影响
由图7可知,不同碳源对鸡枞菌菌丝体生物量有显著影响,以碳源为葡萄糖时,鸡枞菌菌丝体生物量显著高于其他碳源,为11.70 g/L。通过观察鸡枞菌菌丝体在发酵瓶中的生长状态可知,以淀粉为碳源时,菌液浑浊,菌球形状不规则,自溶现象明显;以果糖为碳源时,菌液澄清、静置分层,且与其他碳源相比,菌球偏大且密度较低;以葡萄糖为碳源时,菌液澄清、静置不分层,菌球大小均一悬浮能力强。经综合考虑,最终鸡枞菌菌丝体液体发酵培养的最适碳源为葡萄糖。

图7 不同碳源对鸡枞菌菌丝体生物量的影响
2.8 不同氮源对鸡枞菌菌丝体生物量的影响
由图8可知,不同氮源对鸡枞菌菌丝体生物量有显著影响,以膨化豆粕为氮源时,鸡枞菌菌丝体生物量显著高于其他氮源,达11.42 g/L;而以牛肉膏及麦芽浸汁为氮源时,鸡枞菌菌丝体生物量均与以膨化豆粕为氮源相差不大,且均显著高于以酵母浸膏、蛋白胨及硝酸铵为氮源。通过观察鸡枞菌菌丝体在发酵瓶中的生长状态可知,以蛋白胨为氮源时,菌株大小均一性差;以膨化豆粕为氮源时,菌液澄清,菌球饱满且相对较硬;以硝酸铵为氮源时,菌液澄清,菌球小而细腻;以牛肉膏、酵母膏和麦芽浸汁为氮源时,菌液澄清,菌球饱满,菌丝细腻程度介于以膨化豆粕与硝酸铵为氮源之间。经综合考虑,最终取膨化豆粕为鸡枞菌菌丝体液体发酵培养的最适氮源。

图8 不同氮源对鸡枞菌菌丝体生物量的影响
2.9 鸡枞菌菌丝体液体发酵培养液的最优配方组合
综合单因素试验结果表明,选择对鸡枞菌菌丝体生物量影响较为显著的氮源、培养液pH和磷酸二氢钾添加量三个因素进行组合。由表1可知,以2号培养液对鸡枞菌菌丝体的生长促进作用最为显著,菌丝体生物量达11.6 g/L。

表1 鸡枞菌菌丝体液体发酵培养液的最优配方组合
3 结 论
试验结果表明,供试鸡枞菌菌丝体在供试培养液上均能生长,但生长速度差异达显著水平,说明培养温度、磷酸二氢钾添加量、培养液pH、碳源、氮源对菌丝体的生长都有一定影响。单因素试验结果显示,在本试验条件下,鸡枞菌菌丝体生长的最适碳源为葡萄糖,最适氮源为膨化豆粕,最适硫酸镁添加量为1.0 g/L,最适磷酸二氢钾添加量为1.0 g/L,最适培养液pH为6.0,最适培养温度为28℃;最优培养液配方组合筛选试验结果显示,鸡枞菌菌丝体生长的液体培养液配方以氮源为膨化豆粕、硫酸镁添加量为1.5 g/L、培养液pH为6.0最适宜,此配方的鸡枞菌菌丝体生物量最高,达11.6 g/L,该配方组合结果与前人的研究结果一致,但鸡枞菌菌丝体生物量有一定差距[13],这可能是因为鸡枞菌的种类不同,或是因为与鸡枞菌共生的白蚁种属不同,或是因为鸡枞菌经离体培养优化之后,嗜好生存条件不同[14],或是因为发酵后鸡枞菌菌丝体的酶种类及酶活性在一定程度上存在差异[15-16]。
在本试验中,鉴于鸡枞菌菌丝体生长缓慢,菌丝茂密程度不一,菌龄相差较大等,本试验对其接种方式进行了改进,有别于传统的打孔法接种,本试验事先在无菌条件下将菌丝打碎,得到了相对均一的菌液。同时,在本试验过程中发现,不同培养液对鸡枞菌菌丝体不同生长阶段的影响不一,这说明菌丝生长的全过程是变量生长曲线。此外,在试验过程中还发现,菌球形态易受硫酸镁添加量和碳源种类的影响,具体表现为菌丝轮廓不清晰,容易自溶,故对这两类物质的添加要额外注意;而培养液氮源为膨化豆粕时,菌丝体生物量相对最大,菌球也比其他氮源的饱满、硬,且菌液中蘑菇的香味最浓烈,这可能是因为膨化豆粕在为鸡枞菌提供氮源的同时,还提供了一定的木质纤维素,鸡枞菌对其进行降解时分泌出了香味。

