血浆脂蛋白相关磷脂酶A2水平变化与冠心病的相关性研究
岳 黎
(阳谷县人民医院检验科,山东聊城 252300)
冠心病又被称为冠状动脉粥样硬化性心脏病,是临床上常见的心血管疾病,可分为心绞痛、心肌梗死等类型,其中心绞痛包括稳定型和不稳定型。冠心病的发病机制较为复杂,而动脉粥样硬化是重要的致病因素之一。相关研究表明,慢性炎症在冠心病的发生、发展中起到关键作用,不仅参与动脉粥样硬化斑块的发生,还促进斑块发展[1]。血浆中的脂蛋白相关磷脂酶A2(Lp-PLA2)氧化水解后,机体所产生的脂类促炎物质一定程度上刺激黏附因子、促进细胞因子产生,最终导致动脉粥样硬化斑块的形成[2]。本研究旨在通过比较冠心病各亚组与健康组的生化指标,分析血浆Lp-PLA2水平与其他几项生化指标的相关系数,探讨血浆Lp-PLA2水平与不同类型冠心病的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取阳谷县人民医院2019年4月至2021年4月收治的40例冠心病患者及60例体检正常者,进行回顾性研究。将60例体检正常者纳入健康组,40例冠心病患者纳入冠心病组。根据冠心病类型不同将冠心病组分为稳定型心绞痛组、不稳定型心绞痛组及急性心肌梗死组。冠心病组患者中男性28例,女性12例;年龄46~73岁,平均年龄(55.77±4.95)岁。健康组中男性38例,女性22例;年龄46~71岁,平均(56.08±4.55)岁。各组研究对象的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经阳谷县人民医院医学伦理委员会批准。纳入标准:冠心病组患者符合《冠心病防治指南》[3]中的诊断标准,且经影像学检查确诊者。排除标准:①患有心肌病等其他心脑血管病变者;②采血前服用阿司匹林或他汀类药物者。
1.2 检测方法 入组后,分别采集所有研究对象的空腹静脉血4 mL,其中2 mL置于抗凝管中,以3 000 r/min转速离心10 min,分离得到血浆,采用酶联免疫吸附法对血浆Lp-PLA2水平进行检测。剩余2 mL以3 000 r/min转速离心8 min,取上清液,采用免疫比浊法检测血清超敏C反应蛋白(hs-CRP)水平;采用全自动生化分析仪[贝克曼库尔特商贸(中国)有限公司,型号:AU5800]测定血清中的总胆固醇(TC)、三酰甘油(TG)、载脂蛋白A1(Apo-A1)、载脂蛋白B(Apo-B)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白a[Lp(a)]。
1.3 观察指标 ①比较各组研究对象的生化指标。生化指标包括:血浆Lp-PLA2,血清中hs-CRP、TC、TG、Apo-A1、Apo-B,HDL-C、LDL-C、Lp(a)。②比较血浆Lp-PLA2与其他生化指标的相关性。其他生化指标 包 括:hs-CRP、TC、TG、Apo-A1、Apo-B、HDL-C、LDL-C、Lp(a)。
1.4 统计学分析 应用SPSS 22.0统计学软件进行数据分析,计量资料以(±s)表示,多组间比较采用方差分析,两组间比较采用LSD-t检验;相关性分析以Pearson直线相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 生化指标比较 冠心病各亚组患者的血浆Lp-PLA2、hs-CRP水平均高于健康组,差异有统计学意义(P<0.05),急性心肌梗死组、不稳定型心绞痛组高于稳定型心绞痛组,差异有统计学意义(P<0.05),且不稳定型心绞痛组低于急性心肌梗死组,差异有统计学意义(P<0.05);冠心病各亚组血清Lp(a)水平均高于健康组,差异有统计学意义(P<0.05),且冠心病各亚组组间比较,差异无统计学意义(P>0.05);冠心病各亚组与健康组的 TC、TG、Apo-A1、Apo-B、HDL-C、LDL-C比较,差异均无统计学意义(均P>0.05),见表1。
表1 各组研究对象生化指标比较(±s)
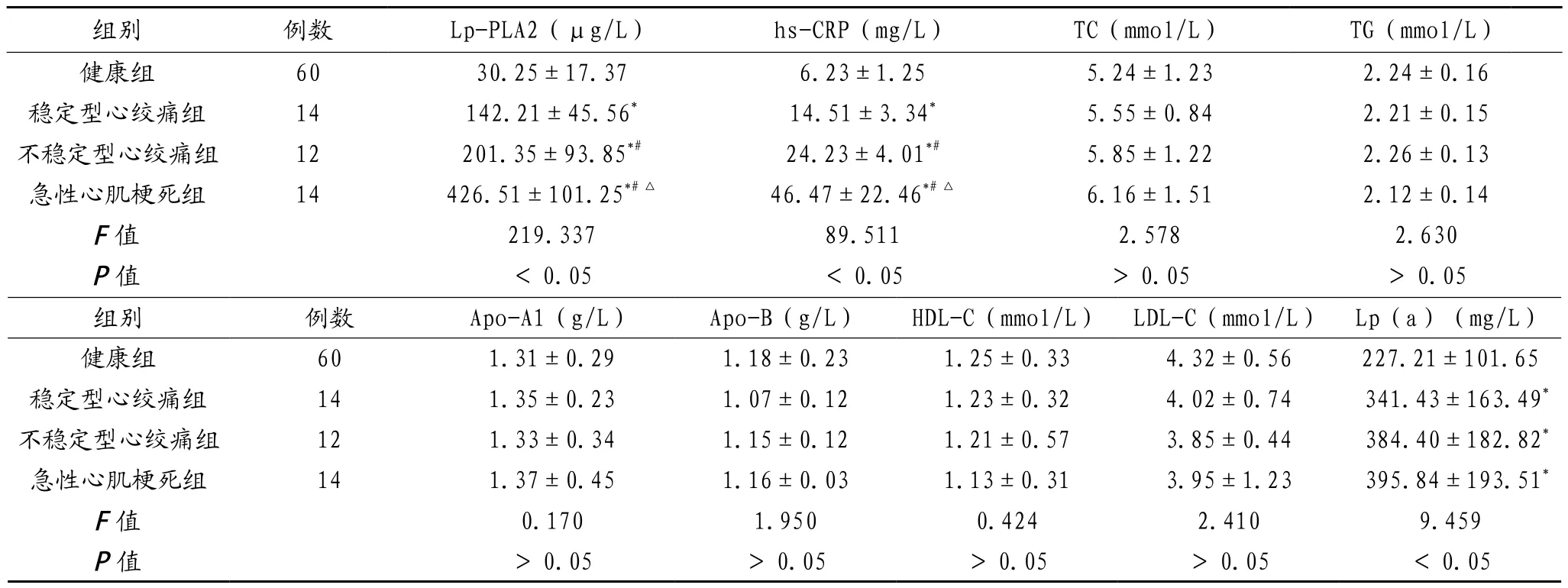
表1 各组研究对象生化指标比较(±s)
注:与健康组比,*P<0.05;与稳定型心绞痛组比,#P<0.05;与不稳定型心绞痛组比,△P<0.05。Lp-PLA2:脂蛋白相关磷脂酶A2;hs-CRP:超敏C反应蛋白;TC:总胆固醇;TG:三酰甘油;Apo-A1:载脂蛋白A1;Apo-B:载脂蛋白B;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;Lp(a):脂蛋白a。
组别 例数 Lp-PLA2(μg/L) hs-CRP(mg/L) TC(mmol/L) TG(mmol/L)健康组 60 30.25±17.37 6.23±1.25 5.24±1.23 2.24±0.16稳定型心绞痛组 14 142.21±45.56* 14.51±3.34* 5.55±0.84 2.21±0.15不稳定型心绞痛组 12 201.35±93.85*# 24.23±4.01*# 5.85±1.22 2.26±0.13急性心肌梗死组 14 426.51±101.25*#△ 46.47±22.46*#△ 6.16±1.51 2.12±0.14 F值 219.337 89.511 2.578 2.630 P值 <0.05 <0.05 >0.05 >0.05组别 例数 Apo-A1(g/L) Apo-B(g/L) HDL-C(mmol/L) LDL-C(mmol/L) Lp(a)(mg/L)健康组 60 1.31±0.29 1.18±0.23 1.25±0.33 4.32±0.56 227.21±101.65稳定型心绞痛组 14 1.35±0.23 1.07±0.12 1.23±0.32 4.02±0.74 341.43±163.49*不稳定型心绞痛组 12 1.33±0.34 1.15±0.12 1.21±0.57 3.85±0.44 384.40±182.82*急性心肌梗死组 14 1.37±0.45 1.16±0.03 1.13±0.31 3.95±1.23 395.84±193.51*F值 0.170 1.950 0.424 2.410 9.459 P值 >0.05 >0.05 >0.05 >0.05 <0.05
2.2 血浆Lp-PLA2与其他生化指标的相关性 经双变量直线分析,整个研究对象中,血浆Lp-PLA2水平与hs-CRP 呈正相关(r=0.624,P< O.05),与 TC、TG、Apo-A1、Apo-B、HDL-C、LDL-C、Lp(a)无相关性;冠心病组血浆Lp-PLA2水平仅与hs-CRP呈正相关(r=0.487,P< 0.05), 与 TC、TG、Apo-A1、Apo-B、HDL-C、LDL-C、Lp(a)无相关性;健康组血浆Lp—PLA2 水 平 则 与 hs-CRP、TC、TG、Apo-A1、Apo-B、HDL-C、LDL-C、Lp(a)无相关性,见表2。
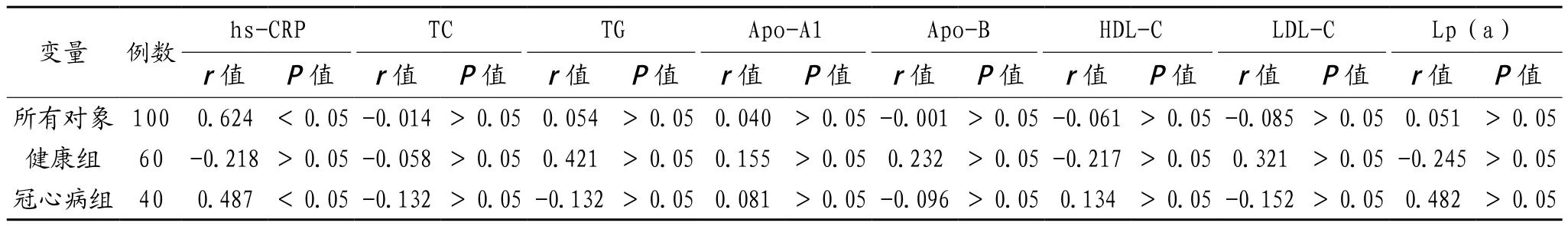
表2 血浆Lp-PLA2与其他生化指标的相关性
3 讨论
冠心病是冠状动脉粥样硬化引起的血管腔狭窄、阻塞,或由冠状动脉功能性改变引发的心肌细胞缺氧、缺血或坏死,其临床症状主要为胸骨后持续疼痛、心电图异常及心肌标志物异常升高[4-5]。家族病史、体质量大、运动量少、高血压、高血脂、高血糖均是诱发冠心病的高危因素[6]。随着病情的加重,极有可能发展为心律失常,进而导致死亡率增加[7],因此早期诊治并采取及时有效的防治措施至关重要。
Lp-PLA2是磷脂酶A2超家族的一员,具有催化细胞膜上的甘油磷脂和脂蛋白水解的作用,能够促进血小板聚集、中性粒细胞和单核细胞趋化、白三烯等炎性介质释放,进而促进血栓形成[8]。在机体血液循环中,Lp-PLA2由巨噬细胞和淋巴细胞产生,其水平异常可导致促炎介质向血管内聚集,最终聚集成斑块,增大血栓形成的风险[9]。hs-CRP主要由肝脏细胞合成和分泌,在组织损伤、急性感染、炎症反应发生时,被大量合成并释放至血液中,高水平的hs-CRP可使机体炎症反应发展,导致病情进一步加重[10]。Lp(a)能够竞争性抑制纤溶酶原产生,具有较强渗透性,易沉积于血管壁,其水平升高易造成纤溶及凝血功能失调,加速血栓形成[11]。
TC,TG,HDL-C,LDL-C,Apo-A1,Apo-B,Lp(a)是临床中检测血脂代谢水平的重要指标,上述指标的水平异常可引起血液黏度和氧自由基含量升高,对血管内皮造成损伤,进而产生血栓,导致冠心病患病风险增加[12]。本研究结果显示,冠心病各亚组患者的血浆Lp-PLA2、hs-CRP水平均高于健康组(P< 0.05),不稳定型心绞痛组、急性心肌梗死组高于稳定型心绞痛组(P<0.05),且不稳定型心绞痛组低于急性心肌梗死组(P<0.05);冠心病各亚组血清Lp(a)水平均高于健康组(P< 0.05),提示血浆 Lp-PLA2、hs-CRP、Lp(a)等3个指标在冠心病患者体内表达水平均较高。冠心病组血浆Lp-PLA2水平与血清hs-CRP呈正相关(P<0.05),提示随着血浆Lp-PLA2表达水平升高,血清hs-CRP水平也升高,疾病严重程度也加重,进而表明血浆Lp-PLA2可作为冠心病早期诊断的重要指标,预测冠心病的疾病严重程度,这与甄雅惠等[13]的研究结果一致。
综上所述,冠心病患者血浆Lp-PLA2水平与血清hs-CRP呈正相关,血浆Lp-PLA2较能明显地反映冠心病的严重程度,临床上可通过检测血浆Lp-PLA2水平辅助制定有效的防治措施。但本研究样本量较少,临床上可扩大样本量深入了解其作用机制。

