婴儿感染B族链球菌的喹诺酮耐药突变调查*
关小珊,唐 倩,邓秋连,钟华敏,高坎坎,刘海英
广东省广州市妇女儿童医疗中心儿童院区检验科,广东广州 510120
B族链球菌(GBS)正常定植于妇女下生殖道,为围生期新生儿败血症、肺炎和脑膜炎的主要致病菌[1-2]。基于孕晚期GBS筛查或临床高危因素评估的产时抗菌药物干预是当前预防新生儿GBS感染唯一有效的措施,而及时的抗菌治疗直接决定患儿的临床预后[3]。尽管喹诺酮类抗菌药物不用于孕妇和儿童感染的治疗,但多重耐药GBS菌株的耐药谱易产生协同效应,使常规使用的抗菌药物敏感性降低,而且细菌间耐药质粒的水平传播大大加快了喹诺酮耐药的传播。本研究旨在调查本中心2014-2019年的GBS喹诺酮耐药状况,并探讨耐药突变位点与菌株血清学分型之间的关系。
1 资料与方法
1.1一般资料 选取从2014年1月至2019年12月于本中心确诊为GBS感染的婴儿血液﹑脑脊液标本中分离出的非重复菌株共120株作为研究对象。纳入标准:(1)菌株来源患儿有1个或多个正常情况下无菌部位GBS培养阳性;(2)菌株来源患儿符合GBS感染诊断标准时,日龄不超过90 d。本研究通过广州市妇女儿童医疗中心医学伦理委员会审批通过。
1.2仪器与试剂 主要仪器包括法国生物梅里埃公司VITEK 2 COMPACT全自动微生物鉴定和药敏分析仪和配套药敏试验卡、德国Biometra公司PCR仪。PCR检测试剂购自Takara公司;血清学分型试剂盒购自丹麦SSI公司;质控菌株为肺炎链球菌ATCC49619,购自国家卫生健康委员会临床检验中心。
1.3方法
1.3.1药敏试验 把GBS临床分离株从-80 ℃冰箱取出,复苏并增菌;用VITEK 2 COMPACT全自动微生物鉴定药敏分析仪进行药敏检测,结果判读参照美国临床实验室标准化协会(CLSI)[4]及欧洲药敏试验联合委员会(EUCAST)[5]标准。菌株对2种喹诺酮类抗菌药物(本研究中为左氧氟沙星和莫西沙星)中的1种耐药即为喹诺酮耐药菌株。
1.3.2血清学分型 使用Oxoid公司Strep-B-Latex快速乳胶凝集试剂盒对GBS进行血清学分型:准备220 μL浓菌悬液,每孔分别加入20 μL的细菌悬液及5 μL的胶乳试剂(兔抗血清Ⅰa、Ⅰb和Ⅱ~Ⅸ),充分混匀并轻摇15~30 s,30 s内出现凝集则判定为阳性。
1.3.3PCR 根据文献[6]设计引物,GyrA和ParC的引物序列见表1。用煮沸法提取GBS临床分离株基因组DNA作为模板,PCR反应总体积为20 μL。GyrA的PCR参数设置:94 ℃ 3 min,94 ℃ 60 s、45 ℃ 60 s、68 ℃ 60 s共30个循环,68 ℃ 6 min;ParC的PCR参数设置:94 ℃ 3 min,94 ℃ 60 s、48 ℃ 60 s、72 ℃ 60 s共30个循环,72 ℃ 5 min。
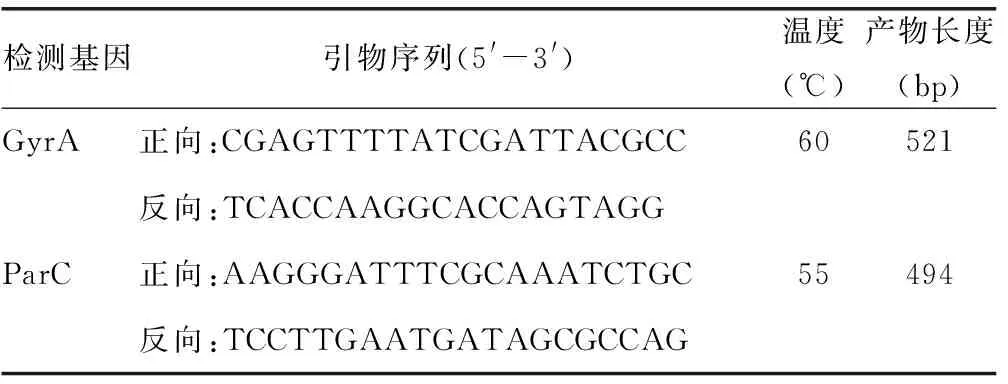
表1 GyrA和ParC基因引物序列
1.3.4电泳及测序 反应结束后,进行2.0%琼脂糖凝胶电泳,使用紫外凝胶成像系统采集图像并保存。将以喹诺酮耐药菌株基因组DNA为模版的GyrA和ParC PCR阳性产物直接送华大基因公司测序,将测序结果与从Gene Bank数据库下载的参考菌株的喹诺酮耐药决定区(QRDRs)序列用CLC Genomics Workbench 12.0和ExPASy软件进行比对,从而确定碱基突变引起的氨基酸改变。
2 结 果
2.1药敏试验 120株GBS对青霉素﹑万古霉素和利奈唑烷100.0%敏感,其中14株为喹诺酮耐药菌株。本研究中,GBS的喹诺酮耐药率为11.7%(14/120),近4年(2016-2019年)的耐药率分别为9.7%(3/31)、15.4%(2/13)、21.4%(6/28)、17.6%(3/17)。
2.2GyrA和ParC PCR产物的电泳检测 凝胶电泳显示,扩增产物与预期目的片段大小一致,见图1、2。
注:1~11为喹诺酮耐药菌株;12为喹诺酮敏感株;13为标准株;M为分子标准带。图1 GyrA PCR产物电泳图
注:1~11为喹诺酮耐药菌株;12为喹诺酮敏感株;13为标准株;M为分子标准带。图2 ParC PCR产物电泳图
2.3靶基因测序及比对 11株喹诺酮耐药菌株100%存在GyrA的碱基突变,且均为错义突变,导致的氨基酸改变包括81位丝氨酸(Ser)→亮氨酸(Leu),219位丙氨酸(Ala)→脯氨酸(Pro)或缬氨酸(Val)。仅存在GyrA(Ser81Leu)单位点突变的占36.36%(4/11),同时存在GyrA(Ser81Leu和Ala219Pro)或GyrA(Ser81Leu和Ala219Val)双突变的分别占45.45%(5/11)和9.10%(1/11)。仅1株耐药株有ParC的有义突变,且与GyrA突变同时出现;血清学分型显示,Ⅲ型占90.9%(10/11),Ⅰb型占9.1%(1/11),见表2。
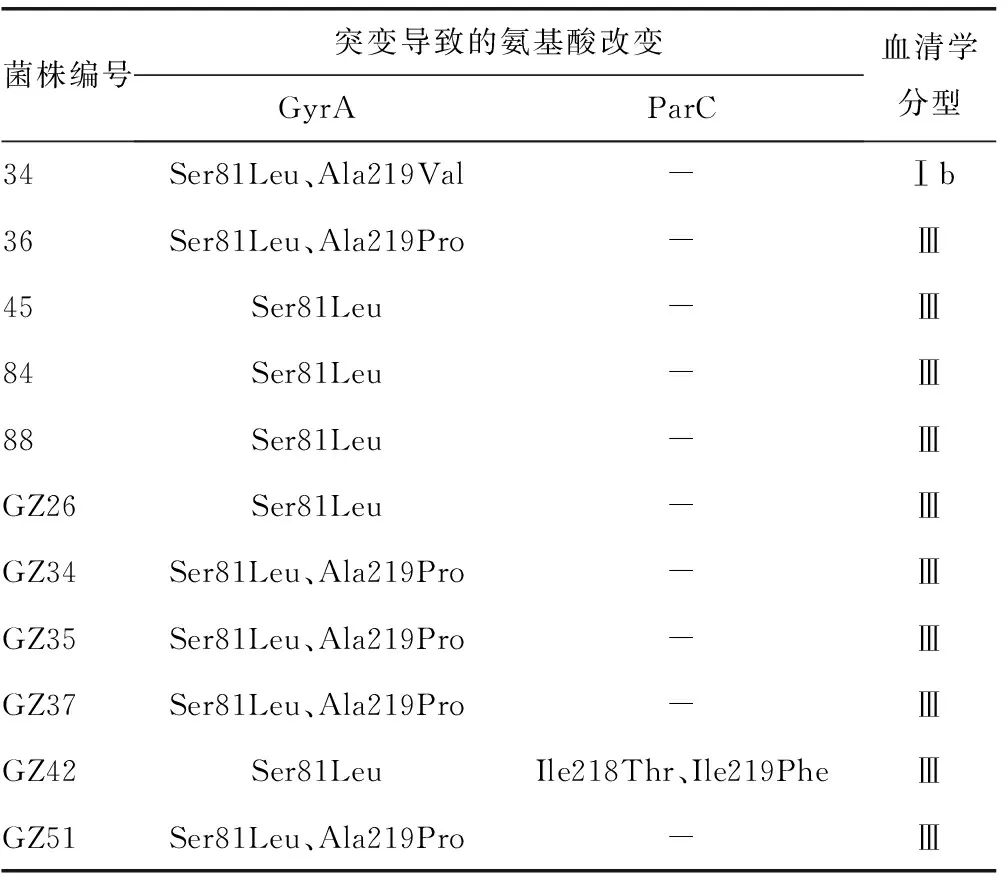
表2 喹诺酮耐药菌株GyrA与ParC基因突变导致的氨基酸改变及血清学分型
3 讨 论
本研究显示,120株GBS中的喹诺酮耐药率为11.7%(14/120),与法国报道的1.5%(新生儿标本1例)[7]、意大利报道的3.0%[8],以及中国台湾地区报道的6.2%[9]相比,本中心分离的GBS对左氧氟沙星的耐药率较高。这种差异可能与标本来源有关,也可能与婴儿感染的特定流行病学特征有关。
喹诺酮类抗菌药物属于临床常用抗菌药物,具有广泛的抗菌谱,当前应用的喹诺酮类抗菌药物主要以第4代为主[10]。目前,革兰阳性菌对喹诺酮类抗菌药物的耐药机制主要是拓扑异构酶靶位点改变,即QRDRs特异位点发生突变介导的耐药,这些突变位点主要位于GyrA、GyrB、ParC、ParE的活性区域,尤其以GyrA和ParC上的突变最为常见。最常见的位点突变有ParC(Ser79Phe)和GyrA(Ser81Leu)双突变,此外还有ParC(Ser80Pro)的报道[7-8]。本研究显示,所有喹诺酮耐药GBS菌株均存在GyrA(Ser81Leu)突变,其中仅存在GyrA(Ser81Leu)单位点突变的占36.36%,同时存在GyrA(Ser81Leu和Ala219Pro)或GyrA(Ser81Leu和Ala219Val)双突变的分别占45.45%和9.10%,经检索万方数据库、中国知网和Medline数据库发现,GyrA219号位的点突变国内外未见报道。此外,本研究中的GBS菌株不存在ParC(Ser79Phe)这种常见突变,尽管11株喹诺酮类耐药GBS均存在ParC基因序列的碱基突变(多数为4个不同碱基的单位点突变),但仅有1株ParC(Ile218Thr和Ile219Phe)为有义突变,推测上述两种新的氨基酸位点突变可能与药物作用后酶的构型变化以及结合位点的改变有关。
本研究发现存在有GyrA和ParC基因突变的喹诺酮耐药GBS菌株血清学分型多为Ⅲ型,与国内报道一致[11],与法国GBS分离株ST-19/CPS Ⅴ型在喹诺酮耐药菌株中的占比较高的报道[7]存在差异。这可能与标本来源有关,也可能与不同国家和地区的地理位置、气候条件、种族差异等造成GBS感染菌株血清学型别谱的差异有关。
需要说明的是,鉴于美国CLSI与EUCAST均无环丙沙星的药敏试验的判定标准,因此本研究仅以左氧氟沙星和莫西沙星耐药作为喹诺酮耐药的判定标准。
综上所述,本中心2014年1月至2019年12月从婴儿临床标本分离的喹诺酮耐药GBS菌株血清学分型以Ⅲ型为主,并且检测出了新的GyrA和ParC基因突变位点。持续调查GBS对喹诺酮类抗菌药物的耐药趋势及耐药基因突变,对于预防耐药菌的产生,控制多重耐药菌的形成,以及新药的开发具有重要的参考价值。

