肌腱蛋白C与肝移植术后肝损伤的关系及其检测的价值*
曹薇薇,杨佩军,李 霄△
1.安康职业技术学院,陕西安康 725000;2.空军军医大学西京医院肝胆外科,陕西西安 710032
肝移植是终末期肝脏疾病和小细胞肝癌的有效治疗方法,其手术技术和围术期管理措施已较为完善,但由于供肝的热缺血、冷缺血、再植入及开放血流后的再灌注等过程均会对移植肝组织造成损伤,故术后早期移植肝损伤仍是无法避免的难题之一,严重时可诱发移植肝早期丧失功能,导致移植失败[1]。移植肝早期损伤的病理生理过程较复杂,涉及免疫损伤、炎症损伤和缺血-再灌注损伤(IRI)等多个环节,因此预判其损伤程度和临床结局较为困难,缺少敏感的预测标志物。肌腱蛋白C(TNC)是细胞外基质中具有独特的六臂体结构的寡聚糖蛋白家族成员,其在体内的分布较为广泛,包括肝脏、肠组织、软骨膜、骨膜、平滑肌及部分神经组织。生理情况下,TNC参与上皮细胞的众多生理调节过程,如黏附、增殖、迁移、分化和凋亡等[2]。既往文献报道和前期动物研究显示,在肝移植、肾移植、器官IRI、病毒性感染、炎性反应等病理过程中,其表达迅速上调,是脏器损伤和炎症的重要分子标志物[3-4]。据此推测TNC可能与移植肝早期损伤有密切联系,但其在临床肝移植术后早期患者血清中的水平变化规律仍未明确,其检测价值也尚不明确。故本研究检测了肝移植术后不同时间点的患者血清TNC水平,并进一步分析了血清TNC水平与移植肝损伤的关系,对这些问题进行了探讨,旨在为早期移植肝损伤的预测提供参考。
1 资料与方法
1.1一般资料 将2015年2月至2018年5月于空军军医大学西京医院肝胆外科接受肝移植治疗的37例终末期肝病患者纳入研究;男26例,女11例;平均年龄(46.76±10.03)岁,中位年龄51岁;主要病因:原发性肝细胞癌11例,乙型肝炎肝硬化22例,丙型肝炎肝硬化2例,酒精性肝硬化2例。所有患者均成功进行手术,无围术期死亡,其余临床资料见表1。依据美国国家癌症研究所发布的2009年版肝功能不全分级标准[6],按照术后第1天的相关生化指标水平将患者分为轻度肝损伤组(1~2级)17例和重度肝损伤组(3~4级)20例。所有纳入研究者均对本研究知情同意并签署知情同意书。本研究符合《赫尔辛基宣言》中的伦理准则,并由医院伦理委员会审批通过。
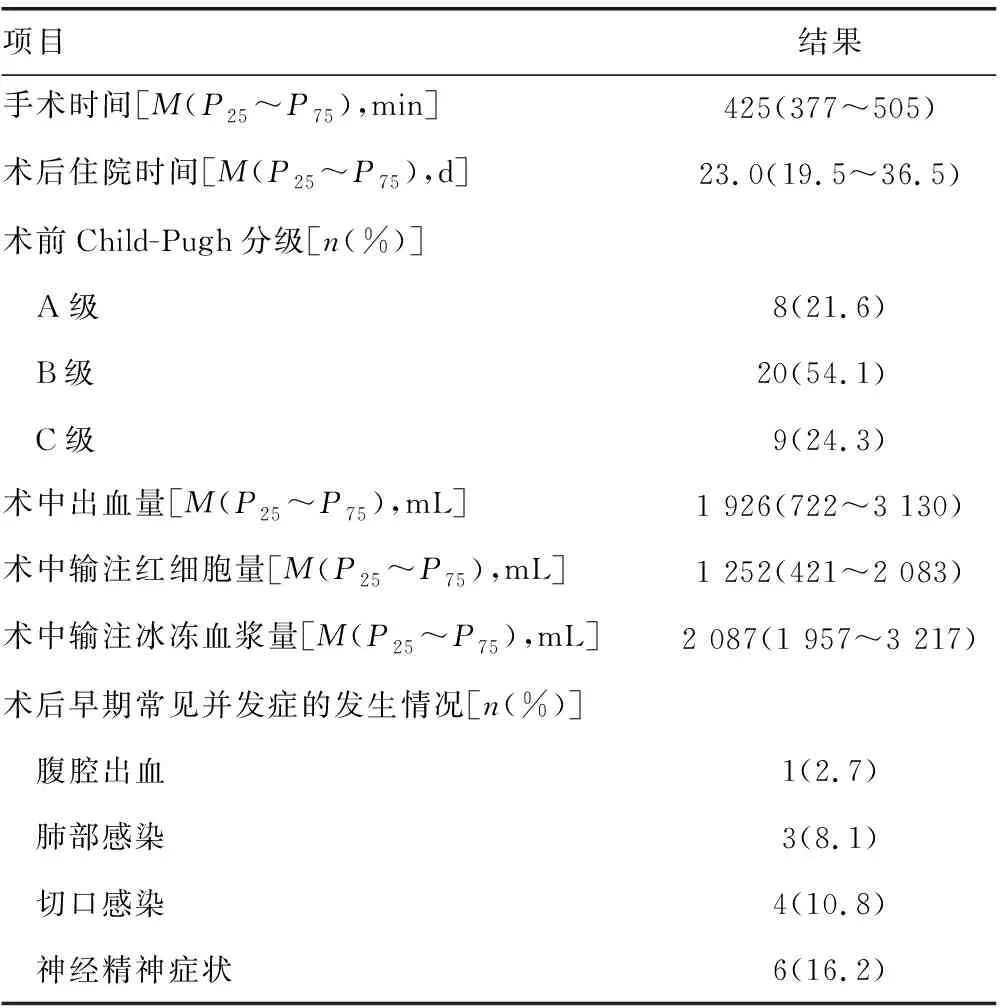
表1 肝移植患者的部分临床资料(n=37)
1.2方法
1.2.1血液标本的采集与保存 对所有纳入研究者于术前及术后1、3、5、7 d,使用非抗凝管采集早晨空腹外周静脉血4 mL,于室温放置30 min后以4 000 r/min离心10 min,留取血清标本,在-80 ℃低温冰箱中保存备用。
1.2.2血清TNC水平检测 以酶联免疫吸附试验(ELISA)检测纳入研究的患者在不同时间点的血清TNC水平。ELISA试剂盒购自英国Abcam公司。操作过程严格按照试剂盒说明书进行。最后,在490 nm波长下以酶标仪检测各孔标准品的吸光度,绘制标准曲线后计算所测标本中的TNC水平。
1.4早期移植物功能评分(MEAF) 采用MEAF对患者术后的早期移植物损伤程度进行评估,评分的计算参照文献[5]中的公式,计算所需的数据包括术后3 d内丙氨酸氨基转移酶(ALT)、国际标准化比值(INR)、胆红素的最高值。
2 结 果
2.1两组间血清TNC水平比较 术前两组TNC水平较低,组间比较差异均无统计学意义(P>0.05)。术后两组TNC水平均升高,且术后1~5 d的上升幅度较大,5~7 d的上升幅度较小,逐渐趋于稳定状态。在各检测时间点,重度肝损伤组的TNC水平高于轻度肝损伤组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者术后血清TNC 水平
2.3TNC水平用于预测移植肝损伤程度的ROC曲线分析 由于术后7 d两组患者血清TNC上升幅度均明显减小,逐渐趋于稳定状态,故将术后7 d时的TNC水平作为预测移植肝损伤程度的指标进行ROC曲线分析。曲线下面积(AUC)为0.888(95%CI:0.781~0.995),最佳临界值为1 489 pg/mL,约登指数为0.715,此时的灵敏度、特异度分别为0.950、0.765。
2.4血清TNC水平与MEAF评分及住院时间的关系 血清TNC水平与MEAF评分呈正相关(r=0.33,P<0.05),与患者住院时间呈正相关(r=0.38,P<0.05),见图1、2。
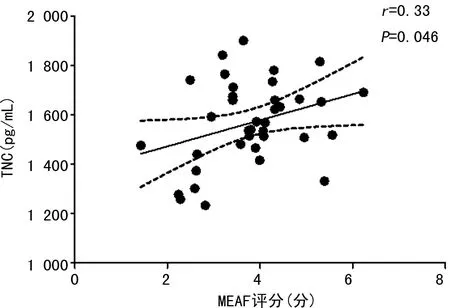
图1 患者血清TNC水平与MEAF评分的关系

图2 患者血清TNC水平与住院时间的关系
3 讨 论
尽管临床肝移植已开展半个多世纪,但早期移植肝损伤和晚期慢性排斥始终是困扰肝移植近期和远期疗效的难题。相对于慢性排斥,移植肝损伤发生时间较早,影响也较为广泛,若发现较晚或处理不当,则会导致移植肝功能不全、原发性移植肝无功能、急性肾损伤、肠道损伤和急性呼吸窘迫综合征等多系统器官功能障碍的发生[7-9],极大增加了肝移植患者围术期并发症发病率和病死率。肝损伤的早发现、早干预对提高肝移植患者生活质量及长期预后有重要意义。目前临床常用于肝损伤评估的指标有ALT、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)等,但这些指标的灵敏度和对预后的预测价值都较为有限,还需要进一步寻找更加敏感的诊断指标。
本课题组在既往的研究中利用肝移植动物模型对移植肝早期损伤的发生机制进行了较为系统的研究。首先,将8例基因敲除小型猪作为供肝来源,对藏酋猴进行辅助性脾窝异位肝移植,通过对移植肝术前和术后的转录基因差异表达谱进行分析,发现术后TNC在移植肝组织内显著上调。随后,构建了同种异基因大鼠肝移植模型,发现移植后7 d,TNC在受体血清中的水平和移植肝组织内表达水平均比对照组有明显升高。进一步的统计分析还表明TNC升高水平与Banff分级评估的排斥活动指数(RAI)呈正相关。这些结果初步证实TNC与肝移植术后早期移植肝损伤有一定联系。
为进一步明确TNC在临床肝移植术后患者体内水平的变化规律,探讨其与移植肝损伤的关系及其检测价值,课题组开展了本项研究。结果表明,TNC在肝移植术后患者体内水平明显升高,与动物实验结果是一致的。依据美国国家癌症研究所发布的2009年版肝功能不全分级标准[6],按照术后第1天的生化指标,将患者分为轻度肝损伤组和重度肝损伤组,比较两组患者的检测结果发现,在术后各检测时间点,重度肝损伤组的TNC水平均明显高于轻度肝损伤组,提示TNC的升高幅度反映了移植肝的损伤程度。ROC曲线分析显示,TNC预测移植肝损伤的AUC为0.888,最佳临界值为1489 pg/mL。TNC水平与MEAF评分、住院时间均呈正相关(r=0.33、0.38,P<0.05)。分析TNC水平与住院时间呈正相关关系的可能原因:术后重度肝损伤组患者的恢复时间较轻度肝损伤组患者长,而TNC水平恰恰反映的是肝损伤的严重程度,与术后移植肝及患者的恢复情况密切相关。术后TNC水平越高,提示肝损伤程度越重,其术后恢复时间可能较长,故住院时间延长。
作为细胞外基质中具有独特六臂体结构的寡聚糖蛋白,TNC的生物学功能十分复杂,目前相关的体内研究资料较少,还不能完全判断其表达规律及检测价值。但已有的研究证据已提示TNC的表达与各种病因所致的肝损伤有一定的联系。例如,BENBOW等[10]在一项针对HCV肝硬化患者的前瞻性研究中发现,TNC在患者血清中的水平显著升高,其升高幅度与AST、终末期肝病模型(MELD)评分、Child-Pugh 评分均呈正相关关系;而TNC联合AST可准确判断HCV感染程度和肝损伤程度,其诊断特异度和灵敏度均优于其他指标。KURIYAMA等[11]在小鼠体内完全敲除TNC表达,然后建立肝脏IRI模型,发现TNC缺乏可减少白细胞在肝脏组织内的蓄积并抑制白细胞介素(IL)-1β、IL-6和趋化因子CXC配体2(CXCL2)的分泌,减轻肝脏的损伤程度并促进肝组织的修复和再生。总的来说,文献[12-14]报道显示TNC在正常肝组织中的表达量很低,但在损伤后的肝组织中表达量出现异常增高,是当前肝脏疾病治疗研究中的重要靶标分子。
本研究初步证实TNC与术后早期移植肝损伤有关,对于明确移植肝损伤程度具有潜在的预测价值。但由于目前缺乏公认的体外研究肝移植机制的细胞模型,因此介导TNC在肝移植术后的表达变化的分子及细胞学机制仍有待进一步探讨。此外,受限于肝移植术后肝组织标本获取困难,未使用临床肝移植术后标本进行TNC相关检测,计划在后续工作中予以完善。
综上所述,TNC在术后早期肝移植患者体内水平异常升高,其反映了移植肝损伤的程度并可能在免疫损伤、IRI等过程中发挥重要作用,可为肝移植术后早期移植肝损伤的诊断和治疗提供新的思路。

