利用QTL-seq定位萝卜肉质根根形指数QTL
胡天华,魏庆镇,汪精磊,王五宏,胡海娇,严亚琴,包崇来
(浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
萝卜(RaphanussativusL.)属于十字花科萝卜属,是一种重要的根菜类蔬菜作物。萝卜以膨大的肉质根为主要产品器官,可以熟食、加工腌制和生食,不仅营养丰富,而且富含糖、维生素和萝卜硫素等物质,具有较高的药用食疗价值[1]。肉质根的大小和形状直接影响萝卜的产量与品质,是萝卜育种的重要目标性状。萝卜的肉质根分为根头部、根颈部和真根三个部分;根头部为短缩茎,其上着生芽和叶,根颈部是幼苗下胚轴发育的无侧根部分,真根一般着生两列侧根。
萝卜肉质根的大小和形状是复合性状,一般可以用肉质根长度、横径、根形指数以及肉质根质量等性状来衡量。萝卜资源中,肉质根的直径最小有1 cm,最大可以到30 cm,肉质根长最短有3 cm,最长可以达到200 cm[2];孙玉燕等[3]将萝卜的肉质根分为圆柱、圆锥、卵圆、扁圆、梨形和圆台等15种主要形状。萝卜肉质根大小和形状为寡基因或多基因控制的数量性状,关于萝卜肉质根大小QTL定位研究较少。荆赞革[4]以肉质根大小差异显著的亲本配制杂交组合,研究了萝卜肉质根质量的遗传规律,发现萝卜肉质根质量是由主基因和多基因控制的数量性状,并分离获得了与其相关的基因组片段。Tsuro等[5]利用F2分离群体构建了包含198个标记的遗传图谱,定位到3个与根形指数相关QTL位点,总共可解释42.4%表型变异率,同时检测到肉质根横径相关QTL位点2个,其中8号连锁群上的QTL位点通过影响肉质根横径来影响根形;Hashida等[6]利用重组自交系群体,结合两年的性状数据,定位到3个与肉质根根重相关的QTL位点。目前,萝卜肉质根大小性状相关的基因定位研究较少,萝卜肉质根大小研究处于QTL初定位阶段,仍未发现有可用的有效的与肉质根大小紧密连锁的分子标记,也未发掘调控肉质根大小相关的主效的基因。与萝卜肉质根发育相关的研究多集中在不同发育时期转录组研究方面[1-2,7-9],相关研究发掘了大量萝卜肉质根不同发育时期的差异基因,但直接调控萝卜肉质根根形相关的基因仍有待发现和验证,肉质根膨大的分子机制也尚未阐明。
数量性状极端性状混池测序技术(QTL-seq)能够通过混池的方法排除复杂遗传背景的干扰,可以在F2代实现主效QTL位点的快速定位[10],已在水稻、番茄和黄瓜等多种作物上得到广泛应用[11-14];萝卜中也利用该方法对萝卜的肉质根皮色和肉质根的肉色进行了基因的定位挖掘[15-16]。随着测序技术的发展和测序成本的降低,目前已公布了5个萝卜的基因组序列[2,17-20],其中Moghe等[18]发表了野生萝卜基因组,其余均为不同栽培萝卜基因组,而且萝卜基因组质量不断提高,最新的基因组利用单分子实时测序技术,基因组contig N50达到了1.2 Mb[20],完整性和连续性均有较大提高,这为不同大小萝卜肉质根形成的关键基因挖掘提供了便利,同时为萝卜分子标记开发及分子育种等提供了重要基础。
本研究以肉质根大小和形状差异较大的亲本配制了F2分离群体,并对根形指数性状进行了QTL定位分析。结合最新的萝卜参考基因组,利用QTL-seq方法,分析获得了4个与肉质根根形指数相关的QTL位点,为萝卜肉质根根形指数性状进一步精细定位和候选基因挖掘克隆奠定了基础。
1 材料与方法
1.1 试验材料与性状统计分析
利用肉质根根形差异较大亲本LLYH与CLA杂交,获得300株F2分离群体。母本LLYH为小型扁圆萝卜,肉质根扁圆形,正常成熟期肉质根长约30.0 mm,最大横径约为35.0 mm;父本CLA为大型长白萝卜,肉质根倒长圆锥形,正常成熟期长约500.0 mm,最大横径约为80.0 mm(图1)。亲本、F1及F2于2018年秋季种植在浙江省农业科学院蔬菜研究所试验基地,9月28日播种,11月12日测量,然后对肉质根长(root length,RL)和肉质根最大横径(root diameter,RD)进行性状数据统计,利用300.0 mm数显游标卡尺进行测量,单位mm,统计标准参照文献[21],同时计算获得肉质根根形指数(RL/RD)。

图1 生长期45 d时的母本、F1和父本的肉质根
1.2 DNA提取与混池测序
选取亲本及F2单株幼嫩叶片进行取样,样品用液氮速冻后,放在-80 ℃超低温冰箱保存备用。根据计算的肉质根根形表型数据,选取10%左右的极端性状个体单株,利用改良的CTAB法分别对每个选取的极端单株进行DNA提取;利用琼脂糖凝胶电泳检测DNA质量,同时用NanoDrop检测DNA浓度,然后根据浓度进行样品DNA等量混池,组成小根形池(S)和大根形池(L)。利用Illumina测序技术平台对亲本及DNA池进行双端测序。
1.3 QTL-seq分析
利用最新发表的萝卜基因组作为参考基因组[20],使用BWA软件获得测序Clean Reads在参考基因组上的比对定位结果,然后使用Picard(http://sourceforge.net/projects/picard/)进行去重复,GATK进行局部重比对、碱基质量值校正等预处理,以保证检测得到的单核苷酸多态性(single nucleotide polymorphism,SNP)准确性,再使用GATK进行SNP的检测和过滤,并得到最终的SNP位点集。然后对SNP进行过滤,首先过滤掉有多个基因型的SNP位点,其次过滤掉read支持度小于4的SNP位点,再次过滤掉混池之间基因型一致的SNP位点以及隐性混池基因不是来自于隐性亲本的SNP位点,最终得到高质量的可信SNP位点。根据QTL-seq方法计算SNP指数[10],以1 Mb为滑动窗口,以10 kb为步移,采用DISTANCE方法对ΔSNP-index进行拟合,计算每个滑动窗口内的平均指数。根据99%的置信区间筛选候选QTL位点区域。
2 结果与分析
2.1 性状统计分析
一共统计了300株F2单株的肉质根长和横径表型数值,其中肉质根长度最小为55.44 mm,最大为275.17 mm,平均值为123.59 mm;肉质根横径最大为43.52 mm,最小为104.20 mm,平均为77.73 mm。肉质根长和横径均呈现连续性变化(图2、图3),是由多基因控制的数量性状遗传。母本LLYH正常商品肉质根(30 d)根形指数约为0.857,父本CLA正常商品肉质根(80 d)根形指数约为3.750,杂交F1肉质根根形指数约为1.764,F2群体中根形指数呈现连续性变化(图4),最小为0.708,最大为3.761,平均值为1.626,暗示根形指数性状是由多基因控制的数量性状遗传[5]。根据表型数值计算3个性状之间的相关性,其中,肉质根长与根形指数相关系数为0.883,肉质根横径与根形指数相关系数为-0.448,肉质根长和横径的相关系数为-0.007(表1)。

图2 F2群体萝卜肉质根长度分布
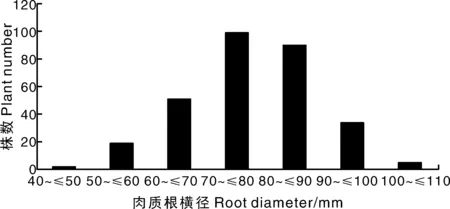
图3 F2群体萝卜肉质根横径分布

图4 F2群体萝卜根形指数分布

表1 表型相关系数
根据肉质根根形指数值,各选取30株极端单株(图5),提取DNA,进行后续的极端混池测序。其中,肉质根根形指数极端小的池根形指数在0.708~1.028,平均根形指数为0.908,肉质根根形指数极端大的池的根形指数在2.407~3.761,平均根形指数为2.838。

图5 F2群体中部分极端混池单株图
2.2 亲本及极端混池测序
本研究经测序得到53.38 Gbp数据,平均Q30达到93.06%,GC含量在37.40%~37.50%之间(表2)。样品与参考基因组平均比对效率为96.31%,亲本测序平均深度为16X,极端池测序平均深度为22.5X,基因组覆盖度为86.62%(至少一个碱基覆盖),亲本及极端池测序质量较好,数据量满足QTL-seq分析要求。利用最新萝卜参考基因组[20],经检测和一系列过滤后,总共获得2 159 693个SNP位点,其中高质量的可信SNP位点913 322个,用于后续QTL-seq分析中SNP-index的计算。

表2 亲本及极端池测序数据统计
2.3 主效QTL位点的检测
根据QTL-seq方法,计算获得△(SNP-index)值,为进一步去除假阳性SNP,利用SNP在基因组上的物理位置信息,对相同染色体上Δ(SNP-index)值进行拟合,然后以1 Mb为滑动窗口,1 kb为步长进行作图,分别划定99%(红色)、95%(蓝色)和90%(绿色)的置信水平作为筛选阈值条件。通过图6可以看出,在R2染色体有两个峰值区域超过99%阈值线,在R6染色体有峰值区域超过95%阈值线,在R4染色体有一小段区域超过90%阈值线。一共获得4个肉质根根形指数相关的QTL位点,根据阈值,其中R2号染色体有两个主效QTL位点rs2.1和rs2.2,R4和R6号染色体分别有两个微效QTL位点rs4.1和rs6.1。根据SNP位置信息和阈值线获得QTL位置区域分别为:rs2.1,21.66~26.03 Mb;rs2.2,30.79~36.56 Mb;rs4.1,39.04~40.43 Mb;rs6.1,11.53~13.40 Mb(图6,表3)。
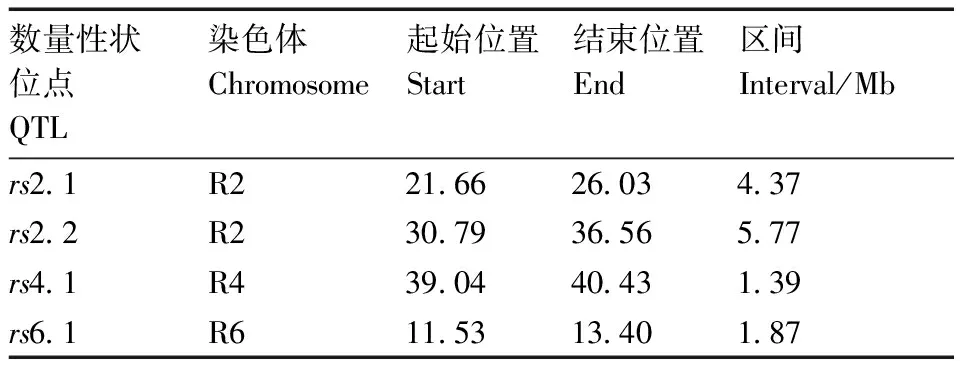
表3 肉质根根形指数QTL位点信息汇总表

横坐标为染色体名称,彩色的点代表计算出来的Δ(SNP-index)值,黑色的线为拟合后的Δ(SNP-index)值。其中红色、蓝色和绿色的线分别代表置信度为0.99、0.95和0.90的阈值线。
3 讨论
萝卜肉质根的根形指数除了受基因遗传调控外,还受到环境与生理等多种复杂因素的影响,因此,开展肉质根根形指数的研究十分有必要,同时也面临较多环境因素的影响,相关基因的QTL定位较为困难。外界因素像光照、温度、水分、矿质营养、二氧化碳和土壤状况等均能影响萝卜肉质根的长度和横径,从而影响萝卜肉质根的根形指数[22-23];同时萝卜肉质根的形成过程中也受到激素的影响,如生长素、细胞分裂素、赤霉素和乙烯等均能影响萝卜的长度和横径[24];此外,也有研究认为萝卜肉质根大小受到光合同化物的影响,蔗糖由源(地上部)向库(地下部)运输的动力来源于蔗糖从叶片的韧皮部装载,然后在肉质根中卸载并储存的驱动[25]。由于萝卜肉质根生长在地下,肉眼难以直接观察,必须将萝卜拔出进行性状统计,这也增加了表型数据的统计误差,使QTL定位准确度降低,增加了基因挖掘的难度。本研究利用肉质根根形指数差异较大的亲本配制了分离群体,所有材料全部种植在土质疏松、透水性较好的砂质土地块,种植过程中也保持水肥一致均衡,尽量减小了外界因素对肉质根生长的影响,以保证定位结果的准确性。因为亲本生长周期差异也较大,小型扁圆萝卜LLYH与大型长白萝卜CLA相比,正常生长周期短近50 d,所以F2单株每个萝卜的生长周期也不同,本研究采取了集中统一采收的方式,在生长期45 d时,全部进行肉质根长度和横径的表型数据测量;此时,有的萝卜可能已经超过了正常的生长期,有的萝卜可能刚完成正常生长周期,达到商品萝卜要求,有的萝卜可能还处于生长发育早期,这也可能对定位结果造成一定的影响,因此,定位结果中也有可能存在与肉质根生长发育相关的QTL位点。
前人研究多集中在不同发育时期萝卜肉质根转录组、miRNA和蛋白质组方面。Zaki等[26]发现,有11个基因在两个不同肉质根形状的萝卜中存在明显差异;Wang等[7]发现,植物激素在肉质根的发育过程中起了重要作用;Mitsui等[2]对肉质根发育时期做了详细生物学观察和转录组分析,发现碳水化合物代谢相关基因在发育的肉质根中表现活跃,尤其是在细胞增殖的组织中,同时发现蔗糖合酶(SUS1)基因与肉质根发育相关;余如刚[1]分析了2个萝卜蔗糖代谢基因RsSuSy1和RsSPS1基因,克隆分析了萝卜肉质根形成相关RsCLE41和RsSAUR;杜雪玲等[9]发现,植物激素合成与激素信号转导相关基因、蔗糖代谢相关基因和细胞壁代谢相关基因可能是调控萝卜肉质根大小品种间差异的关键基因;Muvva等[27]在萝卜中发现了48个保守miRNAs,并预测了16个潜在的基因;余如刚[1]预测了191个肉质根膨大过程中差异表达miRNA的靶基因,另外通过DGE和miRNAs关联分析,鉴定到114对miRNA-mRNA。此外,姜立娜[28]在肉质根发育不同时期发现25个差异明显蛋白点,并对差异蛋白基因情况进行了分析。以上研究发现的差异基因可以结合QTL定位结果,去挖掘定位区域内的差异基因,并验证候选基因是否与肉质根的大小相关;通过基因组、转录组、蛋白组和代谢组等多组学联合的方法系统分析萝卜肉质根的膨大机理。不过,前期研究虽然发现了较多差异基因,但是这些差异基因相关序列信息难以查找汇总;各项研究可能参考了不同版本萝卜基因组,不同版本萝卜基因组存在的差异也使相关差异基因的序列难以进行汇总分析。
蔬菜变态根的发育受到外部环境和内部遗传因素的综合影响,涉及细胞周期、植物激素、转录因子等不同方面的调控,目前,对蔬菜变态根发育的研究还处于初步阶段[3]。萝卜是典型的变态根类蔬菜,肉质根大小和形状相关研究较少,萝卜肉质根大小和形状QTL定位研究可以参考番茄、甜瓜和黄瓜等果实大小和形状的相关研究[29-31],但相较于果实性状的研究,长在地下的肉质根相关性状明显难度更大,相关的调控机理也存在较大差异。目前,关于萝卜肉质根根形指数性状的QTL定位研究较少,前期虽有利用连锁群进行根形指数定位研究[5],但因为遗传图谱精度不够,上图标记较少,所用材料存在差异等因素,较难进行对比。萝卜根形指数研究还需要开展更多的QTL定位研究,发现一些一致性的QTL位点,并结合特殊的群体和先进测序技术,进行后续的基因精细定位和功能验证研究。

