贝利尤单抗治疗系统性红斑狼疮的短期临床观察
许 蕾 朱 芸 张 昊
1.潍坊医学院临床医学院研究生院,山东潍坊 261053;2.山东省潍坊市人民医院风湿免疫科,山东潍坊 261041
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种B 淋巴细胞刺激物(B lymphocyte stimulator,BlyS)过度表达和自身抗体产生过多为特征的自身免疫性疾病[1]。激素、抗疟药及免疫抑制剂是目前临床中治疗SLE 的标准治疗(stand of care,SoC)[2],然而长期应用药物毒副作用及器官损害风险的增加[3]。贝利尤单抗(Belimumab,Benlysta;GlaxoSmithKline)是目前唯一获得批准的用于治疗SLE 的靶向生物制剂[2],可抑制BlyS,减少自身抗体的产生,降低器官损害发生风险[4],其有效性及安全性已经在国外的研究中得到证实[5-7]。本研究旨在探讨贝利尤单抗治疗中国SLE 的疗效和安全性。
1 资料与方法
1.1 一般资料
选取2019 年9 月至2020 年8 月山东省潍坊市人民医院(以下简称“我院”)风湿免疫科确诊为SLE患者共42 例,按照治疗方案将患者分为两组:SoC 组21 例,其中男1 例,女20 例;年龄15~55 岁,平均(30.86±12.06)岁;病程1~20 年,平均(8.71±4.55)年;Belimumab 组21 例,男2 例,女19 例;年龄12~56岁,平均(34.05±10.16)岁;病程1~22 年,平均(9.57±5.30)年。纳入标准:符合2019 年欧洲抗风湿病联盟(EULAR)和美国风湿病学会(ACR)推荐的SLE 分类标准[8]。排除标准:重度活动性中枢神经系统狼疮、重度活动性狼疮肾炎、肝炎病毒感染等,以上研究者均签署知情同意书,且研究经我院医学伦理委员会审批。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性。见表1。
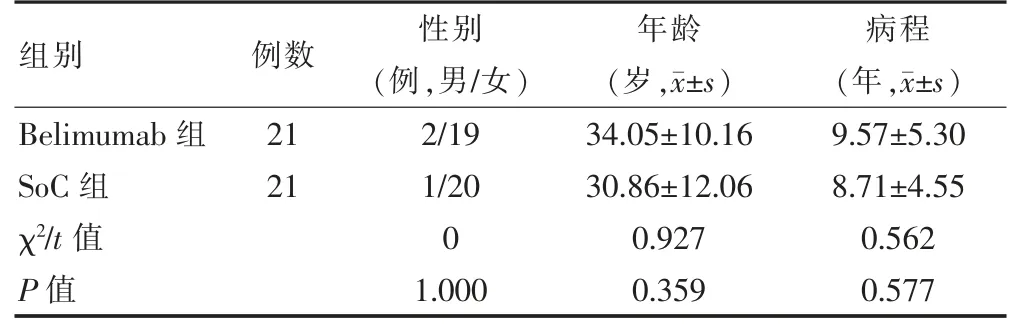
表1 两组一般资料比较
1.2 治疗方法
SoC 组仅使用标准治疗,在起始时给予泼尼松(药品名:醋酸泼尼松片,浙江仙琚制药股份有限公司;批号:191109),起始剂量为5~50 mg/d;羟氯喹(药品名:纷乐,上海上药中西制药有限公司;批号:190370)0.4 g/d。他克莫司(药品名:赛福开,杭州中美华东制药有限公司;批号:200764)1 mg/d。Belimumab组在SoC 组基础上加用贝利尤单抗(药品名:Benlysta,GlaxoSmithKline;批号:WA7K)10 mg/kg,在第0、2、4、8,12、16、20、24 周给予静脉滴注。两组在治疗过程中依据病情酌情调整药物,定期检测相关免疫学指标。
1.3 观察指标及检测方法
治疗24 周前后比较两组检验指标,如补体C3(正常值0.79~1.52 g/L)、补体C4(正常值0.16~0.38 g/L)、免疫球蛋白G(IgG,正常值7.51~15.6 g/L),在每次给药前2 h 取外周静脉血,补体、免疫球蛋白的检测采用免疫比浊法,检测试剂盒购自美国贝克曼库尔特公司,批号:20191009)。观察治疗前后两组激素剂量。观察治疗前后两组临床症状情况,包括皮疹、口腔溃疡并进行疾病活动度指数(SLEDAI)评分[9]。治疗24 周后评价两组的临床疗效:参照《2020 中国系统性红斑狼疮诊疗指南标准》[10],比较两种治疗方式下患者临床总有效率,显效:治疗后患者临床症状完全消失,补体、免疫球蛋白等检测指标也恢复正常;有效:患者症状得以有效缓解,免疫学指标改善1/3 及以上;无效:患者治疗之后临床症状未改善甚至出现恶化,血清学指标未改善甚至加重。总有效率=(显效+有效)例数/总例数×100%。不良反应:头痛、恶心、呕吐、皮疹、感染。
1.4 统计学方法
采用SPSS 23.0 统计学软件进行数据处理。计量资料采用Kolmogorov-Smimov 进行正态性检验,满足正态分布的数据采用均数±标准差()表示,两组间比较采用独立样本t 检验;非正态分布采用中位数(四分位数)[M(P25,P75)]表示,组间比较采用秩检验检验。计数资料以例数和百分比表示,组间比较采用χ2检验,T <5 连续校正卡方,应用Fisher 精确概率法。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗后,Belimumab 组总有效率高于SoC 组,差异有统计学意义(P <0.05)。见表2。
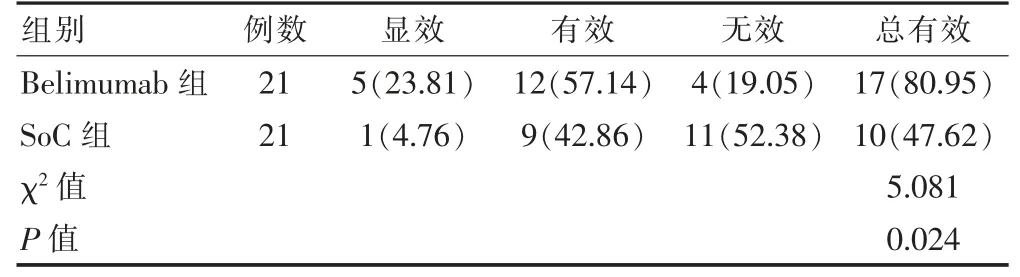
表2 两组临床疗效比较[例(%)]
2.2 两组治疗前后免疫指标的比较
治疗前两组各免疫指标比较,差异无统计学意义(P >0.05);治疗后两组C3、C4 高于治疗前,IgG 低于治疗前,且Belimumab 组补体C3、C4 高于SoC 组,IgG低于SoC 组,差异有统计学意义(P <0.05)。见表3。
表3 两组治疗前后免疫学指标比较(g/L,)
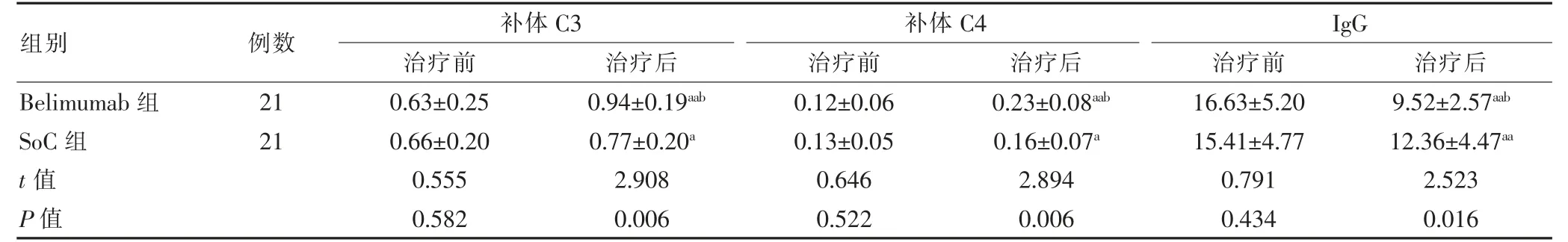
表3 两组治疗前后免疫学指标比较(g/L,)
注:与本组治疗前比较,aP <0.05,aaP <0.01;与SoC 组治疗后比较,bP <0.05。IgG:免疫球蛋白G
2.3 两组治疗前后激素剂量比较
治疗前两组激素剂量比较,差异无统计学意义(P >0.05),治疗后两组激素剂量低于之治疗前,且Belimumab 组低于SoC 组差异有统计学意义(P <0.05)。见表4。
表4 两组治疗前后激素剂量比较(mg/d,)
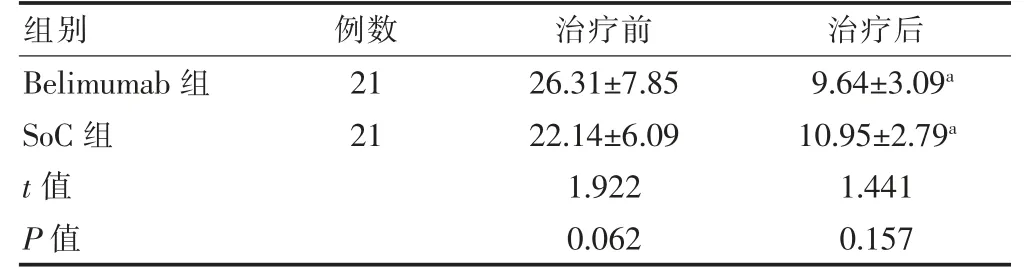
表4 两组治疗前后激素剂量比较(mg/d,)
注:与本组治疗前比较,aP <0.05
2.4 两组治疗前后SLEDAI 评分比较
治疗前两组SLEDAI 评分比较,差异无统计学意义(P >0.05),治疗后两组SLEDAI 评分低于治疗前,且Belimumab 组低于SoC 组,差异有统计学意义(P <0.05)。见表5。
表5 两组治疗前后SLEDAI 评分比较(分,)

表5 两组治疗前后SLEDAI 评分比较(分,)
注:与本组治疗前比较,aP <0.05。SLEDAI:系统性红斑狼疮疾病活动指数
2.5 两组患者不良反应比较
两组治疗过程中均未见到严重的不良反应的发生;治疗后,Belimumab 组出现感染3 例、发热1 例,总发生率为19.05%(4/21)。SoC 组感染5 例、发热3 例,总发生率为38.10%(8/21)。两组不良反应发生率比较,差异无统计学意义(P >0.05)。
3 讨论
SLE 是一种复杂的慢性自身免疫性疾病,其发病机制尚不完全清楚,有研究通过实验发现SLE 患者血清中BlyS 水平较正常组明显升高,造成B 淋巴细胞在SLE 患者中过表达,提示BlyS 可能是SLE 中潜在的重要治疗靶点[11-12]。Nakayamada 等[13]发现贝利尤单抗可以与BlyS 结合,抑制B 细胞的活化,减少自身抗体的产生。
国外大量的试验均证实使用贝利尤单抗可以减少激素剂量,减少疾病复发,且具有良好的安全性[14-16],但目前贝利尤单抗治中国SLE 患者的疗效和安全性鲜有报道。本研究将Belimumab 组的患者与SoC 组的患者进行了对照研究,两组的性别、年龄、病程比较,差异无统计学意义(P >0.05)。两组治疗后补体、免疫球蛋白、SLEDAI 评分均较治疗前改善,差异有统计学意义(P <0.05);Belimumab 组补体及免疫球蛋白指标改善较SoC 组明显,且疾病活动度低于SoC 组,差异有统计学意义(P <0.05),两组激素剂量比较,差异无统计学意义(P >0.05),暂不考虑激素所致两组血清学指标的差异,提示贝利尤单抗在改善低补体、高球蛋白血症及降低疾病活动度方面的治疗效果显著。但本研究样本量少、观察时间短,仍需大规模、长期的临床研究论证。
激素和免疫抑制剂作为系统性红斑狼疮治疗的基础药物,长期应用副作用大,贝利尤单抗可以减少激素和免疫抑制剂的使用,从而减少药物的不良反应,延缓疾病进展[5-6]。有研究认为尽早的使用贝利尤单抗可以最大限度地发挥其治疗SLE 的作用[17-19]。国外研究发现贝利尤单抗治疗的常见不良反应有病毒性上呼吸道感染、腹泻,在随访时发现病毒感染-特别是EB 病毒感染易导致疾病的活动[20],本研究中使用Belimumab 组的患者出现感染、发热,完善相关化验提示EB 病毒抗体阳性,给予抗病毒治疗后症状好转。
过去对于SLE 的治疗多以延长患者生存期为目的[21],随着人们对其发病机制的进一步研究及治疗方法的改善[22],实现疾病的持续缓解为治疗的理想状态,但其很难实现[23-24]。目前认为SLE 的治疗目标达到的最低疾病活动水平,降低器官损害,改善预后[25]。
综上所述,本研究初步显示贝利尤单抗+SoC 治疗SLE 可以更良好地降低疾病活动度,减少疾病复发,其安全性仍在进一步的临床随访中。由于本研究样本量小,贝利尤单抗治疗中国SLE 患者的安全性和有效性仍需大规模临床试验研究。

