增强采样副本交换分子动力学研究端基对Tau74蛋白结构特征的影响
石虎,姚泽帅
(山西大学 化学化工学院,山西 太原,030006)
0 引言
阿尔茨海默病(Alzheimer’s disease,AD),又名老年痴呆症,是一种常见的神经退行性疾病[1]。临床上有两种表现:(1)细胞外的淀粉样斑块沉积,其主要成分为 β-淀粉样蛋白[2-3];(2)细胞内纤维状缠结,其主要成分为Tau蛋白[4-5]。Tau蛋白属于微管相关蛋白家族。它们主要在神经元中表达。在微管蛋白单体组装成微管构成神经元微管网络中起重要的作用。AD患者神经细胞中,Tau蛋白发生聚集是导致神经细胞萎缩和死亡的主要原因[6]。因此,要理解Tau蛋白的聚集过程就需要探索Tau蛋白的结构性质。
与微管结合的Tau蛋白是本质无序蛋白,同时具有很好的可溶性,其在人体中枢神经系统中大量存在[7]。Tau的结构如示意图1A所示,包含N端、酸性区、脯氨酸富集区域、重复(Repeat)区域和C端。在全长的Tau蛋白中,N末端和C末端都是高度无序结构[8]。Repeat区域是整个Tau蛋白中最关键的区域,其原因在于repeat结构特征不但与tau蛋白-微观结合相关,而且与致病纤维状聚集有关[9-12]。对于纤维聚集体的实验研究显示,Tau聚集体的β-sheet核心也就集中在repeat区域[13-14]。
Repeat区域分为R1、R2、R3和R4四个区域,其中R2区域也可以出现缺失状态。现有的研究表明,repeat区域的结构特征也趋向于自由卷曲状态[15-17]。作者Huan He独立的R1~R4的单体模拟研究显示:R1、R2和R4取向螺旋结构,而R3则倾向于折叠结构[18]。二级结构的结构特征如示意图1B所示。LI对R3在不同组氨酸异构条件下的模拟结果显示:R3片端为非集中结构特征,其聚类最高值在 2.4%(εε)、10.8%(εδ)、1.0%(δε)和 10.6%(δδ)[19]。模拟结果上的差异可能来源于对端基处理的不同,因此,本论文将选取Tau蛋白尿片段并探索其在不同端基条件下的结构性质差异。为了更好地排除片段中N末端和C末端的影响,我们选择的Tau片段从R1的末端开始延伸到R4的N末端。

示意图1 Tau蛋白的结构以及Tau74序列(A);α-helix、parallel β-sheet和 antiparallel β-sheet的二级结构特征(B)Scheme 1 The structure of Tau protein and the residual sequence of Tau74 fragment(A).The secondary structure of α-helix,parallel β-sheet,and antiparallel β-sheet(B)
1 模拟方法
本文使用副本交换分子动力学(replica-exchange molecular dynamics,REMD)对 Tau74和Tau74c蛋白片段进行增强采样分子动力学模拟。REMD是一种增强采样的分子动力学模拟方法。其模拟过程中会设定多个副本对应着由低到高的多个温度。在模拟过程中,副本之间可以发生一定概率的结构交换。因此,此方法有助于系统跨越势能面中的局域最小值。
模拟过程中,Tau74和Tau74c初始结构为线型的氨基酸长链,REMD模拟使用了Amber 18软件、ff14SBonlysc力场和隐形水模型[20]。模拟过程中使用了SHAKE和Particle mesh Ewald设置。本文中,每个REMD模拟共设定了10副本,对应温度范围为310 K~510 K。模拟时间步长为2 fs,并设定副本之间每4 ps交换一次。每组体系一共进行了700 ns的REMD模拟。本文中,REMD的交换概率约为10.0%~10.4%,整个模拟过程中最低副本对应温度极限的往返次数为5~6次,验证了本文REMD采样的合理性。
2 结果与讨论
2.1 判断REMD模拟平衡
为了判断REMD的平衡,首先统计了不同时间尺度上的聚类特征,从图1所示:Tau74(图1A,图2A)体系在300 ns~500 ns与500 ns~700 ns所对应的聚类分布趋势一致,可以判定,此时Tau74已经处于动力学平衡阶段。因此,后续的结构特征分析仅使用300 ns~700 ns所对应平衡的400 ns轨迹。同理,Tau74c体系(图1B,图2A)在300 ns~500 ns与500 ns~700 ns所对应的聚类分布趋势也保持一致,仅使用最后平衡的400 ns轨迹用于下文中的结构分析。
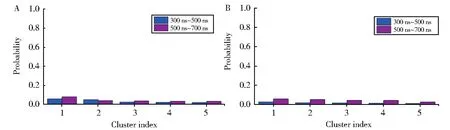
图1 不同时间尺度上Tau74(A)和Tau74c(B)的聚类特征Fig.1 Different time scale for Tau74(A)and Tau74c(B)fragments on cluster properties
2.2 Tau74和Tau74c蛋白的二级结构特征
为了评估Tau74和Tau74c的结构特征,蛋白质二级结构分析结果如图2BCD所示,Tau74和Tau74c体系中都几乎没有平行β-sheet结构的产生(图2B),而反平行β-sheet却存在着巨大的差异,在Tau74体系中,β-sheet结构出现在G9-S25(35.9%~99.3%)、G28-P37(35.6%~84.3%)、G39-P48(18.1%~99.4%)和 L61-P68(12.7%~79.7%)四个区域。而在Tau74c体系中,β-sheet结构出现在G8-L18(32.5%~97.5%)、D31-P37(22.8%~57.1%)、G40-D50(22.1%~76.3%)、T55-L61(33.7%~62.3%)和 I64-H66(22.4%~41.5%)五个区域(图2C)。其差异性集中表现在D19-Q24和T55-L61两个区域,在Tau74c体系中N15-S25具有稍高的α-helix含量,而Tau74中,αhelix结构稳定在P48-C58(7.3%~51.2%)区域(图2D)。二级结构分析的结果显示,通过乙酰基(acety group,ACE)和甲胺基(N-methylamide,NME)保护后的Tau74c片段和无保护Tau74片段的二级结构特征存在巨大的差异。也就是说,端基在Tau74/Tau74c片段的折叠过程中发挥着非常重要的作用。

图2 Tau74和Tau74c的结构(A)及其对应的平行β-sheet(B)、反平行β-sheet(C)和α-helix(D)的特征Fig.2 Modeling structures of Tau74 and Tau74c(A)and characters of corresponding parallel β-sheet(B),antiparallel β-sheet(C),and α-helix(D)properties in each system
2.3 Tau74和Tau74c蛋白的聚类结构特征
为了进一步探索空间结构特征的稳定性,我们使用聚类分析程序对400 ns稳定的轨迹进行结构聚类。聚类标准选用alpha-C原子。结果显示,Tau74和Tau74c两个体系都表现出非集中的结构特征,此结果与平衡判断的结果相一致,也反映出了Tau是本质无序蛋白的特征[15-17]。
然而,在Tau74含量最高的五个聚类结构特征可以看出,sheet区域(图3绿色区域)基本保持不变,而N端(蓝色小球)和C端的变化范围却非常大。其端基局域结构的变化引起了聚类分析中非集中结构特征的出现。由此可见,N端和C端所处的环境将非常容易引起Tau蛋白的结构变化。考虑到Tau74蛋白是处于Tau整体中的一个局域片段。因此,选择ACE和NME端基保护Tau蛋白片段至关重要,否则非保护策略下端基的行为将严重影响了Tau74蛋白原本的结构性质。由此可见,Tau蛋白模拟过程中应选取端基保护策略,其直接影响着模拟结果的正确性。
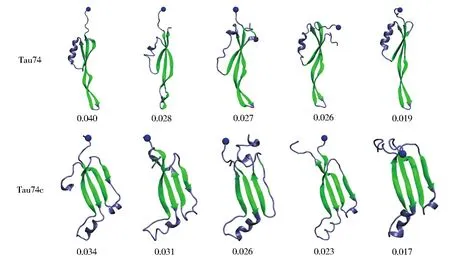
图3 Tau74与Tau74c的前五种聚类结构特征与对应的含量Fig.3 Most abundant five conformational states by cluster analysis and their probability distributions
2.4 Tau74和Tau74c蛋白的氨基酸接触特征
为了进一步的探索Tau74和Tau74c两者之间的氨基酸相互作用规律,基于alpha-C计算得到的氨基酸接触图如图4所示。在Tau74体系中(图4A)一个稳定的反平行β-sheet结构出现在G38-Y46与G8-K16位置。此结果表明,虽然Tau74蛋白在聚类分析中无法保持一种集中的结构行为,但是β-strand G38-Y46片段与β-strand G8-K16片段之间的β-strand相互作用非常稳定。相比之下,Tau74c体系中(图4B),没有任何β-strand结构出现。此结果进一步验证了端基对Tau74/Tau74c蛋白的结构稳定性影响非常大。在含有端基(ACE和NME)保护的条件下,相比于稳定Tau74中规律的相互作用特征,Tau74c表现为自由柔性多变的结构特征。
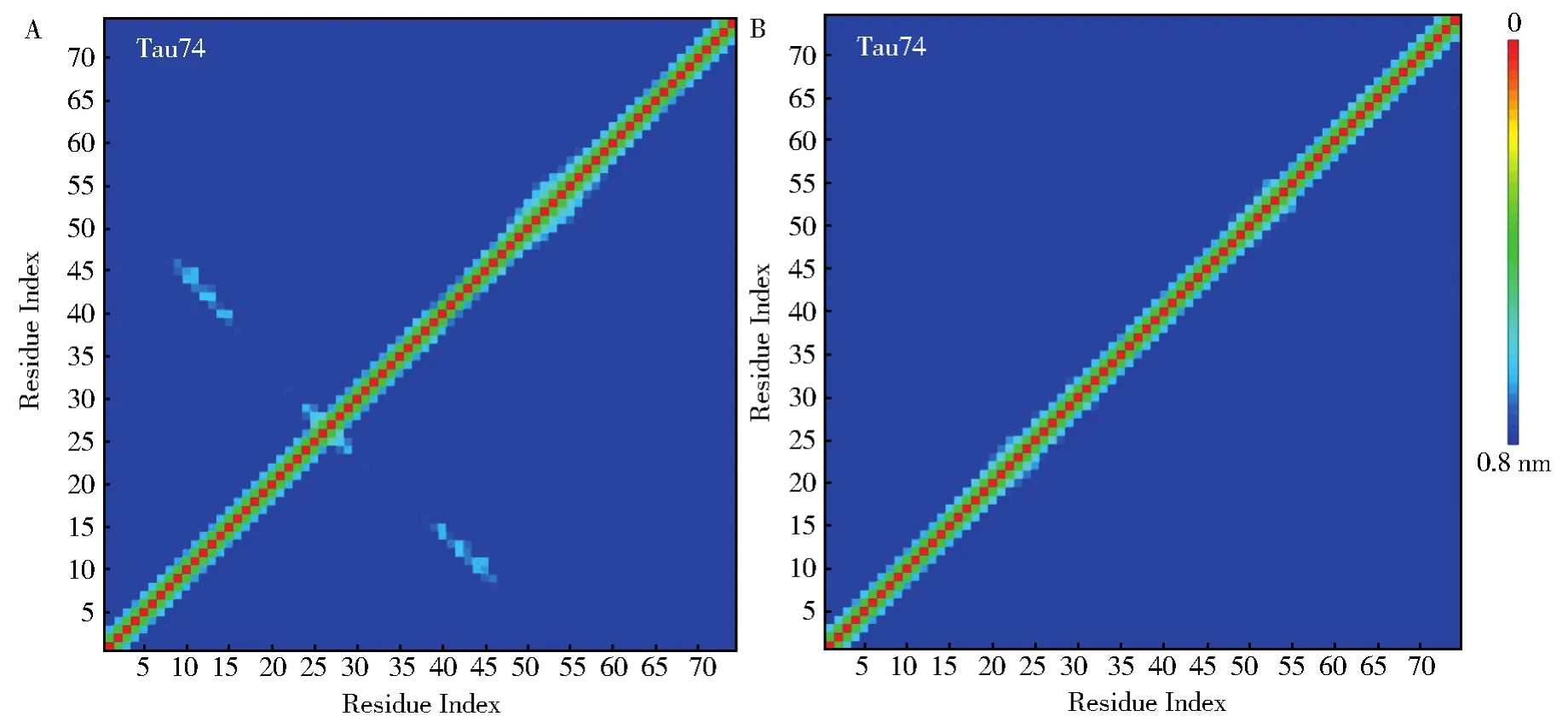
图4 Tau74和Tau74c的氨基酸接触图Fig.4 Contact map of Tau74 and Tau74c fragments
3 结论
本文针对神经纤维状缠结中Tau蛋白,使用REMD模拟方法研究了Tau74和Tau74c的结构特征。二级结构分析表明Tau74和Tau74c两者的结构存在巨大的差异,特别是D19-Q24和T55-L61两个区域,在Tau74c体系中N15-S25具有稍高的αhelix含量,而Tau74中,α-helix结构稳定在P48-C58(7.3%~51.2%)区域。聚类的结果显示Tau74和Tau74c两者都表现出本质无序的结构行为,其主要原因在于端基区域的自由变化掩盖了结构细节。深层的分析证明了Tau74中存在着稳定的β-strand G38-Y46片段与β-strand G8-K16片段之间的βstrand相互作用,而Tau74c仅表现为自由柔性结构特征。本论文结果论证了Tau蛋白模拟过程中应选取端基保护策略,此将直接影响着模拟结果的正确性。

