基于二氰基异佛尔酮的新型比率型荧光探针检测活细胞中的ClO-
阴彩霞,李莎,霍方俊
(1.山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,能量转换与存储材料山西省重点实验室,山西 太原 030006;2.山西大学 应用化学研究所,山西 太原 030006)
0 引言
在我们的日常生活中,次氯酸(HClO)和次氯酸盐(ClO-)由于具有强氧化性而被广泛使用。饮用水中细菌的处理,纸张和工业纺织品的漂白都与这种强氧化剂的作用密不可分[1-2]。特别是,HClO在新型冠状病毒(新型冠状病毒(2019-nCoV))事件中作为主要消毒剂发挥了关键作用。而在正常的生理条件下,保持一定浓度范围的活性氧(ROS)已被证明在维持细胞形态和维持基本细胞功能中起重要作用[3]。ROS参与许多生理过程,例如氧化还原稳态调节和生物信息传递[4-5]。氧化还原稳态为生物体提供了一个合适的内部环境,以执行高度智能的防御系统来抵抗细菌和病毒感染[6-7]。HClO作为一种ROS,在生理和病理过程中也起着重要的作用[8-11]。HClO浓度异常会导致许多疾病,例如心血管疾病[12],肾脏疾病[13],炎性疾病[14]和某些癌症[15]。因此,体内快速检测HClO对治疗疾病非常有帮助。
鉴于HClO的上述生理和病理特性,迫切需要一种特定的超快速检测工具来可视化活细胞中ClO-浓度的波动,这对于通过制定相应的方法来预防相关疾病是至关重要的干预策略。基于有机小分子的荧光探针结合荧光成像技术[16-17],凭借其特异性好,灵敏度高和现场监测的独特优势,已成为现代生命科学和疾病诊断中重要的研究方法[18-23]。由于ClO-的强氧化性,用于检测ClO-的荧光探针的分子结构发生变化,从而导致了荧光光谱的变化。常见的荧光团主要包括以下几类:罗丹明由于其出色的光物理性质和高量子产率而被广泛用于探针的构建[24-27];荧光素作为一种染料,由于其良好的水溶性和出色的荧光发射性,为荧光探针的设计提供了一种很好的方法[28-29];BODIPY衍生物由于其高对称性和稳定的结构而用于探针合成,并且在紫外可见光谱中表现出强吸收性[30-33];花菁具有复杂的共轭体系和高摩尔吸收系数,可在近红外区域进行检测[34-35];萘二甲酰亚胺因其高的荧光量子产率而广泛用于探针的合成[36-38]。不幸的是,大多数探针的溶解度差,水溶性差,荧光量子产率低。因此,迫切需要设计一种性能良好并且超快速检测ClO-的荧光探针。
二氰基异佛尔酮(DCI)的染料因为具有ICT效应可以产生优异的荧光性能,从而具有吸引力,受到了广泛的关注[39-40]。此外,DCI的C=C键经常被用作HClO的反应位点,在温和的条件下,HClO可以将其氧化为醛或酮[41-44]。由于分子结构的变化,该分子实现了对HClO的快速荧光检测[45]。因此,考虑到上述情况,我们基于噻吩醛(供体)和DCI(受体)荧光染料合成了一种新型的ClO-荧光探针YN。YN具有良好的光稳定性,并在565 nm处有黄色发射峰。添加ClO-时,它会在500 nm处产生蓝光发射峰。此外,低检测限(2.8 μmol/L)和超短响应时间(8 s)均表明YN可以特异性检测ClO-。最重要的是,该探针对ClO-具有高的选择性和灵敏性,可以实现ClO-的实时监测。
1 基本原理
1.1 实验仪器与试剂
实验中使用的化学药品和试剂是商业购买的,无须纯化即可用于实验中。所有溶液均使用学校准备的去离子水制备。使用HITACHI U-3900分光光度计进行紫外可见光谱,使用HITACHI F-7000分光光度计进行荧光光谱。使用Bruker AVANCE-600 MHz光谱仪通过1H NMR和13C NMR表征合成的探针,然后使用AB Triple TOF 5600plus系统(AB SCIEX,弗雷明汉,美国)进行质谱分析。最终的生物成像应用通过Zeiss LSM880 Airyscan共聚焦激光扫描显微镜进行测量。
1.2 探针的合成
化合物N的合成步骤:在50 mL圆底烧瓶中,将 4-溴-N、N-二甲基苯胺(306 mg,1.58 mmol)和四(三苯基膦)钯(150 mg,0.13 mmol)溶解在 10 mL甲苯中。将5-甲酰基-2-噻吩硼酸(200 mg,1.28 mmol)溶于8 mL乙醇中,再加入2 mL K2CO3(2 mol/L),在115°C下加热回流。氩气保护并保持5 h。冷却至室温,减压除去甲苯。然后将化合物溶于二氯甲烷,有机相用水洗涤3次,无水Na2SO4干燥。然后通过减压除去溶剂得到粗产物。最后以石油醚和二氯甲烷(1∶2,V/V)为洗脱液,经柱层析纯化,最终得到橙色固体N(103 mg,35%)。
YN的合成步骤:在25 mL烧瓶中加入N(70 mg,0.2 mmol)、异氟尔酮(46 mg,0.2 mmol)和 10 mL乙醇。然后加热至85℃并在此温度下回流8 h。自然冷却,减压除去溶剂后得固体,以甲醇和二氯甲烷(1∶10,V/V)为洗脱液,经柱层析纯化,得到蓝黑色产物YN(61mg,54%)。YN:1H NMR(600 MHz,CDCl3):δ7.53(d,J=8.5 Hz,2H),7.18(d,J=15.6 Hz,1H),7.14(s,2H),6.81-6.68(m,4H),3.05(s,6H),2.60(s,2H),2.44(s,2H),1.09(s,6H);13C NMR(151 MHz,CDCl3):δ168.90(s),154.02(s),150.54(s),148.84(s),138.61(s),131.90(s),130.51(s),126.96(s),122.43(s),121.80(s),114.00(s),113.19(s),112.35(s),58.50(s),42.93(s),40.37(s),39.12(s),32.02(s),29.56(d,J=50.4 Hz),29.35(s),28.05(s),22.72(s),18.45(s),14.20(d,J=9.7 Hz)(图2);HR-MS m/z:计算得 400.184 7;实测值:m/z:400.184 1(图3)。
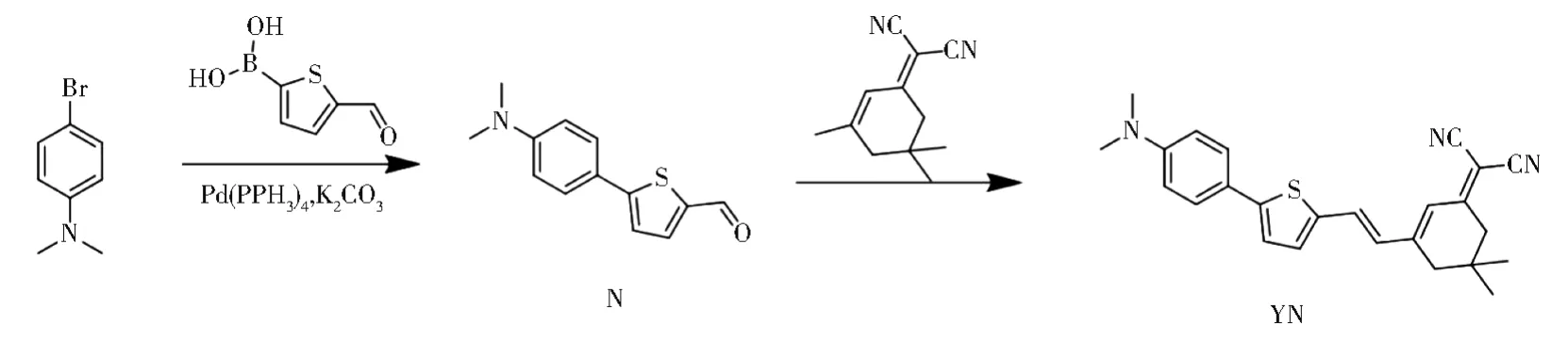
图1 探针YN的合成路线Fig.1 Synthesis route of probe YN
合成路线如图1所示[5]。
1.3 光谱测定
将YN溶于DMSO,制成2 mmol/L储备液。经过筛选体系后,我们选择DMSO/PBS(1/1,V/V,pH=7.4)作为测试体系,探针的量为10 μmol/L。配置100 μmol/L的NO3-;I-;S2-;S2O32-;Br-;Cl-;F-;NO2-;CH3COO-;OH-;.O2;ONOO-;Cys;Glycine;GSH;H2O2;Hcy;L-Cystine;LGlutamate;L-Lysine ;L-Proline;SO42-;SNP;TBHP;Na+;Mg2+;Ca2+;K+溶液(通过直接溶解在去离子水中来制备)。由KH2PO4和Na2HPO4制备了不同的PBS缓冲液。
2 结果与讨论
2.1 探针YN对ClO-的紫外可见光谱
探针YN对ClO-的紫外滴定用HITACHI U-3900紫外-可见光谱仪进行测定。检测ClO-的紫外-可见吸收光谱如图4所示,在PBS(pH=7.4,50%DMSO)中研究了YN和ClO-之间反应的紫外可见光谱。YN在360 nm和550 nm处有吸收峰。随着ClO-的添加,在360 nm和550 nm处的吸收峰逐渐升高。紫外-可见光谱滴定实验表明,YN可以选择性地检测ClO-。
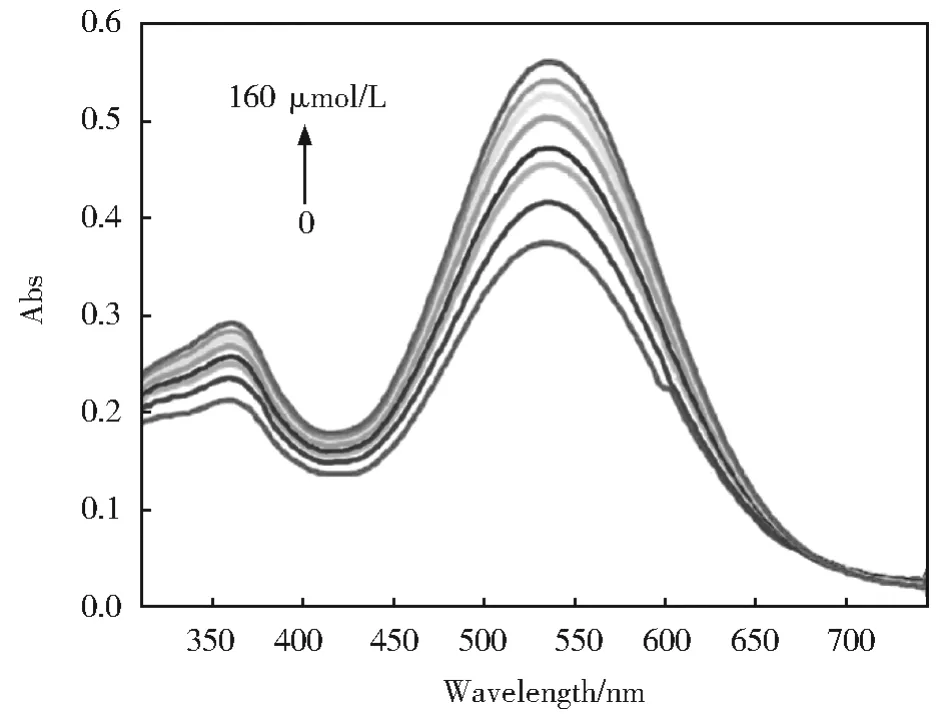
图4 在PBS(pH=7.4,50%DMSO)中,YN(10 μmol/L)在不同浓度ClO-下的紫外-可见吸收光谱Fig.4 UV-Vis absorption spectra of YN(10 μmol/L)in the presence of various concentrations of ClO-in PBS(pH=7.4,50%DMSO)
2.2 探针YN对ClO-的荧光光谱
接下来,我们对PBS(pH=7.4,50%DMSO)中的YN和ClO-进行了荧光光谱研究(激发狭缝宽度/发射狭缝宽度:5 nm/5 nm,激发波长:420 nm)。如图5所示,YN在420 nm激发下发射峰在565 nm处显示弱发射。当加入ClO-后,荧光发射峰发生蓝移,并在500 nm处明显增加。当ClO-加入160 μmol/L时,反应基本完成。由此,YN可以用作识别ClO-的荧光探针。
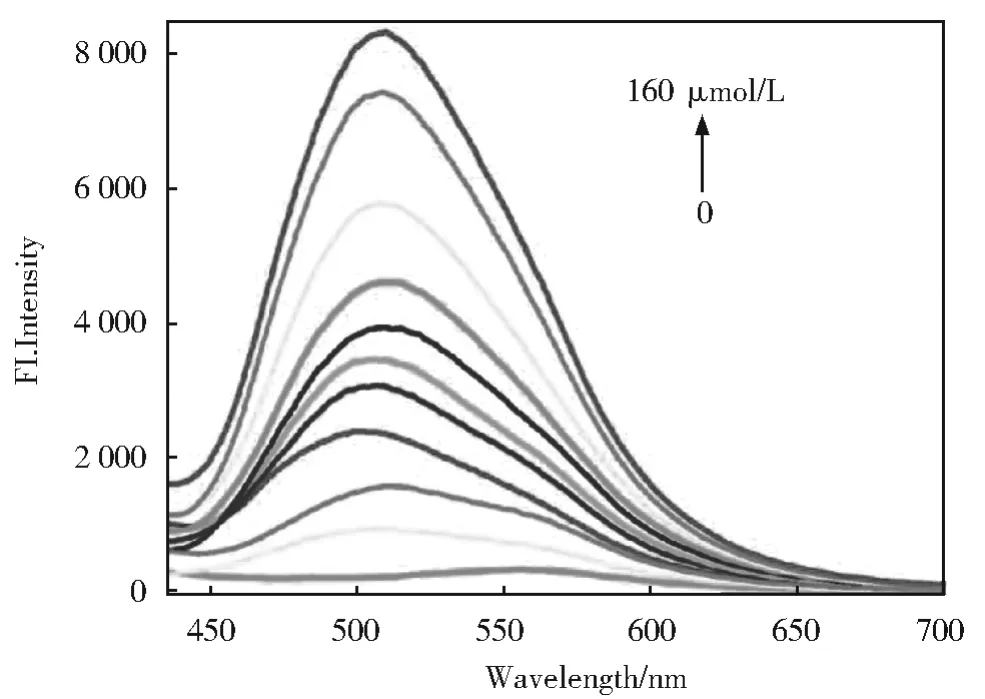
图5 在PBS(pH=7.4,50%DMSO)中,探针YN(10 μmol/L)在不同浓度ClO-下的荧光光谱Fig.5 Fluorescence spectra of probe YN(10 μmol/L)in the presence of various concentrations of ClO-in PBS(pH=7.4,50%DMSO)
2.3 探针YN对ClO-的检出限测试
随后,我们分析了PBS(pH=7.4,50%DMSO)中YN和ClO-之间反应的检出限测试。如图6所示,在ClO-浓度范围为0 μmol/L~30 μmol/L时,荧光发射强度的比值具有良好的线性关系(R2=0.995)。基于IUPAC(CDL=3Sb/m),检测限为0.8 μmol/L。ClO-的低检测限表明YN具有较高的灵敏度。
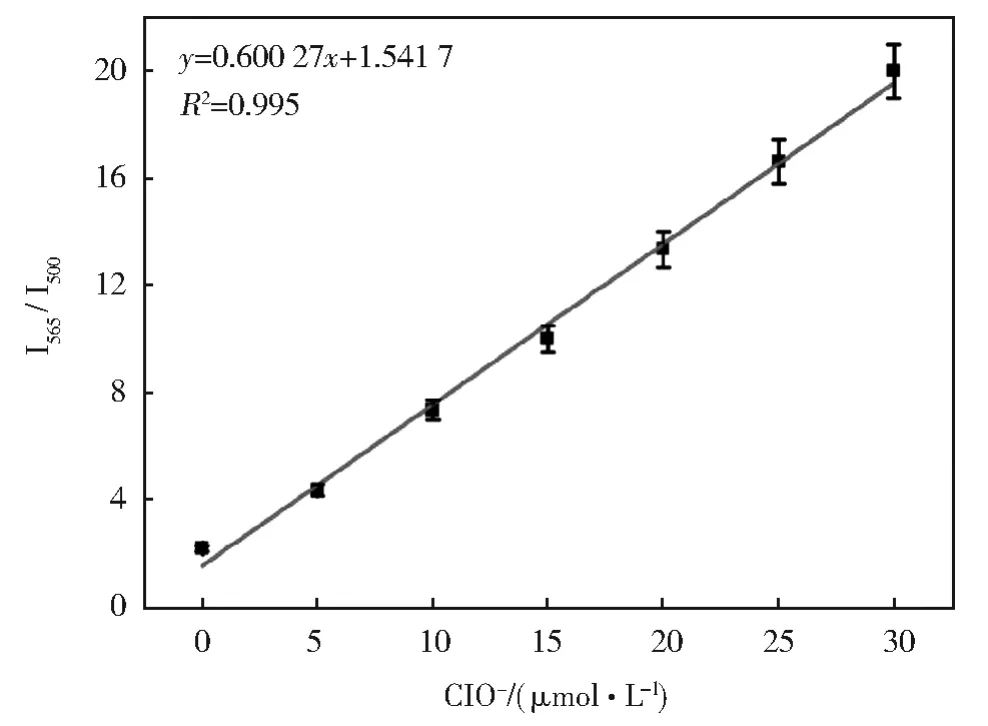
图6 I565/I550处荧光强度的比值随ClO-浓度变化的关系Fig.6 Relationship between the fluorescence intensity at 500 nm and the concentration of ClO-
2.4 探针YN对ClO-的选择性测试
同时,已经在复杂系统中研究了使用YN作为高选择性荧光探针检测ClO-的可能性。如图7所示,YN用于检测其他离子(NO3-;I-;S2-;S2O32-;Br-;Cl-;F-;NO2-;CH3COO-;OH-;.O2;ONOO-;Cys;Glycine;GSH;H2O2;Hcy;LCystine;L-Glutamate;L-Lysine ;L-Proline;SO42-;SNP;TBHP;Na+;Mg2+;Ca2+;K+)时,其荧光强度与探针本身相比几乎没有变化。相反,荧光强度只有与ClO-显示出显著变化,这充分证实了YN对ClO-具有良好的选择性。
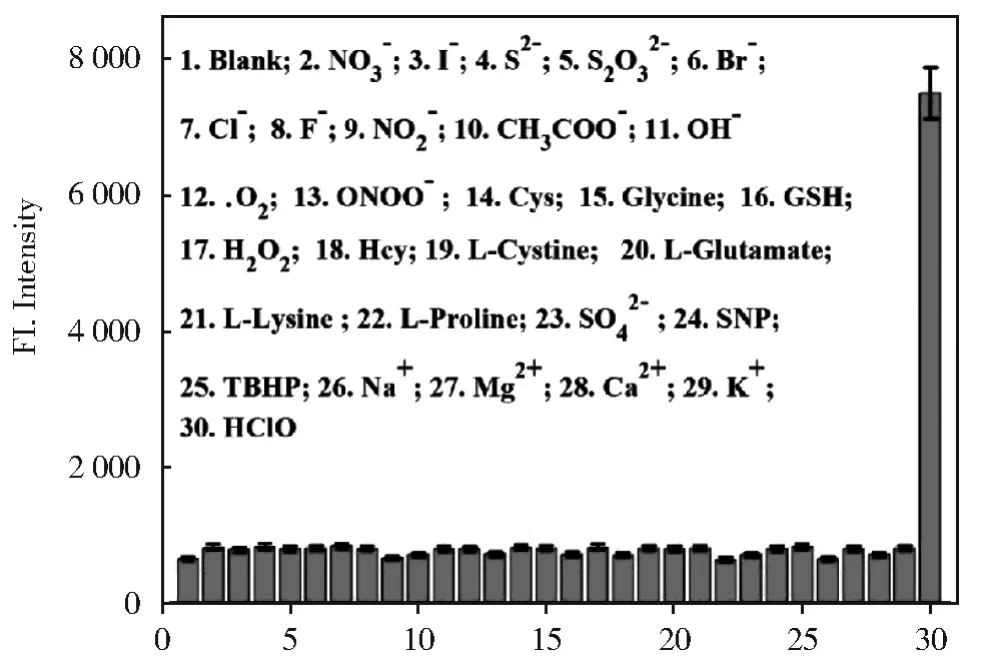
图7 探针YN(10 μmol/L)对ClO-的选择性测试Fig.7 Selective experiment of probe YN(10 μmol/L)on the fluorescence spectrum of ClO-
2.5 探针YN对ClO-的pH测试
为了验证YN是否可以在生理条件下成功检测ClO-,我们记录了在不同pH值下YN的荧光强度变化。如图8所示,在不同的pH值(2~10)下,YN的荧光强度基本没有变化,表明YN具有出色的化学稳定性,但是当加入ClO-时,YN的荧光强度在pH 5~9时发生了显著变化,这很好地涵盖了生理pH范围,因此YN可以在生理环境下进行后续的细胞实验。
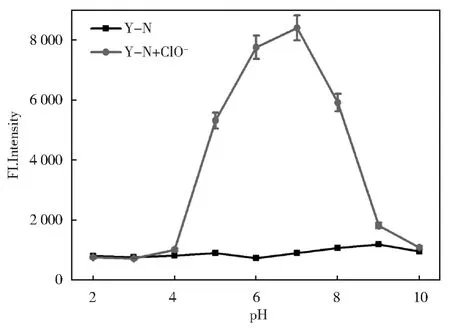
图8 在不存在和存在ClO-的情况下,探针YN(10 μmol/L)在不同pH下的荧光变化Fig.8 Different pH values fluorescent changes of Probe YN(10 μmol/L)in the absence and present of ClO-
2.6 探针YN对ClO-的动力学测试
有趣的是,在图9中可以看出,YN对ClO-具有超快的响应时间(8 s),以满足作为瞬态代谢产物的ClO-的实时检测要求。同时我们与国内外检测ClO-的相关荧光探针做了对比,见表1。可以看出本工作的反应时间明显快于其他文献。
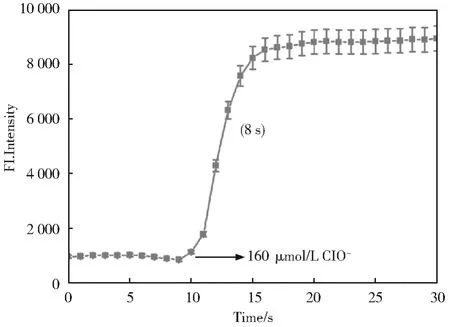
图9 在PBS(pH=7.4,50%DMSO)中,探针YN(10 μmol/L)与ClO-在500 nm处的反应时间曲线Fig.9 Reaction time curve of fluorescence spectra of probe YN(10 μmol/L)upon addition of ClO-
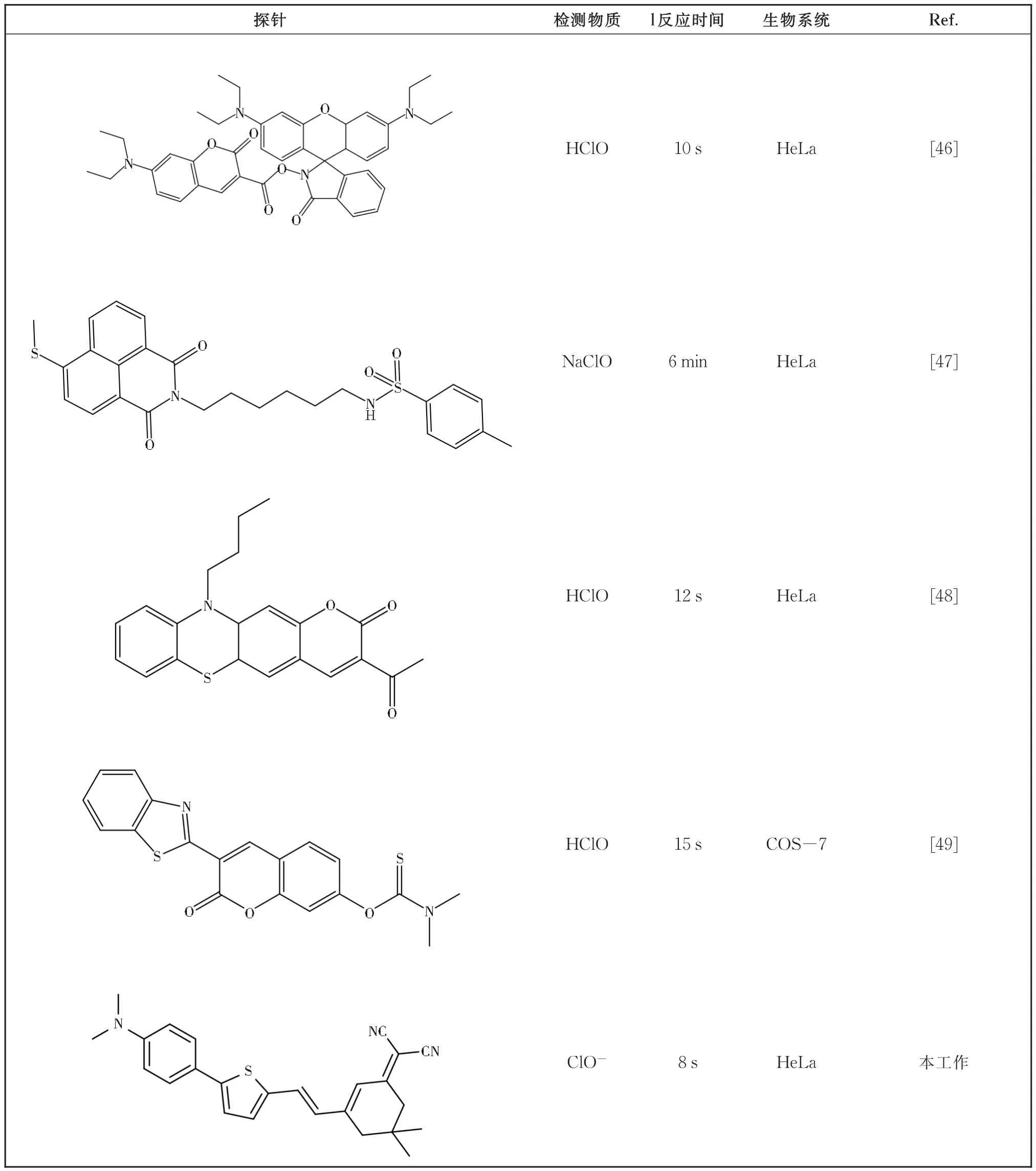
表1 国内外常用的ClO-的荧光探针Table 1 ClO-fluorescent probes commonly used at home and abroad
2.7 探针YN对ClO-的反应机理
我们基于噻吩醛(供体)和DCI(受体)荧光染料合成了探针YN用于检测ClO-。由于存在吸电子CN基团和给电子基团-N(CH3)2,触发了探针YN的ICT-1以显示明显的荧光信号。然而,探针YN的吸电子CN基团受到ClO-的攻击,从-N(CH3)2部分到CN基团的ICT-1过程受到干扰。同时,从-N(CH3)2部分到吸电子酮基引发了ICT-2过程,其荧光光谱与溶液中的ClO-呈比例关系。
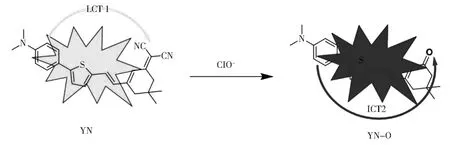
图10 探针YN与ClO-的反应机理Fig.10 Reaction mechanism of YN to ClO-
2.8 探针YN对ClO-的细胞学测试
除此之外,评估了YN对HeLa细胞中外源ClO-成像的能力(图11)。对于仅与YN一起孵育的对照细胞,在黄色通道中捕获了微弱的荧光发射。但是,当HeLa细胞与ClO-一起孵育时,会注意到蓝色荧光逐渐增强。因此,这些细胞实验表明YN可以很好地应用于活细胞中外源ClO-的共聚焦细胞成像。
3 结论
综上所述,我们设计并合成了一种检测ClO-的荧光探针YN,YN是基于二氰基异佛尔酮(DCI)作为受体和噻吩醛作为供体。YN在565 nm处发出黄色荧光,随着ClO-的加入,发射峰会发生蓝移并且在500 nm处产生蓝光发射峰,表现出快速的开启式荧光响应。YN对ClO-检测具有低检测限(0.8 μmol/L)和超短响应时间(8 s)。此外,HeLa细胞成像实验表明,YN可在黄色通道上成像,在蓝色通道上成像外源性ClO-。我们希望以上有机合成策略能够为探针在生理过程中的设计和应用提供更多的帮助。

