Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy及Fib在急性缺血性脑卒中的临床价值
沈惠敏,黄安延,孔令梅,邱杰明,陈瑞乾
(1.汕头大学医学院第二附属医院神经内科,广东 汕头 515041;2.汕头大学精神卫生中心心理咨询中心,广东 汕头 515041;3.汕头大学医学院第二附属医院影像科,广东 汕头 515041;4.汕头大学医学院第二附属医院网络中心,广东 汕头 515041)
脑卒中是目前我国成年人致死或致残的首位原因,伴随着我国老龄化和城市化进程加速,脑卒中疾病负担有爆发式增长的态势。缺血性脑卒中是最常见的脑卒中类型。急性缺血性脑卒中(acute ischemic stroke,AIS)是指因脑动脉狭窄、闭塞,导致脑组织血供障碍,进而发生梗死的一类疾病,临床上又称为“急性脑梗死”[1]。人血浆脂蛋白相关磷脂酶A2(lipoproteinassociated phospholipase A2,Lp-PLA2)水平可作为预测AIS风险的一个生物学标志[2]。动脉粥样硬化(atherosclerosis,AS)导致脑动脉狭窄、闭塞,进而发生脑卒中[3]。血脂异常尤其是低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高在血管AS的发生发展中发挥重要作用[4]。相反,高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)在血管AS发生、发展期间发挥着保护作用,属于血管保护因子[5]。而血清同型半胱氨酸(homocysteine,Hcy)及纤维蛋白原(fibrinogen,Fib)升高,也会导致血管内皮损伤及AS增强[6-7]。缺血性脑卒中发生后,血管因缺血刺激,释放大量炎症因子并加剧脑组织损伤,其中超敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)可促进血管AS的进展,导致脑卒中的发生[8]。本研究探讨 Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy及Fib在AIS患者中的临床价值。
1 资料和方法
1.1 研究对象
选取2019年6月—2021年6月汕头大学医学院第二附属医院住院的AIS患者80例。年龄40~80岁,平均(64.11±12.35)岁,其中男性42例,女性38例。纳入标准:(1)经头颅CT或磁共振成像检查明确诊断为AIS[1],发病至入院时间≤72 h;(2)未接受抗血小板、抗凝、抗栓、调脂治疗;(3)2周内未使用B族维生素及影响Hcy代谢的药物;(4)肝肾功能正常。排除标准:(1)存在出血倾向;(2)严重局部或全身感染;(3)心肺疾病、恶性肿瘤、免疫系统疾病。另选取该院同期80例健康体检者作为对照组,年龄40~80岁,平均(62.43±10.01)岁,其中男性34例,女性46例。本研究经汕头大学医学院第二附属医院伦理委员会审查批准,且获得所有研究对象的知情同意。
1.2 研究方法
1.2.1 样本采集及检测 收集AIS组和对照组研究对象晨起空腹肘静脉血5 mL,其中2 mL静脉血使用枸橼酸钠抗凝管留置,并在室温下以3 000 r/min,离心10 min,离心半径15 cm,取血浆用于Fib检测。其余3 mL静脉血使用5%二胺四乙酸二钠抗凝管留置,以3 000 r/min,离心15 min,离心半径15 cm,分离血清用于Hcy、Lp-PLA2、HDLC、LDL-C、hs-CRP检测。Fib检测使用凝固法(试剂盒购自上海太阳生物技术有限公司);Hcy的检测使用循环酶法(试剂盒购自宁波美康生物技术股份有限公司),LDL-C、HDL-C的检测使用酶法(试剂盒购自美国贝克曼库尔特有限公司),Lp-PLA2检测使用胶乳增强免疫比浊法(试剂盒购自天津康尔克生物科技有限公司)、hs-CRP检测使用胶乳增强免疫比浊法(试剂盒购自宁波美康生物技术股份有限公司)。
1.2.2 观察指标及判断标准 对比AIS组和对照组研究对象血清Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy及Fib水平。根据AIS患者的梗死面积及神经功能缺损程度,将患者分为小面积、中面积、大面积梗死3组(分别为34、26、20例)和轻度、中度、重度神经功能缺损3组(分别为34、35、11例)。对比不同梗死面积、不同神经功能缺损程度患者上述观察指标的差异。梗死面积判断标准[9]:小面积梗死是指大脑中动脉供血区域<1/3梗死;中面积梗死是指1/3≤大脑中动脉供血区域<2/3梗死;大面积梗死是指大脑中动脉供血区域≥2/3梗死,伴或不伴有大脑前(后)动脉供血区域梗死。神经功能缺损程度判断标准[10]:美国国家卫生研究院卒中量表评分1~4分即轻度缺损,5~15分即中度缺损,>15分即重度缺损。
1.3 统计学分析
采用GraphPad Prism 9.0进行数据分析及可视化,计量资料以±s表示,计数资料以例数和百分率表示。分别使用Shapiro-Wilk法与Levene检验分析数据的正态性与方差齐性。两组间比较,若数据符合正态性及方差齐性,则采用t检验;若方差不齐则采用校正t检验。多组间比较,若数据符合正态性,则采用方差分析;若数据不符合正态性则采用Kruskal-WallisH检验。多组间的两两比较采用Tukey法。以P<0.05为差异有统计学意义。采用受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)及曲线下面积(area under the curve,AUC)来评估 Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy及Fib水平对AIS的临床价值。
2 结果
2.1 AIS组和对照组的基线特征
AIS组的白细胞计数大于对照组(P<0.01),而在性别、年龄、随机血糖及血小板计数上,两组间差异均无统计学意义(均P>0.05),具有可比性。见表1。

表1 AIS组和对照组的基线特征比较
2.2 AIS组和对照组的各项指标
AIS组患者血清Lp-PLA2、LDL-C、hs-CRP、Hcy及Fib水平均高于对照组(均P<0.01),血清HDL-C水平低于对照组(P<0.01),见图1。
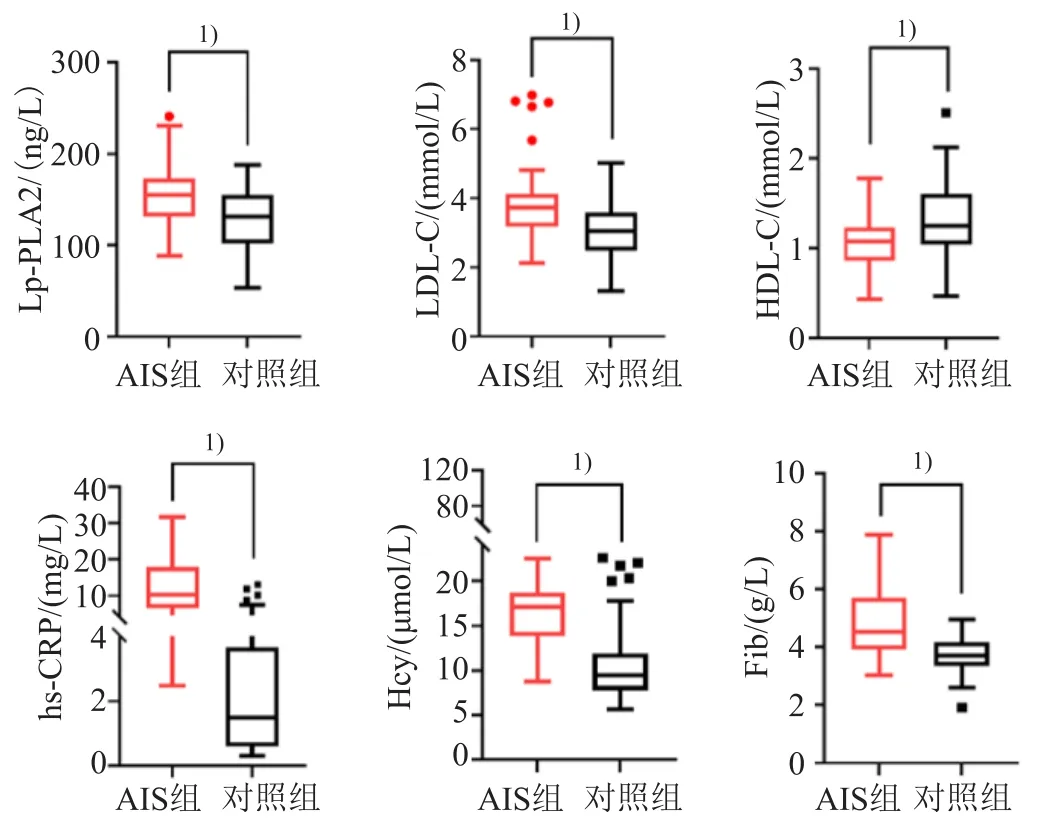
图1 两组研究对象各项指标的比较
2.3 不同梗死面积的AIS患者各项指标
患者血清Lp-PLA2、LDL-C、hs-CRP、Hcy及Fib水平均随着梗死面积增大逐渐升高,尤其是小面积和大面积梗死组相比(均P<0.01)。血清HDL-C水平随着梗死面积增大逐渐降低,尤其是小面积和大面积梗死组相比(P<0.01),见图2。

图2 不同梗死面积AIS患者的各项指标的比较
2.4 不同神经功能缺损程度的AIS患者各项指标
随着患者神经功能缺损程度的加重,Lp-PLA2、LDL-C、hs-CRP、Hcy及Fib水平逐渐升高,尤其是轻度和重度神经功能缺损组相比(均P<0.05)。相反,血清HDL-C水平逐渐下降,尤其是轻度和重度神经功能缺损组相比(P<0.01),见图3。

图3 不同神经功能缺损程度AIS患者的各项指标的比较
2.5 6项指标联合检测的效能分析
ROC曲线分析表明,6项指标联合检测的AUC为0.950,灵敏度为90.00%,特异度为83.75%,见表2。

表2 各项指标对AIS检测的效能
3 讨论
迄今为止,AIS是严重危害人类健康的难治性疾病,AS是AIS的病理基础,且与炎症反应密切相关[11]。炎症反应、变性、渗出和血栓形成是AS的主要发病机制。Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy和Fib在AS中扮演重要的角色,而且与AIS的发生、发展密切相关。所以探讨AIS患者血清的Lp-PLA2、LDL-C、HDL-C、hs-CRP、Hcy和Fib水平,并予以积极干预,对预防和评估AIS有重要的临床价值。
Lp-PLA2是水解磷脂酶家族的成员,是一种血管特异性的炎症因子。在血液循环中,80%的Lp-PLA2与LDL-C结合。Lp-PLA2又称为血小板活化因子乙酰水解酶,主要由巨噬细胞和中性粒细胞从AS斑块中释放,在AS过程中发挥重要作用,参与斑块的形成,而且Lp-PLA2能发挥酶活性,水解低密度脂蛋白中的氧化磷脂,形成脂质促炎物质(如氧化的游离脂肪酸和溶血卵磷脂),产生多种致AS效应因子。Lp-PLA2被认为是一种新的血管特异性炎症因子,可作为心脑血管事件的独立危险因素[12]。在人体血液循环中的Lp-PLA2能够反映血管AS的动态变化进程。Oei等[2]在对鹿特丹1 820例受试者进行队列研究后,第一次指出Lp-PLA2是缺血性卒中疾病新的独立预测指标。本研究结果显示与对照组相比,AIS组血浆Lp-PLA2水平明显升高(P<0.01),说明在AIS患者中血浆Lp-PLA2呈异常高表达,这与彭华等[13]的研究一致,而且本研究患者Lp-PLA2随着梗死面积增大和神经功能缺损程度加重逐渐升高,说明Lp-PLA2能对AIS的预后诊断提供帮助,可作为一个预测指标。
LDL-C升高可损伤血管内皮细胞和平滑肌细胞,启动血管壁的炎性反应,LDL-C被巨噬细胞识别、吞噬并形成泡沫细胞,而泡沫细胞的聚集是AS斑块形成和生长的关键,从而导致AS的发生[4,14]。本研究结果显示,与对照组相比,AIS组血浆LDL-C水平明显升高(P<0.01),说明在AIS患者中血浆LDL-C呈异常高表达,而且升高的LDLC可与Lp-PLA2结合,可加快AS的进程。HDL-C是血液循环中唯一具有抗AS作用的脂蛋白[15]。HDL-C可控制单核细胞的激活和单核细胞前体细胞的增殖,并抑制巨噬细胞的迁徙和LDL-C的氧化,减少氧化型LDL-C的产生,避免内皮细胞受到氧化应激和炎症的影响,发挥抗血管AS的作用[5]。本研究结果显示与对照组相比,AIS组血浆HDL-C水平降低(P<0.01),说明在AIS患者中血浆HDL-C呈异常低表达,并且梗死面积越大,神经功能缺损越严重,血清中HDL-C水平越低。
炎症是AS发展的驱动因素,CRP是重要的炎症标志物之一,由于CRP的敏感性较低,较高敏感性的hs-CRP已替代CRP作为预测血管事件发生的生物标志物[16]。发生AIS与hs-CRP的升高紧密相关,当hs-CRP表达水平上升时,可促进不稳定斑块破裂,导致血管AS进展,激活了补体系统,抑制纤溶系统,促进血栓形成,导致脑卒中的发生和发展[7-8]。本研究基线数据中AIS组白细胞计数大于对照组(P<0.01),但两组数值的均值在成人正常范围(4×109/L~10×109/L)。AIS患者急性期,白细胞计数有应激性升高[17],但它不如hs-CRP敏感[18],所以本研究没有进一步分析。本研究结果显示AIS组血浆hs-CRP水平明显高于对照组(P<0.01),说明hs-CRP在AIS患者中呈异常高表达,与张媛媛等[7]报道一致。
AIS患者血清中Hcy水平显著升高,Hcy≥15.250 μmol/L可作为AIS诊断的有效参考[19]。Hcy会氧化修饰LDL-C,并导致动脉平滑肌细胞内的细胞周期蛋白mRNA以及癌基因fos表达升高,导致细胞由静止期进入到分裂期,从而增加泡沫细胞的生成,促进AS的发生与发展[20]。Hcy是缺血性脑病的独立危险因素,可加速血管平滑肌细胞的增殖,导致血管壁增厚,降低血管弹性,此外它还通过氧化应激导致血管内皮细胞损伤,从而导致脑血栓形成、硬化和脑梗死[21]。本研究结果显示AIS组血浆Hcy水平明显高于对照组(P<0.01),且与LDL-C一致,随着梗死面积增大、神经功能损伤程度加重升高。
肝细胞分泌合成的Fib是分布于血液中的一种羰基化蛋白质,在AIS时,Fib可导致血小板迅速凝集,血液黏度升高,使患者血液栓塞,加速AS等病理变化,加剧AIS的进展[22]。Fib水平检测结果被广泛应用在心脑血管疾病的诊断和预后分析中,Fib表达水平的变化在AIS的发生、转归及治疗效果中扮演着重要的角色[23]。本研究结果显示与对照组相比,AIS组血浆Fib水平明显升高(P<0.01),且随病情进展Fib水平升高,提示Fib可为AIS发生、转归及治疗效果评估提供一定的参考。
ROC曲线分析发现单独分析Lp-PLA2、LDLC、HDL-C、hs-CRP、Hcy和Fib水平对判断AIS预后的价值有限,因为有多种因素可以干扰评估的灵敏度和特异度。而联合6项指标检测分析的AUC可达到0.950,可以从血管内皮细胞损伤、脂质代谢异常、血管壁的炎性反应、血液黏稠度增高等多个维度分析患者的病理生理情况,能够为AIS的预后判断和疾病进展提供参考。
综上所述,AIS患者血清Lp-PLA2、LDL-C、hs-CRP、Hcy和Fib水平均显著升高,血清HDLC水平明显下降,且与患者梗死面积的扩大、神经功能损伤的加重具有相关性,可作为AIS病情评估的辅助指标。

