UV-B对雨生红球藻生长及虾青素积累的影响
许文鑫 朱 琴 朱 梅 季春丽 张春辉 秦 松 李润植 崔红利
(1. 山西农业大学农学院, 太谷 030801; 2. 山西农业大学分子农业与生物能源研究所, 太谷 030801;3. 中国科学院烟台海岸带研究所, 烟台 264003)
光不仅为植物提供了驱动光合作用的能量, 还作为环境信号因子调控植物从种子萌发到开花结果整个生命周期。近年来, 由于臭氧层的破坏, 使得到达地面的紫外线辐射增强。紫外线辐射已成为影响植物的生长和发育的一个重要环境因子[1]。
为了适应动态变化的光环境, 植物进化出一套精密的光感受传导系统, 通过光受体来感知不同波段的太阳光, 通过信号传导网络调控植物体内相关基因表达和蛋白修饰及相互作用, 进而指导植物在生理生化和生长发育等方面的响应。例如, 短波段、高强度和损伤性UV-B会诱发植物的应激反应,造成DNA损伤和活性氧的生成, 加速植物衰老或造成植株死亡[2]; 低强度和非损伤性的UV-B则对植物的多种发育过程有正向调控作用, 如光形态的建成、下胚轴缩短、子叶膨大、黄酮醇和花青素积累等[3—5]。
雨生红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻, 是目前已知虾青素含量最高的物种,大多数研究者认为光照(光强、光质及光周期)是影响雨生红球藻虾青素合成的重要因子[6]。近年高等植物拟南芥(Arabidopsis thaliana)UV-B信号转导机制的研究有很大进展[7,8], 对于微藻UV-B信号转导机制的研究相对较少。UV-B辐射亦影响着水生生态系统, 研究发现适量的紫外线辐射可促进雨生红球藻积累虾青素[9], 然而, 雨生红球藻细胞如何感知和转导光信号进而调控虾青素积累的机制尚不清楚。
UVR8(UV-Resistance locus 8)最早是从拟南芥中分离鉴定出的UV-B特异性光受体。UVR8的光激活依赖于特定位置的固有色氨酸残基吸收UVB光, 在没有UV-B的情况下, 七叶片的β-螺旋桨蛋白UVR8以同源二聚体的形式存在; 当UV-B存在时, 促进同源二聚体的解离使UVR8单体化, 与COP1蛋白的WD40重复域相互作用, 聚集在细胞核中, 进而诱导光形态反应和UV-B适应[10,11]。UVR8可控制与UV-B吸收代谢物的生物合成、DNA修复和氧化应激保护相关的一些基因的表达[12]。除光感受器外, 许多其他成分也在光响应中起着重要作用, 包括COP1(Constitutively Photomorphogenic 1)、SPA1(suppressor of PHYA-105 1)、HY5(Elongated Hypocotyl 5)、HYH(HY5-Homolog)、RUP1/2(Repressorof UV-B Photomorphogenesis 1/2)和PIFs(Phytochrome-interacting Factor 1)等[13—15]。已有研究从雨生红球藻中克隆得到紫外光受体UVR8基因的cDNA序列全长, 并对其理化性质和蛋白结构等进行了分析[16]。本文在前人研究的基础上, 聚焦UV-B辐射对雨生红球藻UVR8基因和虾青素合成关键基因的表达以及UV-B辐射对光信号通路的影响。重点检测高等植物UV-B信号转导通路的核心元件即UVR8、COP1、SPA1、HYH和HY5等基因[17—20]在紫外下的表达谱, 以期为深入解析光诱导虾青素合成的转录调控机制和绿藻UV-B信号响应机制奠定基础。
1 材料与方法
1.1 藻种
雨生红球藻(Haematococcus pluvialis)FACHB-712, 购自中国科学院水生生物研究所淡水藻种库,由本实验室保存。采用MCM培养基进行培养, 培养条件为光强25 μmol/(m2·s)(LED白光), 温度25℃,光暗周期(L∶D)12∶12, 静置培养, 每天手摇2—3次。
1.2 UV-B辐射体系
人工UV-B光源由功率15 W的PhilipsTL20W/01RS窄带UV-B管提供(波长为311 nm), 通过移动锥形瓶与紫外灯的距离调节强度, 光强使用TES 1332A勒克斯计测量, 在试验前连续照射24h使系统稳定。
将正常光照培养且处于对数生长后期的藻细胞, 离心收集重新悬浮于新鲜MCM培养基中, 经黑暗处理24h后, 设置于光照强度为25 μmol/(m2·s)的培养条件下(同时补充不同辐射强度的UV-B)。分别标记: 正常组(CK)、100 lx强度的UV-B辐射(U100)、200 lx强度的UV-B辐射(U200)、300 lx强度的UV-B辐射(U300)、400 lx强度的UV-B辐射(U400)和500 lx强度的UV-B辐射(U500), 每组设置3个平行, 培养温度25℃, 每天摇动2—3次。每隔24h定时取样用于各项生理指标的测定。
1.3 生理指标测定方法
生长曲线测定从每种培养物中吸取1 mL样品, 并用微量移液管将其转移到血球计数板中,在光学显微镜下对细胞进行计数, 该显微镜连接到装有Optilab软件的计算机上。
光合作用活性测定使用脉冲调制叶绿素荧光仪Mini-PAM-Ⅱ/B(H. Walz. Effeltrich, Germany), 于室温下测定叶绿素荧光猝灭过程, 每组取3 mL藻液, 测定前藻样先暗适应10min。PSⅡ最大光化学效率(Fv/Fm)使用公式Fv/Fm=(FmFo)/Fm计算,NPQ(Non-photochemical quenching parameter)是非光化学猝灭系数, rETR(Relative electron transport rate)是相对电子传递速率。
叶绿素a、叶绿素b含量测定参照李合生[21]的方法, 采用95%乙醇提取, 离心, 使用紫外分光光度计(Metash UV-6000PC)测定上清液吸收光谱, 利用公式Chl.a(mg/L)=(12.7×A663-2.69×A645)Va/Vb,Chl.b(mg/L)=(22.9×A645-4.86×A663)Va/Vb计算叶绿素a和叶绿素b的含量(Va和Vb分别代表95%乙醇和微藻样品的体积)。
虾青素含量测定采用改良的Boussiba的虾青素测定方法[22], 使用5%KOH+30%甲醇皂化叶绿素后用二甲基亚砜提取虾青素, 于490 nm处测定光吸收, 用公式C(mg/L)=(4.5×A490×Va)/Vb计算虾青素含量[23](Va和Vb分别代表二甲基亚砜和微藻样品的体积)。
1.4 实时荧光定量PCR
采用qRT-PCR探究UV-B辐射对雨生红球藻编码紫外光受体的UVR8基因、虾青素合成相关的基因(IPI、BCH、PSY和BKT)及光信号转导通路相关基因(COP1、SPA1、HYH和HY5)转录水平的影响。根据说明书, 使用Trizol试剂提取不同样品的总RNA, 并用赛默飞世尔科技公司的分光光度计NanoDrop2000测定浓度及纯度。按照所购试剂盒(PrimeScript™ RT reagent Kit with gDNA Eraser)步骤反转录成cDNA, 进行qRT-PCR, 扩增产物100—250 bp。所用引物详见表 1, 实时荧光定量反应体系参照SYBR®Premix ExTaq™ II (TaKaRa)说明书进行, 每个样品重复3次。

表1 实验所用引物名称及序列Tab. 1 Primers used in this study
1.5 统计分析
对照组和处理组均设置3个平行样, 采用SPSS 16.0软件对数据进行统计分析, 绘图采用Origin9软件(OriginLab Corporation, 美国)。
2 结果
2.1 UV-B辐射对雨生红球藻生长的影响
如图 1a所示, 雨生红球藻在UV-B辐射下藻液颜色发生明显变化, 高UV-B强度(U300和U400)处理组藻液颜色与CK组相比呈红棕色, 且随着光照时间的增长, 藻液颜色越深, 但当UV-B强度增加到500 lx时藻液颜色变浅。进一步观察藻细胞形态,发现在UV-B辐射条件下, 雨生红球藻细胞多为绿色静止细胞, 随着培养时间的延长细胞逐渐变成红色的孢子。如图 1b所示, 36h时藻细胞微红, 随着时间的增加, 细胞变红的面积逐渐增大, 72h时U400组的藻细胞呈全红状态。
雨生红球藻经UV-B辐射后, 高强度组细胞生长呈现先升高后下降的趋势, 如图 1c所示, 前24h的UV-B辐射促进了藻的生长, 之后随着UV-B辐射的增强, 藻细胞生长受抑制, 48h后生物量急剧下降,72h后高UV-B辐射强度下(U400和U500)大多数细胞裂解死亡。

图1 UV-B辐射对雨生红球藻形态和生长的影响Fig. 1 Effects of UV-B radiation on morphology and growth of H. pluvialis
2.2 UV-B辐射对雨生红球藻光合作用的影响
在UV-B辐射下, 雨生红球藻Fv/Fm随辐射时长增加而下降, 且下降幅度与UV-B强度成正比(图 2a),低强度组(U100和U200)与CK组相比, 尽管略微下降, 但Fv/Fm维持在0.6—0.8; 中高强度组(U300、U400和U500)在24h时, 其Fv/Fm<0.6表明藻细胞短时内就受到光抑制, 且随着辐射时长的增加,Fv/Fm<0.3, 表明受到严重光抑制。高强度处理组(U400和U500)96h后在仪器测量范围内已经检测不到藻的光合活性(Fv/Fm<0.2), 可能是过量UV-B辐射导致大量细胞裂解死亡。
NPQ是非光化学淬灭系数, 如图 2b所示, 在对照及低UV-B辐射强度下, NPQ呈上升趋势, 24h之后由于长时间UV-B辐射的破坏, NPQ也随之下降;而对于高强度组, 如U400和U500组的NPQ尽管也上下波动, 但是远低于对照水平。
在UV-B照射下, 不同辐射时长的雨生红球藻的相对电子传递速率(rETR)均在0—1000 μmol/(m2·s)下随光合有效辐射(PAR)的增大而升高, 在低强度(100 和200 lx)、短时间(24h和48h)UV-B辐射条件下, 藻细胞的rETR与未处理CK组的变化趋势相吻合, 略高于CK组的rETR值, 显著高于高强度处理组(U300、U400和U500)的rETR(图 2c和2d)。但是, 持续长时间(72h)、低强度辐射导致藻细胞rETR下降, 且数值低于CK组(图 2e)。在高强度(300、400和500 lx)UV-B辐射下, 无论时间长短, 均对藻细胞造成了不同程度的损伤, 其rETR值显著低于CK组。且随着辐射强度的增加其最大相对电子传递速率(rETRm)显著降低, 且初始斜率也降低。

图2 UV-B辐射对雨生红球藻叶绿素荧光参数的影响Fig. 2 Effect of UV-B radiation on chlorophyll fluorescence parameters of H. pluvialis
2.3 UV-B辐射对雨生红球藻色素积累的影响
UV-B辐射对雨生红球藻细胞内的叶绿素和虾青素含量的影响都很大, 且影响效果与UV-B辐射强度和处理时间有关。如图 3a和3b所示, UV-B处理组的叶绿素a和叶绿素b含量都明显低于对照组,且降低幅度与UV-B强度正相关。U100组与对照相比, 叶绿素a降低幅度较小, 处理24h后, U400组的色素含量降低了23.34%, 84h时U400组降低了48.75%,远大于U100组的15.8%, 细胞中的叶绿素的含量呈对照组>低强度组(U100和U200)>中强度组(U300)>高强度组(U400和U500)的关系。

图3 UV-B对雨生红球藻叶绿素含量和虾青素含量的影响Fig. 3 Effect of UV-B on chlorophyll content and astaxanthin content of H. pluvialis
与叶绿素积累相反, 随着虾青素逐渐覆盖整个细胞, 虾青素积累经UV-B辐射后呈现U400>U300>U200>U100>CK组的关系, U500组由于72h后细胞受损严重导致虾青素含量显著降低。24h时U300组的虾青素含量较对照组增加22.58%, 36h时U400组的虾青素含量较对照组升高35.68%, 而到72h显著升高, 较CK组提高了56.23%, 分别达到5.82和7.06 mg/L。72h辐射后, 随着生物量的减少, 所有处理组的虾青素含量均下降。
2.4 UV-B辐射下雨生红球藻虾青素合成相关基因的表达分析
为深入探究UV-B辐射对雨生红球藻虾青素积累的机制, 选取了虾青素合成通路第一步的关键酶基因IPI(异戊烯焦磷酸异构酶)、虾青素合成限速酶PSY(八氢番茄红素合成酶)和BCH(β-胡萝卜羟化酶)和BKT(β-胡萝卜酮化酶)等基因进行qRT-PCR定量分析。结果发现类胡萝卜素前体物质合成的关键酶基因IPI在对照组几乎不表达, 在UV-B辐射下显著高表达(P<0.05), 第1天IPI基因的表达量最高,之后随UV-B辐射时长的增加, 表达量呈下降趋势(图 4)。

图4 UV-B对雨生红球藻4个虾青素素合成相关基因表达的影响Fig. 4 The effects of UV-B on the transcript levels expression kinetics of four astaxanthin genes in H. pluvialis during incubation
PSY基因在UV-B辐射下, 随着时间增长呈现上升趋势, 与IPI基因表达趋势相反, 前2天其表达量较低, 第3天显著上升(P<0.05), 与对照相比, UVB为400 lx的表达量提高近90倍。BCH基因的表达量在正常培养条件下及UV-B辐射下均呈现先降低后升高的趋势, 与CK组相比, 补充UV-B后其表达量显著升高(P<0.05), 第3天其表达量达到最高, 在UV-B为400 lx的表达量较CK组提高近310倍。BKT基因在CK组随着时间的增长略微升高, 经UVB辐射后,BKT基因的表达量显著高于CK组(P<0.05), 随着辐射时间的增加无显著差异(P>0.05), 一直维持在较高的水平上。IPI、PSY、BCH和BKT等基因在不同的辐射强度和辐射时间诱导下其表达量存在差异。总之, 相较于CK组,UV-B辐射可显著提高雨生红球藻虾青素合成相关基因转录水平的表达。
2.5 UV-B辐射下雨生红球藻编码紫外光受体基因UVR8的表达分析
为探究UV-B辐射对雨生红球藻紫外光受体UVR8基因表达模式的影响, 收集了不同时间点的藻样进行分析。如图 5所示,UVR8基因对UV-B十分敏感, 随着UV-B辐射时间增长, 其表达量呈现先升高后下降的趋势; 与对照组相比, UV-B辐射下的UVR8基因的表达量均显著升高(P<0.05), 且辐射强度越大其表达量越高。第1天高强度组(U400)UVR8基因的表达量约为CK组的2000倍, 第2天实验组表达量显著下降, 但在第3天又恢复到较高水平。
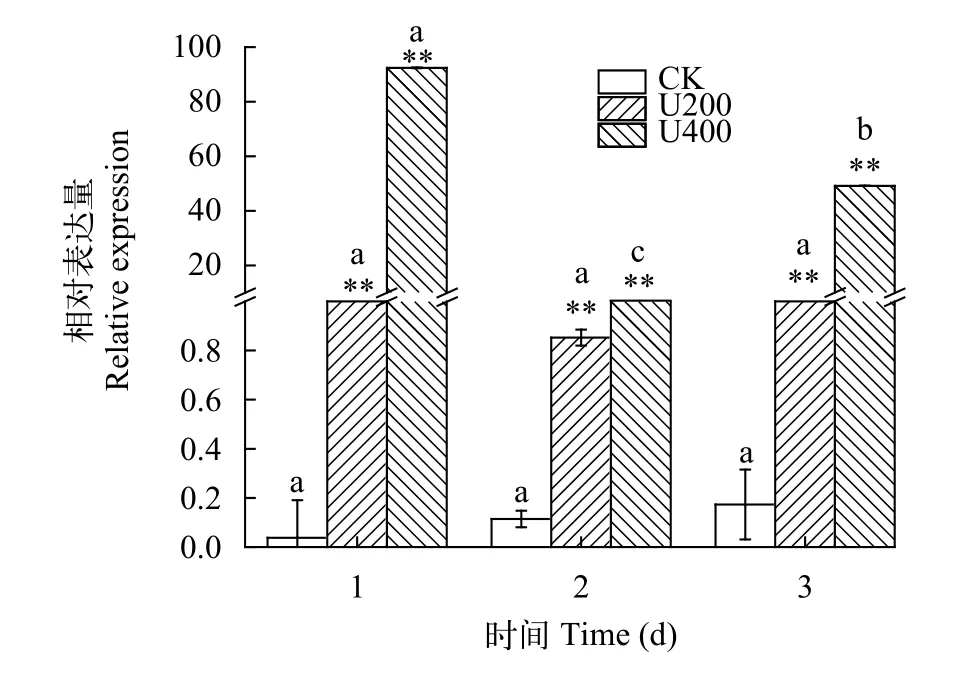
图5 UV-B下雨生红球藻紫外光受体UVR8基因的表达情况Fig. 5 The relative expression of UVR8 of H. pluvialis under UVB radiation
2.6 UV-B辐射下雨生红球藻光信号通路关键基因的表达分析
采用qRT-PCR对经UV-B辐射2d后的藻样进行了分析(图 6), 与对照相比, UV-B辐射后COP1、SPA1、HY5和HYH等基因均能响应UV-B辐射, 在转录水平上其表达量有变化。SPA1的表达量随着UV-B辐射强度的增加略微升高,HY5和HYH等基因的表达量随着UV-B辐射强度增加显著上升, 其中HY5在高强度(U400)下较低强度(U200)提高近0.5倍,HYH提高近3.4倍。尽管COP1在UV-B辐射下其表达量增加, 但随UV-B辐射强度的增加, 其表达量略微降低。
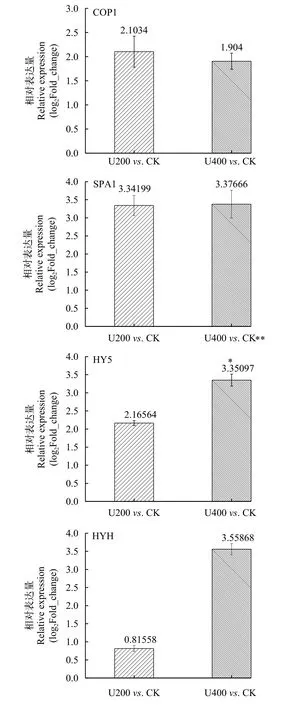
图6 UV-B辐射下雨生红球藻光信号通路关键基因的表达Fig. 6 The expression of key genes in light signaling pathway of H. pluvialis under UV-B radiation
3 讨论
3.1 UV-B辐射损伤雨生红球藻光合系统、抑制其生长, 促进虾青素的积累
雨生红球藻是目前公认的天然虾青素的理想来源, 在高光、缺氮等胁迫条件下会积累大量的虾青素[15]。前人研究表明适量强度的UV-B照射也能有效诱导其大量积累虾青素[6,9]。但藻细胞如何感知并转导UV-B光信号进而调控虾青素积累的机制尚不清楚。因此本文首先研究了UV-B辐射下雨生红球藻生长、光合系统及虾青素积累的变化。
经UV-B辐射后, 雨生红球藻表现为生长受抑制同时细胞形态也发生变化, 细胞壁逐渐增厚变硬、轮廓变得明显, 先形成成熟的静止细胞, 最后变成积累虾青素的红色孢子。这与高光及缺氮等胁迫条件下的细胞形态变化一致[25—27], 暗示藻细胞受到UV-B胁迫并作出响应(图 1)。
UV-B辐射也损伤雨生红球藻的光合系统, 随着UV-B辐射强度的增加,Fv/Fm呈下降趋势, 该结果与前人对斜生栅藻(Scenedesmus obliqnusFACHB 1986)和铜绿微囊藻(Microcystis aeruginosa)的研究结果相类似[28]。暗示UV-B可能直接影响藻细胞光合系统, 进而影响光能吸收和能量转化过程。NPQ反映PSⅡ吸收的过量光能不能用于光合电子传递而以热的形式耗散掉的部分, 可以表示为光合系统的保护效率[29]。UV-B辐射下雨生红球藻的NPQ均低于CK组, 这与高光下结果相一致[30], 暗示过量的光能超过藻细胞自身的承受能力, 不能以热的形式耗散掉。高强度(300、400和500 lx)UV-B辐射下,无论时间长短, 均引起藻细胞光合作用降低, 其rETR值显著低于CK组, 推测在这种条件下, 更多的光能可能主要用于虾青素的合成。
进一步测定UV-B辐射下雨生红球藻虾青素积累的变化, 发现其对藻细胞积累虾青素的影响不但与辐射强度也与辐射时间相关: 低强度(100和200 lx)、短时间的辐射可以提高雨生红球藻单位体积生物量中的虾青素含量, 而较高强度(300、400和500 lx)的UV-B辐射尽管可诱导虾青素积累使其短时间内显著升高, 但长时间辐射对细胞伤害程度超过了自身的防御能力, 最终导致细胞裂解死亡和虾青素含量迅速降低(图 3)。总而言之, 研究表明UV-B辐射能显著诱导雨生红球藻中虾青素的积累, 但具体调控机制不清楚。
3.2 UV-B辐射诱导雨生红球藻虾青素合成主要发生在转录水平上
大量文献表明, 光诱导雨生红球藻虾青素积累的同时, 虾青素合成相关基因在转录水平上呈现不同程度的高表达[6,9,15], 暗示调控机制部分发生在转录水平上。因此为了探究虾青素合成基因的调控与虾青素积累之间的关系, 通过qRT-PCR对不同辐射强度(200和400 lx)、不同辐射时长(24h、48h和72h)下的虾青素生物合成相关基因的表达进行了探究, 结果表明不同辐射强度下的IPI、PSY、BCH和BKT等关键基因的转录表达差异显著(图 4), 这与文献报道的经ACC(1-Aminocyclopropane-1-Aarboxylic Acid)处理[31]、高蓝光和高白光[24]处理后雨生红球藻虾青素合成关键基因高表达的趋势一致。综上所述, UV-B是虾青素生物合成网络中的一种诱导因素, 且虾青素合成相关基因(IPI、PSY、BCH和BKT)的表达量与UV-B辐射的强度和时长均相关。
3.3 UV-B介导的信号转导通路可能在UV-B诱导雨生红球藻虾青素积累中发挥重要作用
尽管UV-B辐射诱导雨生红球藻中虾青素的积累主要发生在转录水平上, 但藻细胞如何感知和转导UV-B信号, 如何激活虾青素合成相关基因在转录水平的高表达, 这些还不清楚。
植物依靠光受体, 例如紫外光受体UVR8(UV resistance locus 8)通过构象改变和磷酸化等感知光信号, 并通过多种互作蛋白形成复杂的接收和转导系统, 并与体内其他信号转导途径耦合, 进而调控基因的表达, 最终调控光响应生理过程[10—15]。拟南芥紫外光受体UVR8单体化, 与COP1和SPA1等蛋白结合, 通过多种机制共存的方式激活转录因子HY5, HY5处于光信号转导网络的枢纽位置, 可诱导包括其同源蛋白HYH在内的一系列光形态建成相关基因的表达, 进而响应UV-B信号[32], 如抑制拟南芥下胚轴的伸长, 促进色素积累和提高抵御胁迫的能力等[17,33]。同时UVR8-COP1途径在进化上是保守的, 它可介导莱茵衣藻(Chlamydomonas reinhardtii)的UV-B响应, 并且能够通过启动非光化学淬灭机制进而保护莱茵衣藻藻细胞光合系统[34]。
目前在雨生红球藻中有许多UV-B反应的报道,前期, 我们实验室从雨生红球藻中获得编码紫外光受体UVR8的基因序列[16], 但是雨生红球藻中的UV-B反应是否依赖于UVR8光感受器尚不清楚。近年拟南芥, 莱茵衣藻UV-B信号转导机制的研究进展为解析雨生红球藻UV-B通路提供视角, 我们从基因转录水平对UV-B信号转导通路相关基因(UVR8、COP1、SPA1、HY5和HYH)进行探究, qRTPCR结果表明, 经UV-B辐射后, 不但紫外光受体UVR8在高强度UV-B下显著上调, UV-B信号转导通路相关基因(COP1、SPA1、HY5和HYH)在转录水平也发挥调控作用, 这与高白光和高蓝光下COP1、SPA1、HY5和HYH等紫外光受体相关基因表达差异结果相一致[24], 同时虾青素也在UV-B条件下大量积累, 暗示上述UV-B信号转导通路相关基因在雨生红球藻虾青素积累上发挥重要作用。
结合本研究及前人研究结果[21,24,31], 我们推测雨生红球藻同样存在“光信号→光受体→互作蛋白(互作蛋白→转录因子/转录调节子) →功能基因表达→虾青素积累”机制来响应UV-B信号及激活相关通路。如图 7所示, 本研究已验证在UV-B辐射条件下,UVR8、COP1、SPA1、HY5和HYH等基因上调表达, 与光信号通路基因高表达同步的是虾青素合成关键酶基因(IPI、PSY、BCH和BKT)也在UVB下高表达。但是, 雨生红球藻光受体UVR8是否通过与光信号通路相关蛋白、转录因子直接互作参与调控虾青素合成相关基因的表达, 进而促进虾青素的富集, 尚无实验证据, 有待进一步研究。本文为解析光诱导雨生红球藻虾青素的积累机制提供新的思路, 仍需继续挖掘新的证据深入解析光诱导虾青素合成的转录调控机制。

图7 雨生红球藻响应UV-B辐射光信号通路预测Fig. 7 Prediction of response pathway of H. pluvialis to UV-B radiation

