苦荞脂氧合酶基因家族的鉴定及其在铝胁迫应答中的表达
仲雪婷,徐 鸿,李鑫鑫,孙若嘉,付文英,李佳鹏,杨莲莲,吴酬飞,张立钦,王占旗
(1.湖州师范学院 生命科学学院,浙江 湖州 313000;2.湖州师范学院 浙江省媒介生物学与病原控制重点实验室,浙江 湖州 313000)
铝(Al)是地壳中含量最丰富的金属元素,也是土壤无机矿物的主要元素[1].在酸性条件下,特别是当pH低于5.5时,铝会从化合态转变为离子态释放到土壤溶液中[2].此时,即使在微摩尔(μM)浓度下,铝离子(Al3+)也会对植物造成伤害,抑制植物根的生长,影响植物对水分和养分的吸收,从而增加植物对其它类型胁迫的敏感性[3].因此,铝胁迫被认为是威胁全球作物生产和粮食安全的主要环境限制因素之一[4-5].
脂氧合酶(LOX,EC 1.13.11.12)是一种非血红素含铁双加氧酶,具有催化多不饱和脂肪酸双加氧生成相应的过氧化物能力[6].LOX结构域是由5个保守的组氨酸(His)残基形成的与铁原子结合相关的功能结构[His-(X)4-His-(X)4-His-(X)17-His-(X)8-His].根据多不饱和脂肪酸碳原子氧化的位置,植物LOX可分为2个亚家族,即9-LOX和13-LOX[7].LOX广泛参与植物的生长、发育,以及生物和非生物的胁迫应答[8-10].
苦荞是一种被广泛种植的药食同源作物,具有较高的经济和营养价值[11].近年来,随着种植规模的不断扩大和极端天气的肆虐,苦荞受到了寒冷[12]、干旱[13]、高温[14]等非生物胁迫的严重危害.然而,苦荞对铝胁迫的响应机制却很少受到关注.本研究通过生物信息学方法系统地鉴定苦荞LOX基因家族,分析其染色体定位、进化关系和组织表达模式,并进一步利用荧光定量PCR(qRT-PCR)分析苦荞FtLOX基因在铝胁迫条件下的表达水平,最终鉴定出6个铝响应的FtLOX基因,其中FtLOX6、FtLOX8和FtLOX9可能在苦荞铝胁迫应答中起着重要作用.
1 材料与方法
1.1 FtLOX基因的鉴定
苦荞基因组序列下载自Tartary Buckwheat Genome Project(http:∥mbkbase.org/Pinku1)[11].根据拟南芥、水稻和番茄LOX的蛋白序列,利用HMMER软件(v.3.2.1)[15]构建LOX蛋白的隐马尔可夫模型(HMM),并检索苦荞全蛋白质数据库.通过InterPro数据库(http:∥www.ebi.ac.uk/interpro)进一步分析在苦荞候选LOX蛋白中是否含有保守的结构域PLAT/LH2(IPR001024)和LOX(IPR036226)[16],去除不包含PLAT/LH2和LOX结构域的候选蛋白,其对应的编码基因即为FtLOX基因家族,并利用pI/Mw工具(https:∥web.expasy.org/compute_pi/)对FtLOX蛋白的等电点(pI)和分子量(MW)进行计算.
1.2 多序列比对和系统进化树构建
利用MEGA 7.0中的MUSCLE程序进行多序列比对,并采用neighbor-joining(NJ)法和MEGA 7.0[17]进行系统进化树构建,每个分支抽样1 000次.
1.3 基因结构分析
基因结构和启动子数据下载自Tartary Buckwheat Genome Project(http:∥mbkbase.org/Pinku1)[11].使用在线工具GSDS 2.0(http:∥gsds.gao-lab.org/)[18]分析基因结构.
1.4 基因染色体定位和进化分析
基因定位数据下载自Tartary Buckwheat Genome Project(http:∥mbkbase.org/Pinku1)[11],并利用TBtools(v.1.045)[19]进行基因定位可视化.串联重复和片段重复分析按照Yang[20]和Wang[21]等方法进行.利用DnaSP 6[22]计算重复基因对的Ka、Ks和Ka/Ks值.
1.5 基因组织特异性分析
基因组织特异性分析数据下载自RNA-Seq数据,主要包括SRR5433734、SRR5433731、SRR5433730、SRR5433732、SRR5006770和SRR5433733[11].苦荞不同组织的选取按照Liu等[23]的研究方法进行,主要包括根、茎、叶、花、果实和种子等,分析结果利用TBtools(v.1.045)[19]进行基因组织表达可视化.
1.6 铝胁迫处理
本研究采用苦荞栽培种“西荞2号”为实验材料,种子购于四川省凉山州乔良种业有限责任公司.首先用1% NaCIO(V/V)对苦荞种子消毒5 min,灭菌水洗涤8次,再用去离子水在25 ℃的黑暗条件下浸种 12 h;将发芽的种子转移到浮漂上,置于0.5 mM的CaCl2溶液(pH 5.5)中,在25 ℃的黑暗条件下培养3 d后将生长一致的苦荞幼苗置于0.5 mM的CaCl2溶液(pH 4.5)中培养12 h,再将其随机分组分别置于含有0或50 μM AlCl3的0.5 mM的CaCl2溶液(pH 4.5)中处理6 h;收集根尖(0~1 cm)和基本根(1~2 cm)用于RNA提取.每个处理进行3个生物学重复.
1.7 RNA提取、逆转录和qRT-PCR分析
利用试剂盒Plant RNeasy Kit(Qiagen),按照说明书对样品总RNA进行提取.利用试剂盒ReverTra Ace qPCR Master Mix(Toyobo)从1 μg总RNA逆转合成cDNA.在CFX96荧光定量PCR仪(Bio-Rad)上进行qRT-PCR,采用2-ΔΔCT方法计算基因相对表达量,FtH3用作内参基因[23].本研究使用的引物见表1.结果显示为3个生物学重复的平均值±标准差.使用统计软件(DPS,v15.10)对数据进行显著性分析,P<0.05表示差异具有显著性[24].

表1 研究中的引物Tab.1 List of primers used in this study
2 结 果
2.1 FtLOX基因家族的鉴定
本研究共鉴定10个FtLOX基因家族成员,根据染色体位置,将其命名为FtLOX1~FtLOX10(表2).鉴定出FtLOX基因的基因组DNA大小为3 711~8 621 bp,其编码的FtLOX蛋白大小为732~906 aa,它们的等电点和分子量分别为5.6~7.9和83.1~102.3 kDa(表2).多序列比对分析表明:在FtLOX蛋白中存在一个典型的由38个氨基酸组成的基序[His-(X)4-His-(X)4-His-(X)17-His-(X)8-His][6],该基序在所有的FtLOX蛋白中是严格保守的(图1A).对这10个苦荞FtLOXs、6个拟南芥AtLOXs、14个水稻OsLOXs和14个番茄SlLOXs进行系统进化分析,结果表明:FtLOXs可分为9-LOX和Ⅱ型13-LOX两个亚家族,其中9-LOX包括FtLOX5、-8和-9,Ⅱ型13-LOX包括FtLOX1、-2、-3、-4、-6、-7和-10(图1B).分析结果还表明:苦荞FtLOXs与番茄SlLOXs的亲缘关系比与拟南芥和水稻LOXs的亲缘关系更相近,这与目前建立的高等植物LOX基因间的进化关系一致[8,10,25].
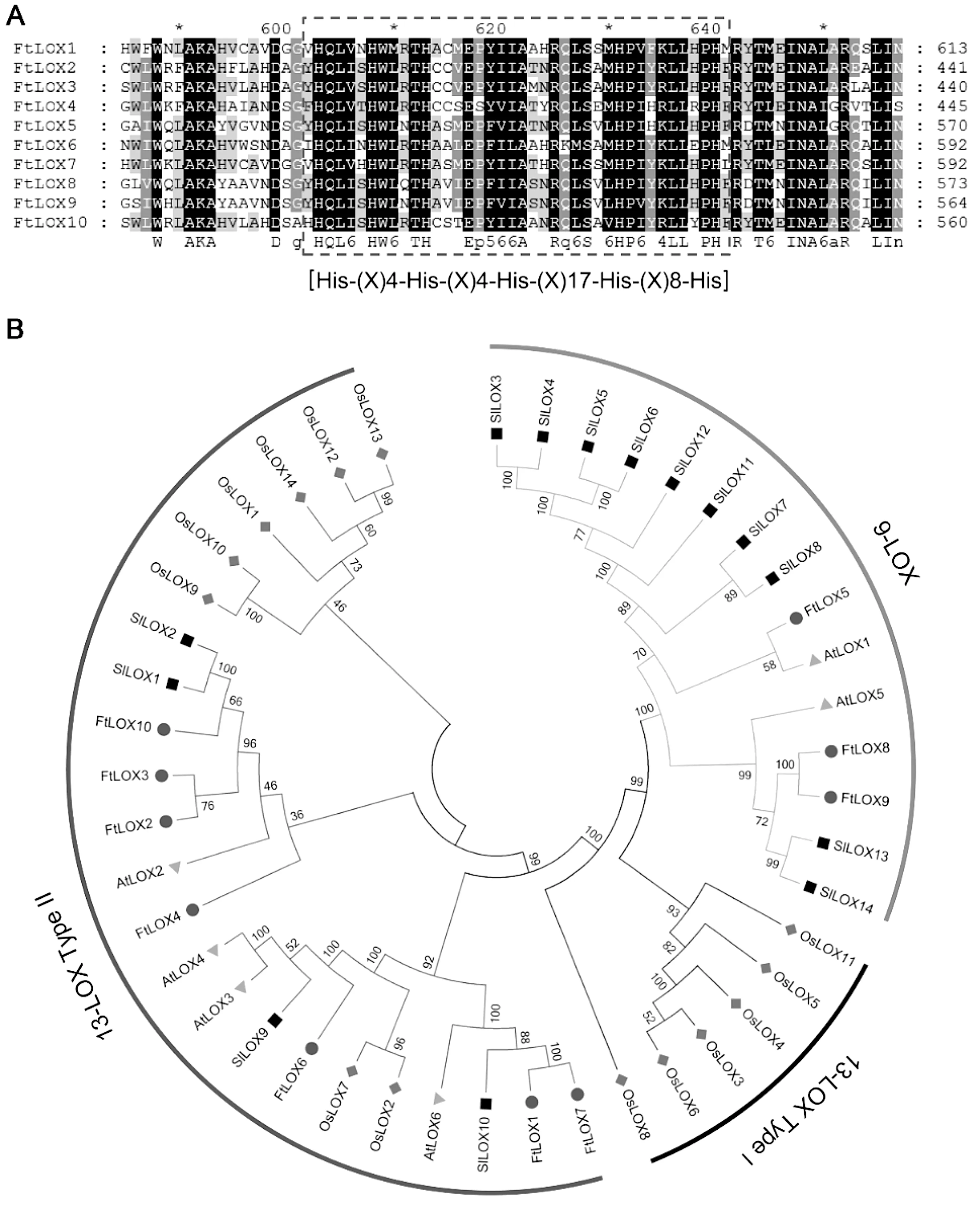
图1 苦荞FtLOXs多序列比对和系统进化分析Fig.1 Multiple sequence alignment and phylogenetic analyses of FtLOXs in tartary buckwheat

表2 苦荞脂氧合酶(FtLOX)基因家族的基因结构和理化特性Tab.2 Structural and physicochemical features of lipoxygenase (LOX)gene family in tartary buckwheat
2.2 FtLOX基因的结构分析
基因家族中基因结构的差异性通常在该基因家族的进化中起着重要作用[26].为进一步获得FtLOX基因结构与进化的关系,本研究用邻接法(NJ)构建FtLOX基因家族的系统进化树,并利用在线工具GSDS 2.0[18]分析FtLOX基因家族的基因结构.如图2所示,FtLOX家族含有7~10个外显子,其中FtLOX3的外显子最少(7个),FtLOX7的外显子最多(10个),且无论它们属于哪个亚家族,大多数FtLOX基因的外显子数量和大小都是相似的.这表明苦荞FtLOX的两个亚家族之间存在相似的进化和扩展进程.

图2 苦荞FtLOXs的基因结构和分子进化的关系Fig.2 Molecular phylogenetic and gene structure relationship of FtLOXs in tartary buckwheat
2.3 FtLOX基因的染色体定位和复制分析
为进一步了解FtLOX基因家族在苦荞基因组上的分布,本研究利用从苦荞基因组中提取的位置信息对FtLOX基因进行染色体定位分析.如图3所示,10个FtLOXs可定位到苦荞的6条染色体上,其中染色体Ft3、Ft5、Ft6、Ft7和Ft8各定位一个FtLOX基因,染色体Ft1定位5个FtLOXs.
本研究还分析了苦荞FtLOXs的基因复制模式,在苦荞基因组中共检测到4个片段重复的FtLOX基因对(80%)和1个串联重复的FtLOX基因对(20%)(图3、表3).这说明片段重复可能是苦荞FtLOXs进化的主要驱动力.为进一步估算进化日期和随后的选择对基因复制的影响,使用DnaSP 6[22]计算其基因对的非同义替换率(Ka)和同义替换率(Ks).前期研究表明:在植物中,Ka/Ks的比值小于0.5,表示片段重复和串联重复事件的净化选择[25].本研究中4个片段重复(FtLOX1/FtLOX7、FtLOX2/FtLOX3、FtLOX2/FtLOX10、FtLOX3/FtLOX10)和1个串联重复(FtLOX3/FtLOX4)的Ka/Ks比值都小于0.5(表3),说明净化选择在苦荞FtLOX基因进化中起着主导作用.按照Koch、Haubold等[27]的研究方法对这些重复事件的进化时间推算表明,4个片段重复可能发生在约4 290万年至9 250万年前,1个串联重复发生在约4 720 万年前(表3).

图3 苦荞FtLOXs的染色体定位和复制情况Fig.3 Localization and duplication events of FtLOXs in tartary buckwheat

表3 苦荞FtLOXs重复基因对差异Tab.3 Divergence between duplicated FtLOXs gene pairs in tartary buckwheat
a:Ka/Ks ratio<0.5认为是净化选择.
2.4 FtLOX基因的组织表达模式
本研究进一步使用公开的RNA-Seq数据[11]分析FtLOXs在苦荞不同组织(根、茎、叶、花、果实和种子)中的表达模式,结果表明(表4、图4):所有的FtLOXs至少在一个组织中表达;6个FtLOX基因(FtLOX3和FtLOX5-9)均能在所有的受试组织中检测到(FPKM ≥ 1.0),在茎和叶中能检测到所有FtLOX基因中有8个基因(FtLOX1、FtLOX3、FtLOX5-10)在根中高水平表达,其中表达水平最高的两个基因是FtLOX6(FPKM ≥ 92.0)和FtLOX5(FPKM ≥ 68.0);串联重复的基因(FtLOX3和FtLOX4)在受试组织中呈现出显著的不同表达模式,说明它们在功能上是不同的.这些结果符合植物LOX串联重复基因的功能进化特性[10].

表4 苦荞FtLOXs的组织表达模式Tab.4 Tissue expression profiles of FtLOXs

图4 苦荞FtLOXs在不同组织中的表达模式Fig.4 Expression patterns of FtLOXs in different tissues of tartary buckwheat
2.5 铝胁迫下FtLOX基因的表达分析
已有研究表明,LOX基因可能参与植物铝胁迫的应答[28].本研究利用qRT-PCR技术研究在铝胁迫下苦荞根尖和基本根中FtLOX基因的表达谱,结果表明:FtLOX1和FtLOX10在基本根中的表达不受铝的影响,FtLOX10在根尖中的表达略有增加(图5中(a)(h)).相反,FtLOX5和FtLOX7在根尖中的表达不受铝的影响,但在基本根中的表达受到铝的抑制(图5中(c)(e)).此外,铝能够显著地诱导FtLOX3、FtLOX6、FtLOX8和FtLOX9在苦荞根尖和基本根中的表达(图5中(b)(d)(f)(g)),说明这些FtLOX基因可能在铝胁迫应答中发挥重要作用.考虑到FtLOXs在根中的表达模式(表4、图4),推测FtLOX8、FtLOX9特别是FtLOX6可能在苦荞铝胁迫应答中起着关键作用.
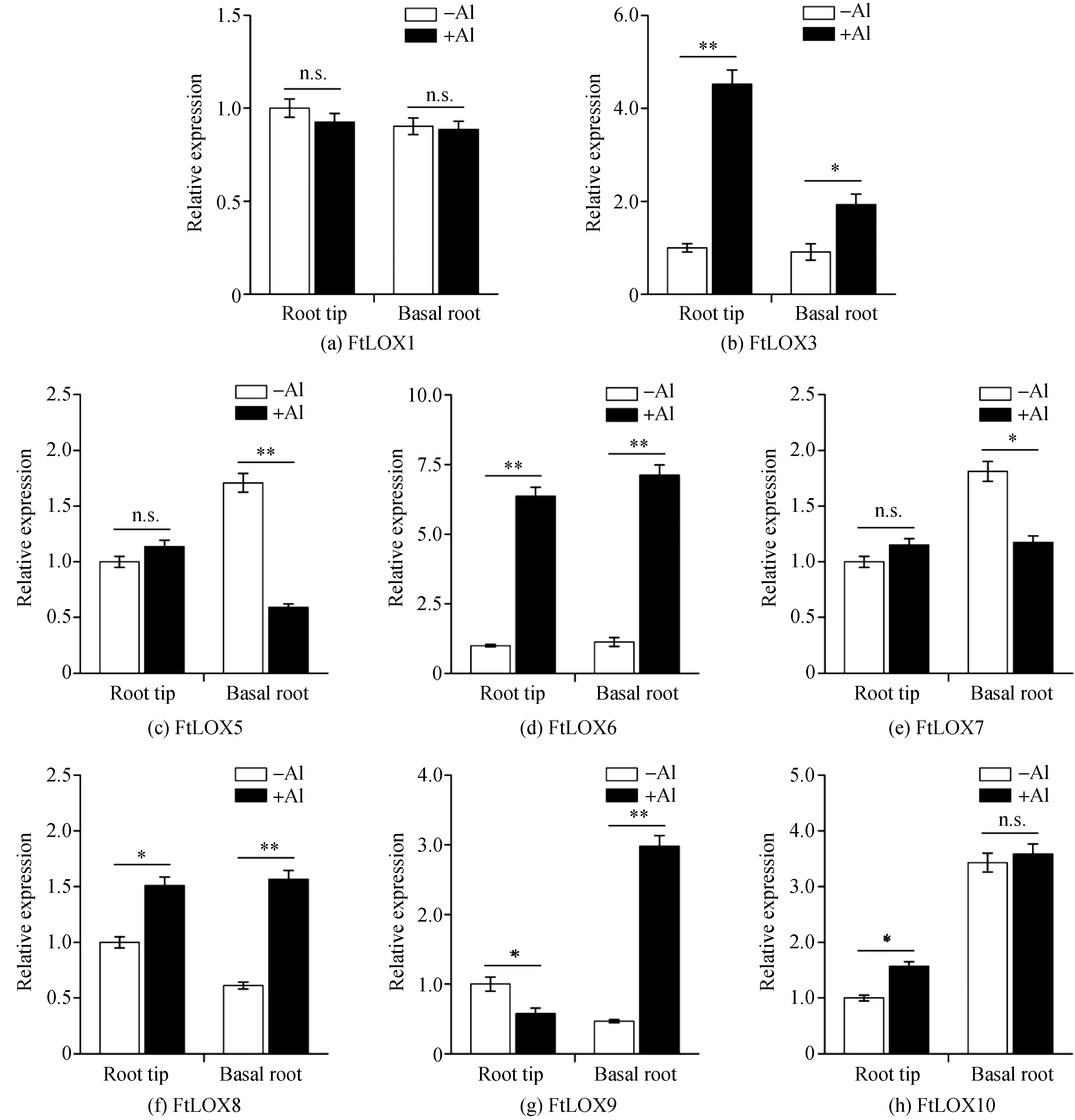
注:“*”表示P<0.05,“**”表示P<0.01,n.s.表示不具有显著性差异.图5 qRT-PCR分析铝胁迫下苦荞FtLOX基因的表达水平Fig.5 qRT-PCR analysis of FtLOX genes expression of tartary buckwheat under aluminum stress
3 讨 论
本研究鉴定了苦荞的LOX基因家族,该家族由10个FtLOX成员组成.根据拟南芥、水稻和番茄LOX蛋白的氨基酸序列与系统发育关系,这10个FtLOXs可以分为两个亚家族,即9-LOX和13-LOX(图1B).这一结果与之前对其它植物中LOXs的研究结果一致[8,10,25].此外,基因结构分析也支持FtLOXs的这一分类,每个亚家族成员间都有相似的结构域和基因结构(图2).序列分析表明:所有的FtLOXs都具有保守的植物LOX蛋白结构域和典型的基序,包括一个由38个氨基酸组成的基序[His-(X)4-His-(X)4-His-(X)17-His-(X)8-His](图1中A),这个保守基序对高等植物LOX的稳定性和酶活性至关重要[8,25].
基因复制事件包括片段重复和串联重复,在基因组重排和基因家族的扩增中起着重要作用[21].本研究鉴定到4个片段重复基因对和1个串联重复基因对参与FtLOX基因的复制(图3、表3),表明片段重复可能是FtLOX基因家族扩增的主要基因复制事件.这一发现与之前的研究结果一致[11].此外,本研究中片段重复基因对和串联重复基因对的Ka/Ks比值都小于0.5,表明净化选择在FtLOX基因家族的进化中起主导作用.
研究表明,LOX基因在植物生长、发育和果实成熟中发挥着重要作用[9-10],基因表达模式往往可以提供基因潜在功能的关键信息[4].本研究使用公开的RNA-Seq数据分析FtLOXs在根、茎、叶、花、果实和种子中的表达水平,结果表明:大多数FtLOXs在所有受试组织中均有表达(表4、图4),说明它们可能在苦荞的生长和发育中起重要作用.这一结果证实了先前的报道,LOXs在植物生长和发育中具有重要功能[8,10].研究还发现,某些FtLOX基因在特定组织中的表达水平明显较高,如叶中的FtLOX3和FtLOX4、根中的FtLOX5、根和茎中的FtLOX6,以及叶和花中的FtLOX7(表4、图4),说明这些基因在这些组织中可能具有重要功能.
铝胁迫是威胁全球农业生产的一个主要问题.尽管苦荞是一种耐铝作物,但在生长和发育过程中也常常受到铝胁迫的影响[11,29].qRT-PCR分析表明,铝能够显著地诱导FtLOX6、FtLOX8和FtLOX9在苦荞根尖和基本根中的表达(图5中(d)(f)(g)),说明这些基因在铝胁迫应答中可能发挥了作用.因此,本研究结果有助于阐明LOX基因家族的扩增和进一步分析其在苦荞铝抗性中的功能.
4 结 论
本研究在苦荞全基因组范围内鉴定了10个FtLOX基因,为苦荞FtLOX基因家族的功能分析提供了重要信息.组织特异性表达分析表明,FtLOX基因可能参与苦荞营养器官和生殖器官的发育.qRT-PCR分析表明,铝胁迫可以显著地诱导FtLOX3、FtLOX6、FtLOX8和FtLOX9基因的表达,抑制FtLOX5和FtLOX7基因的表达.这些结果有助于进一步探索FtLOX基因介导的铝胁迫响应过程和分子机制,能为系统地研究苦荞FtLOX基因家族的功能提供重要依据.

